2. 中国医学科学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
巴戟天为茜草科植物巴戟天(Morinda officinalis How)的干燥根,具有补肾阳、强筋骨、祛风湿的功效,主要分布在我国的广东、海南、广西、福建等热带和亚热带地区[1-2]。巴戟天主要含有蒽醌和环烯醚萜苷等类成分[3-4],其中环烯醚萜苷类成分具有较强的抗炎镇痛作用[5],水晶兰苷具有促进去卵巢小鼠成骨细胞的形成和抑制骨流失的作用,与巴戟天传统功效密切相关[6]。目前,国内外报道从巴戟天中分离鉴定的环烯醚萜苷化合物主要有水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷等7个[7]。巴戟天中水晶兰苷和去乙酰车叶草苷酸的HPLC定量分析方法已有少量报道[8-11],但UPLC-MS/MS同时测定巴戟天中主要环烯醚萜苷的研究还未见报道。
中药成分复杂,提取方法对获得准确的定量分析结果尤为重要。为了更全面评价巴戟天的质量,本实验比较了超声提取、加热回流提取和加速溶剂萃取3种方法对巴戟天中水晶兰苷、去乙酰车叶草苷酸,车叶草苷酸和车叶草苷提取率的影响,并采用LC-MS/MS法同时测定这4种成分的含量,通过对样品回流条件、色谱和质谱条件的优化,建立了一种简单、快速、准确的环烯醚萜苷分析检测方法,为巴戟天药材质量评价及开发提供技术支持。
1 仪器与材料Waters Acquity™ UPLC色谱仪(Waters公司);Waters Xevo TQ-S三重四极杆串联质谱检测器(Waters公司);ASE350型加速溶剂萃取仪(Thermo Scientific公司);KQ-500DE型超声波清洗器(昆山市超声仪器有限公司);DK-S型电热恒温水浴锅(上海森信实验仪器有限公司);XS105DU十万分之一电子分析天平(上海托利多有限公司);Mili-Q超纯水系统(Millipore公司)。
巴戟天分别采自海南、广东、广西和福建等省,经笔者鉴定为茜草科植物巴戟天Morinda officinalis How的根。水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷对照品购自上海同田生物科技有限公司;棕车菊素(内标)购自成都克洛玛生物科技有限公司;对照品和内标的纯度均大于98%;乙腈、甲醇为色谱纯(Fisher),其他试剂为分析纯。
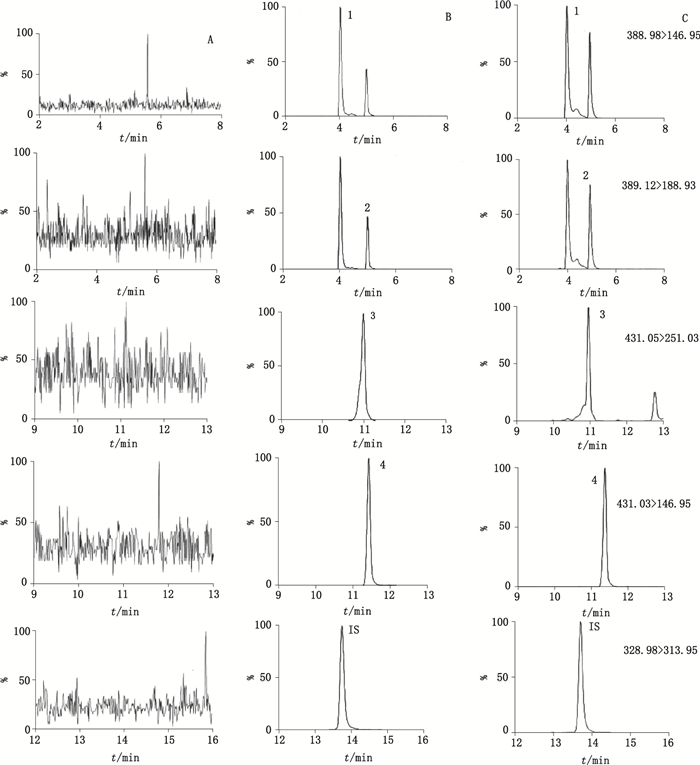
2 方法与结果 2.1 色谱、质谱条件色谱柱:Waters Xbridge BEH C18(150 mm×4.6 mm,5 μm);柱温:40 ℃;流动相:乙腈(A)-0.3%(v/v)甲酸水溶液(B),梯度洗脱(0~5 min,7%→10%A;5~8 min,10%→45% A;8~13 min,45%→60% A;13~22 min,60%→90%A;22~25 min,90% A;25~30 min,90%→7% A);流速:0.4 mL·min-1;进样体积:5 μL。质谱离子源为电喷雾离子化源(ESI);负离子多反应监测模式(MRM);毛细管电压2.5 kV;离子源温度150 ℃;去溶剂温度350 ℃。4个环烯醚萜苷和棕车菊素的质谱条件见表 1,对照品及样品的色谱图见图 1。
|
|
表 1 目标成分和内标的MS参数 Table 1 MS parameters of the target analytes and jaceosidin |
|
1.水晶兰苷(monotropein)2.去乙酰车叶草苷酸(deacetyl asperulosidic acid)3.车叶草苷酸(asperulosidic acid)4.车叶草苷(asperuloside) 图 1 目标物和内标在空白甲醇(A)、对照品(B)和样品(C)中的多反应监测扫面下的LC-MS/MS色谱图 Figure 1 Typical LC-MS/MS MRM chromatograms of blank methanol(A), reference substances of each analyte and IS(B) and Morindae Officinalis Radix sample(C) |
精密称取水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷的对照品适量,置于5 mL量瓶中,甲醇溶解并定容至刻度,配成质量浓度分别为159.3、192、42和75 μg·mL-1的混和对照品储备液。精密称取棕车菊素对照品适量,用甲醇溶液配制成质量浓度为1.6 μg·mL-1的内标溶液,备用。
2.2.2 供试品溶液 2.2.2.1 回流提取准确称取巴戟天粉末1.0 g,置于50 mL圆底烧瓶中,加入甲醇25 mL,称定,加热(70 ℃)回流1 h,冷却至室温,用甲醇补足减失的量,摇匀,过滤。取滤液0.5 mL,精密加入内标溶液0.5 mL,摇匀,过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
2.2.2.2 超声提取准确称取巴戟天粉末1.0 g,置于50 mL具塞三角瓶中,加入甲醇25 mL,称量,室温超声(40 kHz,500 W)提取1 h,冷却至室温,用甲醇补足减失的量,摇匀,过滤。取滤液0.5 mL,精密加入内标溶液0.5 mL,摇匀,过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
2.2.2.3 加速溶剂萃取准确称取巴戟天粉末1.0 g,加入硅藻土1.0 g,在研钵中研磨均匀,装入34 mL萃取池中。以体积分数为60%的甲醇溶液为萃取溶剂,萃取温度70 ℃,压力4.8 MPa,加热10 min,静态萃取15 min,循环2次,用体积60%的甲醇冲洗萃取池,并用氮气吹扫100 s,萃取液收集于250 mL收集瓶中,减压浓缩,用甲醇定容至25 mL量瓶中,过滤。取滤液0.5 mL,精密加入内标溶液0.5 mL,摇匀,过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
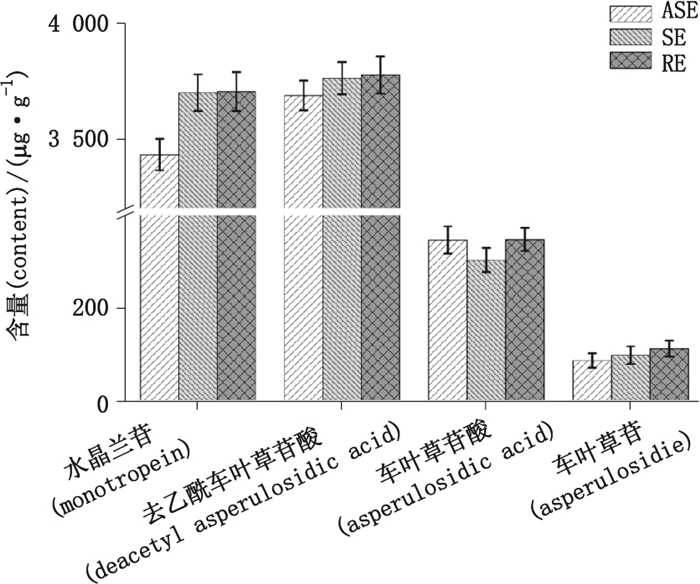
2.3 提取方法的比较比较了回流提取(RE)、超声提取(SE)和加速溶剂萃取(ASE)3种提取方法对4种目标物含量的影响,结果见图 2。由图可知,3种方法对目标物的提取率差异显著。加速溶剂萃取对水晶兰苷和去乙酰车叶草苷酸的提取效果显著低于回流提取和超声提取,而这2种方法对目标物含量的影响不大;超声提取对车叶草苷酸的提取率低于另外2种方法;回流提取对车叶草苷的提取效果也较好。本实验结果表明加热回流提取适合作为巴戟天中4种环烯醚萜苷的提取方法。
|
图 2 加热回流、超声和加速溶剂萃取对目标物含量的影响 Figure 2 Effects of reflux, ultrasonic and accelerated solvent extraction on the content of analytes |
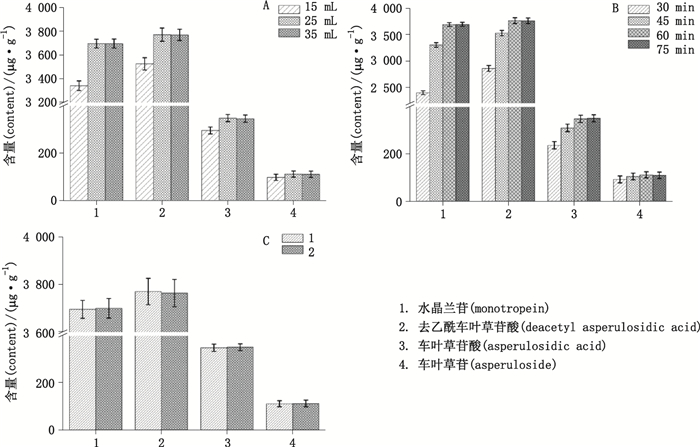
实验中考察了影响加热回流提取的因素:提取溶剂的体积(15、25和35 mL甲醇),提取时间(30、45、60和75 min),提取次数(1次和2次)。结果显示(图 3),当甲醇体积大于25 mL和提取时间大于60 min时,水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷的含量没有显著增加;而提取次数对目标物提取率没有影响,因此巴戟天样品提取的条件为25 mL甲醇加热回流提取60 min,提取1次。
|
图 3 提取溶剂体积(A)、提取时间(B)和提取次数(C)对目标物提取率的影响 Figure 3 Effects of extraction solvent volume(A), extraction time(B) and repetitions(C) on extraction efficiency of the 4 analytes in the Morindae Officinalis Radix. |
用甲醇将混合对照品储备液稀释为不同浓度的混合对照品溶液,精密加入内标溶液适量,使内标质量浓度为0.8 μg·mL-1,进样前用0.22 μm微孔滤膜过滤。按照“2.1”项下的条件进行测定。以对照品的峰面积与相应内标峰面积的比值Y,及对应的浓度X进行线性回归,分别以信噪比为3和10求得各组分的检测下限和定量下限,结果见表 2。
|
|
表 2 线性方程,线性范围,定量下限和检测下限 Table 2 Linear equation, linear range, LOD and LOQ |
取水晶兰苷质量浓度为10.62 μg·mL-1的混合对照品溶液(内标浓度为0.8 μg·mL-1),连续进样6次,记录峰面积,以待测峰与内标峰面积比计算RSD,结果均小于5.0%,表明仪器精密度良好。取此溶液分别于0、2、4、8、16、24 h时间点进样,计算各成分与内标峰面积比值的RSD,结果RSD均小于5.0%,表明溶液中被测成分在24 h内稳定。
2.5.3 重复性试验按照“2.2.2.1”项下回流法制备样品(S6)的供试品溶液6份,分别进样测定。结果水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸、车叶草甘的平均含量分别为3 457.33、3 763.56、236.47、109.35 μg·g-1,RSD均小于4.5%,表明该方法的重复性良好。
2.5.4 加样回收试验取6份已知含量的同一批巴戟天样品(S6)各0.5 g精密称定,精密加入适当浓度的对照品溶液(相当于供试药材原有含量质量分数的100%),按照“2.2.2.1”项下回流提取制备供试溶液,在上述条件下进样分析。结果水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷的的平均回收率分别为99.4%、98.5%、98.1%和97.7%,RSD分别为2.3%、2.5%、3.5%和4.1%。
2.6 含量测定分别准确称取不同产地的巴戟天药材粉末1.0 g,按照“2.2.2.1”项下回流提取方法制备供试品溶液,在上述色谱条件下进样测定(n=3),依据内标法计算水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷的含量,结果见表 3。
|
|
表 3 巴戟天中4个成分的含量测定结果(μg·g-1,n=3) Table 3 Quantitative analytical results of the four constituents in Morindae Officinalis Radix |
目前巴戟天中环烯醚萜苷类成分的含量测定使用的是HPLC法[2, 8-11],但存在分析方法时间较长,灵敏度较低等问题。UPLC-MS/MS具有分析时间短,高灵敏度,专属性强的特点,在中药化学成分分析,中药质量控制、中药代谢产物鉴定等方面广泛应用[12]。本实验采用LC-MS/MS法同时测定4个成分,负离子多反应监测被测成分的离子对,样品中其他成分不会对待测成分产生干扰,克服了HPLC分离度差的问题。同时可以在短时间内快速分离水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷4个成分。
3.2 流动相的选择本研究考察了不同配比乙腈-水、甲醇-水以及含有甲酸、乙酸等含酸溶液作为流动相对环烯醚萜苷的分离能力的影响。水晶兰苷等目标物母环上含有-COOH基团,具有一定的酸性。文献中流动相使用磷酸的较多,但该酸不适合在质谱上使用,通过预实验最终确定乙腈-0.3%甲酸水溶液作为流动相,梯度洗脱,在该系统下4个成分得到较好的保留和分离。
3.3 定量分析结果刘瑾、仰铁锤和王玉磊等[2, 8-9]报道了不同产地巴戟天中水晶兰苷和去乙酰车叶草苷酸的含量,范围分别在1.27~21.78 mg·g-1和3.16~5.01 mg·g-1之间。本文报道的2种成分的含量范围分别在1.45~3.49 mg·g-1和1.09~3.80 mg·g-1之间,与文献报道的结果相似,水晶兰苷和去乙酰车叶草苷酸是巴戟天中环烯醚萜苷的主要成分。但车叶草苷和车叶草苷酸2种成分含量相对较低,并且不同产地含量的变异幅度较大,这可能与巴戟天种植环境和栽培技术有关。本文结果为巴戟天中环烯醚萜苷含量测定,标记物的选择,制定其含量范围,质量控制提供了科学依据。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 81 ChP 2015. Vol Ⅰ[S]. 2015: 81 |
| [2] |
刘瑾, 徐吉银, 罗进辉, 等. 不同产地巴戟天中水晶兰苷的含量测定[J]. 中成药, 2010, 32(3): 517. LIU J, XU JY, LUO JH, et al. Determination of monotropein in Morinda officinalis from different areas[J]. Chin Tradit Pat Med, 2010, 32(3): 517. DOI:10.3969/j.issn.1001-1528.2010.03.054 |
| [3] |
ZHANG HL, ZHANG QW, ZHANG XQ, et al. Chemical constituents from the roots of Morinda officinalis[J]. Chin J Nat Med, 2015, 8(3): 192. |
| [4] |
景海漪, 史辑, 崔妮, 等. 巴戟天炮制前后寡糖类成分HPLC-CAD指纹图谱研究[J]. 中草药, 2014, 45(10): 1412. JING HY, SHI J, CUI N, et al. Fingerprints of oligosaccharides in Morinda officinalis before and after processing by HPLC-CAD[J]. Chin Tradit Herb Drugs, 2014, 45(10): 1412. DOI:10.7501/j.issn.0253-2670.2014.10.012 |
| [5] |
CHOI J, LEE K, CHOI M, et al. Antinociceptive anti-inflammatory effect of monotropein isolated from the root of Morinda officinalis[J]. Biol Pharm Bull, 2005, 28: 1915. DOI:10.1248/bpb.28.1915 |
| [6] |
ZHANG ZG, ZHANG QY, YANG H, et al. Monotropein isolated from the roots of Morinda officinalis increases osteoblastic bone formation and prevents bone loss in ovariectomized mice[J]. Fitoterapia, 2016, 110: 166. DOI:10.1016/j.fitote.2016.03.013 |
| [7] |
黄珍珍. 巴戟天的化学成分及其生物活性研究[D]. 广州: 广州中医药大学, 2013 HUANG ZZ. Studies on Chemical Constituents and Their Bioactivities of Morinda officinalis[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2013 |
| [8] |
仰铁锤, 徐吉银, 梁英娇, 等. HPLC测定巴戟天中的水晶兰苷[J]. 华西药学杂志, 2008, 23(6): 695. YANG TC, XU JY, LIANG YJ, et al. Determination of monotropein from Radix Morinda officinalis by HPLC[J]. West China J Pharm Sci, 2008, 23(6): 695. DOI:10.3969/j.issn.1006-0103.2008.06.028 |
| [9] |
王玉磊, 崔翰明, 黄世敬, 等. HPLC测定不同产地和批次巴戟天中主要环烯醚萜苷含量[J]. 中药材, 2011, 34(8): 1187. WANG YL, CUI HM, HUANG SJ, et al. Determination of main iridoid glucosides from Morindae Officinalis Radix of different producting areas by HPLC[J]. J Chin Med Mater, 2011, 34(8): 1187. |
| [10] |
LI CM, DONG J, TIAN JC, et al. LC/MS/MS determination and pharmacokinetic study of iridoid glycosides monotropein and deacetylasperulosidic acid isomers in rat plasma after oral administration of Morinda officinalis extract[J]. Biomed Chromatogr, 2016, 30: 163. DOI:10.1002/bmc.v30.2 |
| [11] |
徐吉银, 梁英娇, 丁平. 炮制方法对巴戟天有效成分水晶兰苷含量的影响[J]. 中药材, 2007, 30(1): 20. XU JY, LIANG YJ, DING P. Determination of monotropein in Radix Morinda officinalis from different processed products by HPLC[J]. J Chin Med Mater, 2007, 30(1): 20. DOI:10.3321/j.issn:1001-4454.2007.01.008 |
| [12] |
陈黎, 刘春霞, 何秀丽, 等. LC-MS/MS法同时测定中药白及中militarine、原儿茶酸和咖啡酸的含量[J]. 中国药师, 2015, 18(2): 230. CHEN L, LIU CX, HE XL, et al. Simultaneous determination of militarine, protocatechuic acid and caffeic acid in Bletilla striata by LC-MS/MS[J]. China Pharm, 2015, 18(2): 230. DOI:10.3969/j.issn.1008-049X.2015.02.015 |
 2018, Vol. 38
2018, Vol. 38 