2. 中国食品药品检定研究院, 北京, 100050
2. National Institutes for Food and Drug Control, Beijing 100050, china
复方氨基酸(15)双肽(2)注射液由15种L-氨基酸和2种二肽组成,为肠外营养制剂,通过肠外营养提供氨基酸。应用于不能口服或经肠道补给营养,以及营养不能满足需要的患者,特别是处于高分解代谢的患者。
醋酸主要来源于制剂处方中醋酸赖氨酸原料药,为游离赖氨酸的酸配基,同时制剂过程中调节pH也可能引入醋酸。醋酸含量的高低会影响注射液的pH,而pH对产品的稳定性起着决定性作用,水解、氧化、变色、分解以及澄明度等都与pH有关。根据国家食品药品监督管理总局药品审评中心发布的《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》的要求,应当对注射剂仿制药中的辅料(抑菌剂、缓冲剂、抗氧剂等)种类和用量进行控制,建立适宜的剖析注射剂缓冲成分含量测定方法对处方分析和工艺研究具有重要意义。建立复方氨基酸双肽注射液中的醋酸含量测定方法,有助于全面考察注射液的稳定性和安全性,对注射液物质成分全面展现、质量控制和标准完善具有重要意义。
现有的醋酸检测方法主要有气相色谱法[1]、离子色谱法[2-4]、反相高效液相色谱法[5-7]、滴定法[8]等,此外,在复方氨基酸(15)双肽(2)注射液的进口注册标准中采用醋酸专用检测试剂盒测定醋酸含量。气相色谱法和离子色谱法均需要专门仪器,普适性差;试剂盒法成本高,易出现假阳性结果;滴定法灵敏度低,常用于常量组分的分析;高效液相色谱法通用性强,是药物分析最常用方法之一。
离子排斥色谱的色谱柱通常用总体磺化的高容量阳离子交换树脂填充,离子排斥理论认为在分离过程中,固定相表面形成一种Donnan膜,离解型阴离子受Donnan排斥作用无法穿过膜层,而未离解型分子可以通过该膜层与固定相发生相互作用而具有一定的保留作用,从而得到分离,离解度越低的化合物保留值越强[9-10]。
复方氨基酸双肽注射液成分较多,其他组分容易干扰醋酸的测定,本研究团队在前期利用离子排斥色谱法进行单成分肽类药物中弱酸检测研究的基础上[11-13],比较和尝试了离子交换色谱法、高效离子排斥色谱法,以及现有2015年版《中华人民共和国药典》(以下简称《中国药典》)附录收载的合成多肽中醋酸测定法[14](2015年版《中国药典》四部通则0872),发现利用离子交换色谱和药典方法,醋酸的测定均受注射液中其他成分干扰,而离子排斥色谱法中由于待测成分醋酸的pKa值与多种氨基酸主成分的pKa值差异较大,通过调节流动相的酸强度,可实现完全分离,能够较好解决复方氨基酸注射液中的成分干扰问题,方法学验证结果显示建立的方法简单专属、准确耐用,能够较好满足复杂氨基酸体系下醋酸定量要求。
1 仪器与试药 1.1 药品与试剂无水醋酸钠(ThermoFisher公司,批号:161025,纯度:99.90%)。市售复方氨基酸(15)双肽(2)注射液:生产企业A,样品2批(批号:20140801、20140802);生产企业B,样品3批(批号:14121601、14121701、14121801)。硫酸(分析纯,北京化工厂,批号:20130928);超纯水。
1.2 仪器Thermo U-3000双三元液相色谱仪(双三元低压梯度泵,自动在线脱气机,自动进样器,柱温箱,可变波长检测器,变色龙7.2工作站)(ThermoFisher公司,美国);Milli-Q Integral超纯水器(Merck Millipore公司,德国);Mettler Toledo XP205电子分析天平(Mettler-Toledo公司,瑞士)。
2 方法与结果 2.1 色谱条件色谱柱:HyperREZ XP carbohydrate H+(7.7 mm× 300 mm,8 μm);流动相:0.002 5 mol· L-1硫酸;流速:0.5 mL·min-1;柱温:45 ℃;检测波长:210 nm;进样量:10 μL。
2.2 溶液的制备 2.2.1 对照品溶液精密称取无水醋酸钠对照品适量,用超纯水溶解并稀释成每1 mL中约含醋酸钠5.0 mg·m L-1(相当于含醋酸量3.7 mg·m L-1)的溶液,即得。
2.2.2 供试品溶液取复方氨基酸(15)双肽(2)注射液滤过,取续滤液即得。
2.2.3 空白溶液以超纯水作为空白溶液。
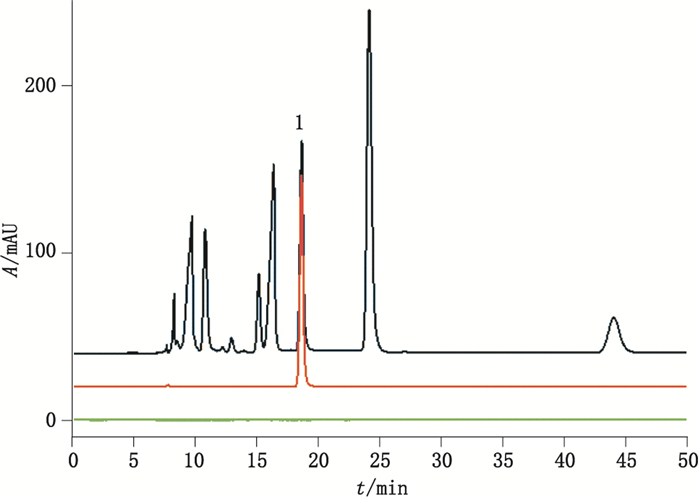
2.3 专属性试验取对照品溶液、供试品溶液和空白溶液各10 μL,分别注入液相色谱仪,记录色谱图。结果醋酸色谱峰保留时间为18.680 min,理论塔板数为21 449,拖尾因子为1.09,醋酸峰与相邻峰的分离度分别为3.82、8.94,见图 1。
|
1.醋酸(acetic acid) A.供试品(test sample)B.醋酸钠对照品(sodium acetate reference substance)C.空白(blank) 图 1 离子排斥色谱法检测醋酸色谱图 Figure 1 Chromatograms of determination of acetic acid by ion exclusion chromatography |
精密称取无水醋酸钠适量,用超纯水溶解并稀释成相当于醋酸质量浓度为0.184 8~7.391 mg·m L-1的溶液,按“2.1”项下色谱条件,进样测定。以进样浓度(X,mg·m L-1)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得回归方程:
| $ Y = 11.232X - 0.292\;5\;\;\;\;r = 1.000\left( {n = 5} \right) $ |
结果表明,醋酸质量浓度在0.184 8~7.391 mg·m L-1范围内线性关系良好。
2.5 定量下限与检测下限取“2.2.1”项下对照品溶液逐级稀释,按“2.1”项下色谱条件进样,并记录色谱图,按信噪比(S/N)为10和3分别计算定量下限和检测下限。结果,醋酸的定量下限为1.478 μg·m L-1,检测下限为0.739 1 μg·m L-1。
2.6 精密度试验精密量取“2.2.1”项下对照品溶液,按“2.1”项下色谱条件连续进样6次,记录色谱图,计算峰面积。结果,醋酸峰面积的RSD(n=6)为0.21%,表明仪器精密度良好。
2.7 重复性试验取生产企业A(批号:20140801)的样品,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定。结果,6份样品中醋酸含量测定结果分别为3.744、3.748、3.737、3.755、3.741、3.775 mg·m L-1,RSD为0.37%,表明方法重复性良好。
2.8 稳定性试验取“2.2.2”项下供试品溶液(批号:20140801),在室温下放置0、3、6、9、12、15、18、21、24 h后,按“2.1”项下色谱条件分别进样测定,记录色谱图。结果在24 h内,供试品溶液中醋酸峰面积的RSD为0.20%,表明供试品溶液在室温下24 h内稳定。
2.9 加样回收率试验取1 mL含醋酸11.30、18.50、26.01 mg·m L-1的对照品溶液分别置10 mL量瓶中,加入供试品溶液(批号:20140801)5.0 mL,用超纯水稀释至刻度,制成含醋酸约为3.0、3.7、4.4 mg·m L-1的溶液。每个浓度点平行制备3份。按“2.1”项下色谱条件进样测定。结果醋酸的加样回收率为101.5%,表明该方法有良好的回收率。
|
|
表 1 加样回收率试验测定结果(n=3) Table 1 Results of recovery test |
考察色谱柱种类、流速、柱温以及流动相硫酸的浓度变化对醋酸含量测定的影响。按“2.2”项下方法制备对照品溶液和供试品溶液,按“2.1”项下色谱条件进样测定。结果流速、柱温以及流动相硫酸的浓度发生微小变化对醋酸含量测定无影响。比较了Rezex ROA-Organic Acid H+(7.8 mm × 300 mm,8 μm)色谱柱和HyperRex XP Carbohydrate H+(7.7 mm × 300 mm,8 μm)色谱柱,结果2种色谱柱差异不大,均符合分离要求,均可用于复方氨基酸双肽注射液中醋酸的检测。
2.11 样品测定按“2.2”项下方法制备对照品溶液和供试品溶液,按“2.1”项下色谱条件,进样,按外标法以峰面积计算醋酸含量。结果2个厂家注射液中醋酸测定含量与理论含量(3.7 mg·m L-1)相当,见表 2。
|
|
表 2 样品含量测定结果 Table 2 Results of content determination of samples |
实验中分别尝试用离子交换色谱法、离子排斥色谱法以及《中国药典》中多肽药物中醋酸检测方法检测复方氨基酸双肽注射液中的醋酸。
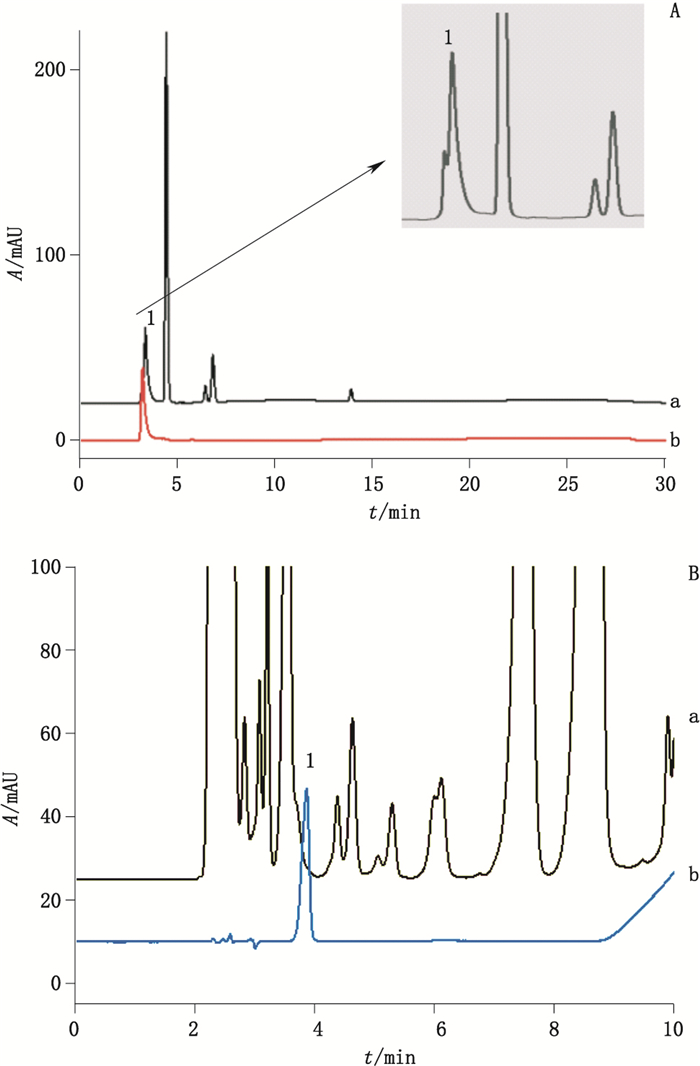
采用Thermo dionex ICS-5000+型离子色谱仪,以离子交换色谱法进行检测,色谱柱为IonPac® AS11-HC阴离子交换色谱柱,自动再生淋洗液发生器产生氢氧化钾淋洗液,采用浓度梯度洗脱,利用抑制性电导检测器进行检测,结果如图 2所示,醋酸在该色谱条件下,保留较差,样品中醋酸峰与其他干扰峰同时出峰,尝试改变淋洗液浓度,也未能改善分离。
|
1.醋酸(acetic acid) a.供试品(test sample)b.醋酸钠对照品(sodium acetate reference substance) 图 2 离子交换色谱法(A)和药典方法(B)检测醋酸色谱图 Figure 2 Chromatograms of determination of acetic acid by ion exchange chromatography(A)and by pharmacopoeia method(B) |
参照2015年版《中国药典》四部通则0872方法,以反相十八烷基键合硅胶色谱柱(250 mm×4.6 mm,5 μm)分离,分离结果如图 2所示,醋酸约在4 min出峰,复方氨基酸双肽注射液中其他成分在醋酸出峰位置存在明显干扰。
采用离子排斥色谱法检测,以紫外检测器210 nm检测,由于醋酸酸性较弱,在色谱柱上获得较好分离,选择并优化流动相浓度,则注射液中其他成分均不干扰醋酸的测定。该方法仅采用稀硫酸做流动相,绿色、环保,普通HPLC即可完成,适合复方氨基酸注射液的质量控制。
3.2 流动相的优化与考察在耐用性试验中,比较了3种不同浓度(0.002 0、0.002 5、0.003 0 mol· L-1)硫酸对分离的影响,发现硫酸浓度的微小变化,醋酸的保留时间基本不变,样品中其他成分的出峰位置会发生少许改变,但不影响醋酸的检测。当把硫酸浓度增加到0.005 0 mol· L-1时,由于抑制程度的增强,醋酸峰邻近的峰保留增强,与醋酸峰发生部分重叠,不能达到基线分离,从而影响检测。
本实验建立了测定复方氨基酸(15)双肽(2)注射液中醋酸含量的方法,该方法在普通HPLC设备上以稀硫酸作为流动相,不需要有机试剂,环保、简便,方法专属、灵敏,能够准确测定复方氨基酸双肽注射液中的醋酸含量,为复方氨基酸双肽注射液中醋酸的质量控制提供了参考。
| [1] |
周晖, 王东凯. 气相色谱法对自制生长抑素中醋酸含量的测定[J]. 中国医科大学学报, 2004, 33(3): 280. ZHOU H, WANG DK. Determination of acetic acid in self-made somatostatin by GC[J]. J Chin Med Univ, 2004, 33(3): 280. |
| [2] |
白海娇. 离子色谱法测定复方氨基酸注射液(20AA)中醋酸根[J]. 现代药物与临床, 2014, 29(5): 494. BAI HJ. Determination of acetate ion in compound amino acid injection (20AA) by ion chromatography[J]. Mod Med Clin, 2014, 29(5): 494. |
| [3] |
邓锋, 林向华. 离子色谱法测定合成多肽类药物中醋酸的含量[J]. 中国当代医药, 2014, 21(22): 56. DENG F, LIN XH. Content of acetic acid in synthetic polypeptide drugs determined by ion chromatography[J]. China Mod Med, 2014, 21(22): 56. |
| [4] |
闻宏亮, 赵敬丹, 秦峰, 等. 离子色谱法测定注射用氯唑西林钠中醋酸根离子含量[J]. 药物分析杂志, 2016, 36(7): 1268. WEN HL, ZHAO JD, QIN F, et al. Determination of acetate ion in cloxacillin sodium for injection by ion chromatography[J]. Chin J Pharm Anal, 2016, 36(7): 1268. |
| [5] |
黄萍, 杨秀丽, 王洋. 高效液相色谱法测定醋酸奥曲肽中醋酸的含量[J]. 中国药师, 2009, 12(6): 763. HUANG P, YANG XL, WANG Y. Determination of acetic acid in octreotide acetate by HPLC[J]. China Pharm, 2009, 12(6): 763. |
| [6] |
鞠祖芳. 高效液相色谱梯度洗脱法测定胸腺五肽原料药中醋酸和三氟醋酸的含量[J]. 医学信息(中旬刊), 2010, 1(4): 946. JU ZF. HPLC gradient test method of HAc and TFA residual in thymopentin material[J]. Med Info, 2010, 1(4): 946. |
| [7] |
吕海鸿, 廖海明, 李勇, 等. RP-HPLC法测定酪丝亮肽中醋酸的含量[J]. 药物分析杂志, 2004, 24(3): 286. H H, LIAO HM, LI Y, et al. RP-HPLC determination of the content of acetic acid in tyrserleutide[J]. Chin J Pharm Anal, 2004, 24(3): 286. |
| [8] |
谢仁德. 电位滴定法连续测定样品中盐酸和醋酸含量[J]. 中国氯碱, 2013, 1(4): 34. XIE RD. Continuous determination of hydrochloric acid and acetic acid content in the sample by potentiometric titration[J]. China Chlor-Alkali, 2013, 1(4): 34. |
| [9] |
林晓婕, 魏巍, 何志刚, 等. 离子排斥色谱法测定黄酒中的13种有机酸[J]. 色谱, 2014, 32(3): 304. LIN XJ, WEI W, HE ZG, et al. Determination of organic acids in rice wine by ion-exclusion chromatography[J]. Chin J Chromatogr, 2014, 32(3): 304. |
| [10] |
原小寓, 于泓, 吴伟. 离子排斥色谱法分析有机酸的新进展[J]. 生命科学仪器, 2005, 3(3): 29. YUAN XY, YU H, WU W. New advances in analysis of organic acid by ion-exclusion chromatography[J]. Life Sci Instrum, 2005, 3(3): 29. |
| [11] |
李婧华, 刘桂霞, 李盼盼, 等. 离子抑制色谱法测定注射用醋酸奥曲肽中乙酸的含量[J]. 中国药房, 2016, 27(27): 3867. LI JH, LIU GX, LI PP, et al. Content determination of acetic acid in octreotide acetate for injection by IEC[J]. China Pharm, 2016, 27(27): 3867. DOI:10.6039/j.issn.1001-0408.2016.27.41 |
| [12] |
李婧华, 宗艳平, 王智亮, 等. 离子抑制色谱法测定醋酸曲普瑞林注射液中醋酸的含量[J]. 药物分析杂志, 2016, 36(5): 863. LI JH, ZONG YP, WANG ZL, et al. Determination of acetic acid in triptorelin acetate injection by IEC[J]. Chin J Pharm Anal, 2016, 36(5): 863. |
| [13] |
宗艳平, 李婧华, 孙伟, 等. 高效离子抑制色谱法和高效离子交换色谱法检测琥珀酸去甲文拉法辛中琥珀酸的含量[J]. 色谱, 2016, 34(2): 189. ZONG YP, LI JH, SUN W, et al. Determination of succinic acid in desvenlafaxine succinate by high performance ion-exclusion chromatography and high performance ion-exchange chromatography[J]. Chin J Chromatogr, 2016, 34(2): 189. |
| [14] |
中华人民共和国药典2015年版. 四部[S]. 2015: 110 ChP 2015. Vol Ⅳ[S]. 2015: 110 |
 2018, Vol. 38
2018, Vol. 38 
