2. 北京中医药大学, 北京 100029
2. Beijing University of Chinese Medicine, Beijing 100029, China
真菌多糖具有强烈的抗肿瘤、抗病毒、抗衰老、抗氧化、降血糖及免疫活性作用,是近年来的研究热点,灵芝多糖作为一种常见的真菌多糖而备受关注。2015年版《中华人民共和国药典》(以下简称《中国药典》)规定,灵芝为多孔菌科真菌赤芝Ganoderma lucidum(Leyss.exFr.)Karst.或紫芝Ganoderma sinense Zhao,Xu et Zhang的干燥子实体,全年采收,除去杂质,剪除附有朽木、泥沙或培养基质的下端菌柄,阴干或在40~50 ℃烘干[1]。灵芝主要成分是多糖和三萜,这也是《中国药典》灵芝项下的主要质控指标,其水提物的主要活性组分为多糖。灵芝提取物是指以赤芝为原料,经提取分离制成的水提物,由于含有灵芝的主要活性成分,目前在药品、保健品、化妆品行业应用广泛。市场上灵芝提取物产品较多,其质量参差不齐,更存在提取过程中掺入糊精或淀粉的现象。《中国药典》及地方标准均未收录灵芝提取物检测方法,2015年版《中国药典》灵芝药材项下采用蒽酮硫酸比色法测定多糖含量,此方法专属性较差,重现性不佳,无法全面反映灵芝提取物中多糖信息。提取灵芝多糖的原料较多,不同的灵芝属真菌,采用子实体或者菌丝体进行提取且提取工艺不同(如水提、发酵等),都会使提取产物存在较大差异。这些差异主要体现在在多糖含量、相对分子质量、化学结构等方面,而采用紫外分光光度法测定总糖无法对以上信息进行区分。若作为药用,规范灵芝提取物来源及生产工艺十分重要,故建立专属性强的灵芝多糖分析方法,对于灵芝提取物的质量控制具有重要意义。
目前植物多糖的研究中,除采用传统比色法测定总糖含量外[2-3],单糖组成及相对分子质量的测定也是重点研究内容[4-5]。单糖组成多采用三氟乙酸全水解,PMP衍生化的方法,运用HPLC紫外检测器进行测定[6-7]。相对分子质量的测定多采用GPC-RI法[8-9],2种方法联合可初步对多糖质量进行专属性的控制,并从侧面反映多糖的结构特征。本研究初步建立了灵芝提取物的单糖组成、重均相对分子质量(Mw)测定方法,并对3批灵芝提取物进行测定,为灵芝提取物中多糖的质量标准提供技术参考。
1 仪器与材料 1.1 仪器Waters 2790高效液相色谱仪配置紫外检测器,岛津LC-20AD高效液相色谱配置示差检测器及GPC数据处理软件,Wyatt多角度激光光散射检测器。
1.2 材料甘露糖(Man)、葡萄糖醛酸(GlcA)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、阿拉伯糖(Ara)、半乳糖醛酸(Gal A)、鼠李糖(Rha)、L-岩藻糖(Fuc)9种单糖对照品均购于中国食品药品检定研究院,纯度大于97%;肌醇(Ino),纯度98.5%,Sigma公司;右旋糖苷分子量对照品购于美国Polymer Standards公司;1-苯基-3-甲基-5-吡唑啉酮(PMP):99%,美国Acros Organics公司;三氟乙酸、盐酸、硫酸、无水乙醇、甲醇、硫酸钠、磷酸二氢钠,磷酸氢二钠、氢氧化钠均为分析纯,购于国药集团化学试剂有限公司。3批灵芝提取物分别收集于江苏神华药业、中科健康产业集团及福建仙芝楼生物科技公司,编号为S1、S2、S3。
2 方法与结果 2.1 灵芝提取物中粗多糖的提取精确称取灵芝提取物0.12 g于锥形瓶中,用热水10 mL溶解,再加入乙醇150 mL,充分混合,4 ℃下静置过夜,4 000 r·min-1离心10 min,弃去上清,下层粗多糖用乙醇反复洗涤,挥去乙醇,作为灵芝粗多糖,待测。
2.2 灵芝提取物中单糖组成及含量测定 2.2.1 对照品溶液的制备分别取Man、Glc A、Gal、Glc、Xyl、Ara、Gal A、Rha、Fuc 9种单糖和Ino的对照品适量,精密称定,加水制成质量浓度均为1.0 mg·m L-1的单标溶液。最终根据测定结果,将检出的5种单糖溶液,加水制成浓度为0.1 mg·m L-1的混合对照品,按照“2.2.3”项下方法进行衍生化,即得混合对照品溶液。
2.2.2 完全酸水解用热水将粗多糖溶解并转移到50 mL量瓶中,冷却至室温,再用水定容至刻度,摇匀,滤过;精确移取1.0 mL至反应瓶(安瓿瓶)中,加入4 mol· L-1三氟乙酸1.0 mL,将反应瓶密封,110 ℃下加热4 h。冷却至室温后,60 ℃氮气吹干,再用适量甲醇清洗反应瓶,吹干,反复操作3次。
2.2.3 PMP衍生化反应瓶中加水0.2 mL,0.15mol· L-1氢氧化钠溶液0.3 mL,0.1 mol· L-1的PMP甲醇溶液0.5 mL,盖好瓶盖,70 ℃下加热30 min,冷却至室温。往瓶中加入0.15 mol· L-1盐酸溶液0.3 mL,充分混匀,用0.45μm的微孔膜过滤,即得供试品溶液。
2.2.4 HPLC-PDA色谱条件采用CAPCELL PAK MGII C18色谱柱(4.6 mm×250 mm,5 μm),流动相A为乙腈,流动相B为0.05 mol· L-1磷酸钠缓冲液(0.05 mol· L-1磷酸二氢钠与磷酸氢二钠混合水溶液,体积比为12:88),梯度洗脱(0~30 min,85%B→80%B;30~55 min,80%B→75%B;55~56 min,75%B→85%B),检测波长250 nm,柱温35 ℃,流速1.0 mL·min-1,进样量20µL。
2.2.5 单糖组成测定结果对样品水解及衍生化,经高效液相紫外检测器测定,得到灵芝提取物单糖组成及含量如表 1所示。
|
|
表 1 3批样品单糖组成测定结果(%) Table 1 Results of the monosaccharide composition in 3 samples |
从以上结果可看出,3批灵芝提取物中单糖组成基本一致:所测定的9个单糖中,灵芝提取物粗多糖主要由4个单糖组成,包括Glc、Glc A、Man和Gal,其中2批灵芝提取物检出Fuc,但含量很低,而Ara、Xyl、Rha、GalA及Ino均未检出。从组成含量来看,Glc为灵芝多糖的主要成分,其次为Gal和Man。3批提取物的糖总量在2.6%~6.9%之间。见图 1。
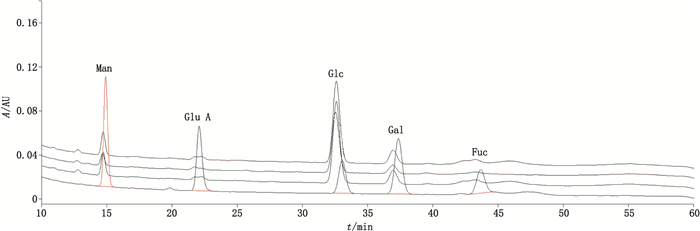
|
图 1 3批样品单糖组成测定色谱图(从上至下分别为S3、S2、S1、混合对照品溶液) Figure 1 The chromatograms of monosaccharide composition in 3 samples(from top to bottom:S3, S2, S1 and mixed reference substance solution) |
色谱柱:Shodex HQ 806+804+803凝胶渗透色谱柱(300 mm×8 mm,7 μm)串联;流动相:0.2 mol· L-1氯化钠溶液;流速:0.5 mL·min-1;柱温:40 ℃;进样量:50 μL;检测器:RI与MALLS联用;检测器温度:40 ℃。MALLS激光波长658 nm,石英玻璃样品池。MALLS 90°光电二极管检测器用甲苯校正,其余角度二极管检测器采用Mw=3 000右旋糖酐对照品归一化,dn/dc值为0.14。
2.3.2 对照品溶液的制备称取11个(Mw分别为180、500、3 000、21 000、44 000、72 000、123 000、325 000、530 000、820 000、3 755 000),用流动相溶解制成10 mg·m L-1的对照品溶液。
2.3.3 供试品溶液的制备取“2.1”项下提取的灵芝粗多糖加入流动相溶液10 mL使溶解并摇匀,取5 mL置15 mL超滤管(Mw=3 000)中,离心(4 000 r·min-1)10 min,取截留液(Mw > 3 000)作为供试品溶液,待进样分析。
2.3.4 相对分子质量标准曲线的绘制分别取不同相对分子质量的对照品溶液在“2.3.1”项条件下测定,采用GPC计算软件绘制标准曲线,得3次方程校正曲线:
| $ \begin{array}{l} Y = - 3.958 \times {10^{ - 4}}{X^3} + 6.198 \times {10^{ - 2}}{X^2} - 3.381X + 68.04\;\;\;{r^2} = \\ 0.995\;5 \end{array} $ |
结果表明,相对分子质量在180~3 755 000范围内线性关系良好。
2.3.5 GPC-RI-MALLS测定结果与分析按“2.3.1”项下色谱条件,对3批样品采用RI和MALLS串联进行检测,色谱图见图 2。
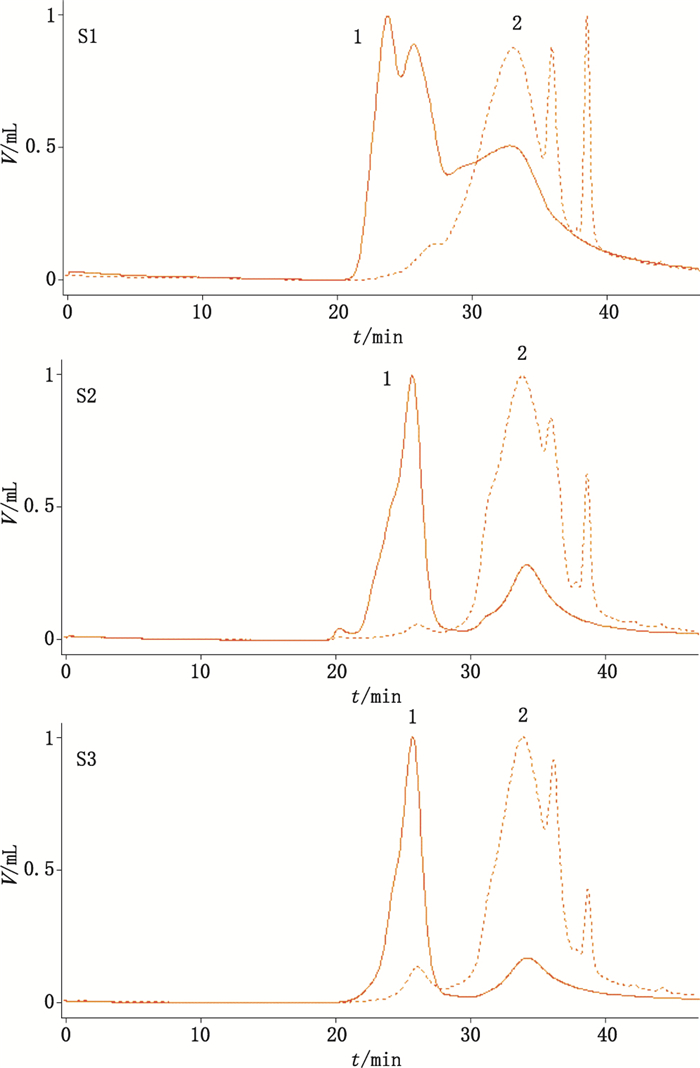
|
图 2 3批样品GPC-RI-MALLS测定图谱(——MALLS;----RI) Figure 2 The GPC-RI-MALLS chromatogram of 3 samples(——MALLS; ----RI) |
采用分割峰方式把样品峰分为两部分,分别积分计算Mw。峰1保留时间为35~48 min,峰2保留时间为48.1~60 min。采用右旋糖酐分子量对照品标准曲线计算峰1、峰2的Mw,同时采用MALLS法测定峰1、峰2的Mw,结果如表 2所示。利用RI测定结果对3批样品图谱进行比较,色谱图如图 3所示。
|
|
表 2 3批样品Mw测定结果 Table 2 Results of Mw in 3 samples |
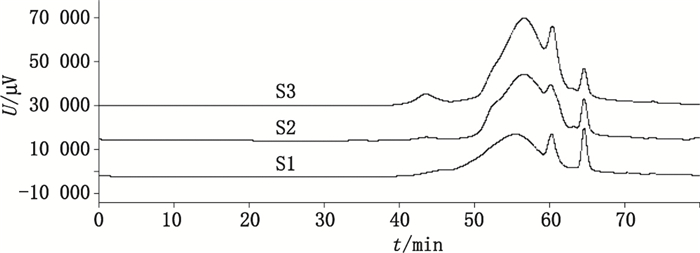
|
图 3 3批样品GPC-RI法测定图谱比较 Figure 3 Comparison of GPC-RI chromatogram for 3 samples |
从表 2可看出,峰1的Mw均大于1 000 000,峰所占比例小。峰2不管是MALLS法还是RI法测得Mw均小于46 000,为低分子量部分,峰所占比例大,在91%以上。由MALLS测定的Mw数值均比RI测定的Mw数值高,这可能与测定原理和方法有关,将在讨论部分阐述。
3 讨论 3.1 3批样品多糖测定结果比较据文献报道,灵芝多糖多由Glc、Gal、Man、Xyl、Rha、Ara、Fuc等组成[10]。在本次3批样品测定中只出现4~5种单糖,包括Glc、Gal、Man、GlcA和Fuc,而未检出Xyl、Rha、Ara等,这可能与其提取工艺相关。Xyl一般存在于灵芝多糖高分子量端,有可能在灵芝提取过程中对高分子量部分进行处理;Fuc常出现于灵芝菌丝体发酵液中[11],故部分批次检出Fuc是否与其生产工艺有关,需进一步考察。从含量上看,测定结果显示Glc含量最高,在所有单糖组成比例达到65%以上,这与灵芝多糖研究报道[10]相符,即灵芝多糖是β-(1→3)为主链,伴有β-(1→6)支链的葡聚糖结构,葡萄糖为其主要单糖成分,这也是大多真菌多糖的结构特点;其次Gal比例达到11%以上,Gal含量较多的多糖可以显著增加免疫活性,故Gal也应是灵芝多糖的重要指标成分。
分子量测定方面,采用Shodex HQ 806+804+803色谱柱对粗多糖进行分离,得峰1(高分子量部分)和峰2(低分子量部分)。MALLS测定结果显示峰1的Mw均大于1 000 000,峰2的Mw均小于46 000,不同批次灵芝提取物多糖分子量总体分布一致,但从图 3亦可看出多糖含量差异较大。
3.2 RI与MALLS测定结果差异分析GPC-RI法是一种相对分子质量测定法,需经普适校正才能得到可靠的相对分子质量。此法相对分子质量的计算主要依靠标准曲线,即相对分子质量对保留时间作图所得,而样品在色谱柱上的保留时间不仅与其相对分子质量有关,还与分子的空间结构相关。相对分子质量相同的线性结构和球状结构分子,表观尺寸差异很大,导致保留体积不同,故此法的准确性取决于采用的多糖对照品与实际样品结构是否相似,结构差异大则会造成结果偏离。MALLS法是一种绝对分子质量测定法,不依赖于标准物质,无需做校正曲线;MALLS法亦可由测得的α值推断样品的构象信息,α值在0.2~0.4之间时表明高分子为紧缩的球形构象,在0.5~0.6之间时表示为无规则线团。本试验对灵芝提取物和右旋糖酐对照品的α值进行测定,结果见图 4。从图 4可看出灵芝提取物S1的α值为0.33,与灵芝多糖研究报道[12]一致,表明其在0.2 mol· L-1 NaCl水溶液中可能为球形构象,与右旋糖酐存在一定差异,这可能是导致RI与MALLS测定结果不一致的原因之一。另外,本实验采用右旋糖苷对照品,此对照品的最大相对分子质量为3 750 000,大于3 750 000的相对分子质量结果是由标准曲线外推所得,亦可能造成一定偏差。
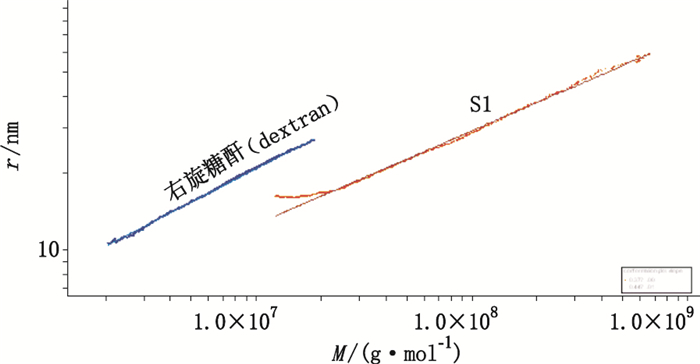
|
图 4 灵芝提取物(S1)和右旋糖酐(Mw=820 000)在0.2 mol· L-1氯化钠水溶液中的斜率值α Figure 4 The α value of the plot for Ganoderma Lucidum extracts(S1) and dextran(Mw=820 000)in 0.2 mol· L-1 NaCl |
本文对灵芝提取物中多糖的单糖组成及Mw测定方法进行初步研究。通过对3批样品的测定初步得出结论:灵芝提取物中多糖的测定可采用Glc、Gal、Man和GlcA作为定性鉴别指标,并对几种单糖的含量进行检测。此方法相较于传统的蒽酮-硫酸、苯酚-硫酸总糖测定法,准确性、重复性更佳。同时采用GPC-RI-MALLS联用方法对灵芝提取物中多糖的Mw进行测定,规定2个主要色谱峰的Mw范围。本实验研究认为,单糖组成和Mw可作为控制灵芝提取物中多糖质量的有效指标。但本实验仍存在不足,灵芝提取物由于其品种、工艺、发酵等多种因素,都有可能导致其单糖组成和相对分子质量存在差异,此次实验批数较少,应进一步收集来源更为广泛的灵芝提取物进行研究,并对方法的稳定性进行优化和考察。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 319 ChP 2015. VolⅠ[S]. 2015: 319 |
| [2] |
赵骏, 连娜, 李青青. 桑叶多糖质量控制初探[J]. 天津中医, 2002, 19(5): 48. ZHAO J, LIAN N, LI QQ. Discussion on quality control of polysaccharide of Sangye[J]. Tianjin J Tradit Chin Med, 2002, 19(5): 48. |
| [3] |
刘玉明, 李珂娴, 蒋定文, 等. 海洋星虫多糖质量标准初探[J]. 中国药师, 2015, 18(1): 4. LIU YM, LI KX, JIANG DW, et al. Preliminary study on quality standard for Sipunculus nudus polysaccharide[J]. China Pharm, 2015, 18(1): 4. |
| [4] |
李蒙蒙, 张丽颖. 国内中药多糖的提取分离及分析研究概况[J]. 药物分析杂志, 2005, 25(10): 1285. LI MM, ZHANG LY. Summary on extraction, separation and analysis of polysaccharides from Chinese traditional medical herbs[J]. Chin J Pharm Anal, 2005, 25(10): 1285. |
| [5] |
郭志烨, 韩丽, 杨明, 等. 中药多糖定量测定方法的探讨[J]. 中成药, 2014, 36(10): 2172. GUO ZY, HAN L, YANG M, et al. Discussion of the method of quantitative determination of polysaccharide in Chinese medicine[J]. Chin Tradit Pat Med, 2014, 36(10): 2172. DOI:10.3969/j.issn.1001-1528.2014.10.037 |
| [6] |
SUN XM, WANG HH, HAN XF, et al. Fingerprint analysis of polysaccharides from different Ganoderma by HPLC combined with chemometrics methods[J]. Carbohydr Polym, 2014, 114: 432. DOI:10.1016/j.carbpol.2014.08.048 |
| [7] |
WANG YF, XIAN JH, XI XG, et al. Multi-fingerprint and quality control analysis of tea polysaccharides[J]. Carbohydr Polym, 2013, 92: 583. DOI:10.1016/j.carbpol.2012.09.004 |
| [8] |
任爱农, 邹义芳, 陆颖, 等. 红花多糖的分离纯化及单糖组成分析[J]. 药物分析杂志, 2013, 33(7): 1190. REN AN, ZOU YF, LU Y, et al. Isolation, purification and monosaccharide composition analysis of polysaccharides from safflower[J]. Chin J Pharm Anal, 2013, 33(7): 1190. |
| [9] |
李楠, 李卓, 张燕, 等. 高效分子排阻色谱法同时测定白及多糖分子量和含量[J]. 药物分析杂志, 2012, 32(10): 1801. LI N, LI Z, ZHANG Y, et al. Determination of molecular weight and content of Bletilla striata glucomannan by high performance size exclusion chromatography[J]. Chin J Pharm Anal, 2012, 32(10): 1801. |
| [10] |
于青, 尚姝, 冯有龙, 等. 离子色谱法测定灵芝孢子粉中多糖的含量[J]. 中国药学杂志, 2014, 49(4): 344. YU Q, SHANG S, FENG YL, et al. Determination of monosaccharide composition of polysaccharide in Ganoderma lucidum spore by ion chromatography[J]. Chin Pharm J, 2014, 49(4): 344. |
| [11] |
叶素丹. 灵芝多糖相对分子量检测及其单糖组分分析[J]. 分析测试学报, 2015, 46(12): 51. YE SD. Determination of molecular weight of Ganoderma Lucidum polysaccharides and its monosaccharide components analysis[J]. J Ins Anal, 2015, 46(12): 51. |
| [12] |
杨慧. 灵芝子实体多糖的分离分析及其免疫活性与色谱指纹图谱的相关性研究[D]. 无锡: 江南大学, 2015: 19 YANG H. Isolation, Characterization of Polysaccharides from Ganoderma lucidum Fruiting Bodies and Correlation Analysis Chromatographic Fingerprint-immunocompetence[D]. Wuxi: Jiangnan University, 2015: 19 http://cdmd.cnki.com.cn/Article/CDMD-10295-1015523686.htm |
 2018, Vol. 38
2018, Vol. 38 
