2. 新疆维吾尔自治区食品药品检验所, 乌鲁木齐 830002;
3. 中国人民解放军 95788 部队卫生队, 成都 610041
2. Xinjiang Uygur Autonomous Region for Food and Drug Control, Urumqi 830002, China;
3. The Chinese People's Liberation Army Corps, Sichuan, Chengdu 610041, China
神香草为唇形科植物硬尖神香草Hyssopus cuspidatus Boriss的干燥地上部分,是维吾尔族民间习用药材,性质干热,有很强的香味,具有镇咳、袪痰、平喘作用[1],在维吾尔医和民间用于治疗气管炎已有几百年的历史,其疗效确切、显著[2]。前期研究证实,神香草提取物具有明显的镇咳、平喘作用,进一步对神香草提取物进行制备工艺的系统性研究和优化,获得神香草有效部位,并进行了相关的药效学研究,证实神香草有效部位可通过抑制炎症因子的产生和抑制炎性介质的表达,促进免疫调节的平衡,从而达到防治支气管哮喘的作用[3];并发现神香草有效部位对乙酰胆碱、磷酸组胺致豚鼠支气管平滑肌收缩具有舒张作用[4]。
本研究在前期优化神香草有效部位制备工艺和药效作用显著的基础上,对其质量进行研究,采用高效液相色谱法对神香草有效部位中的主要成分迷迭香酸[5]进行测定,并对其特征图谱进行研究;采用紫外分光光度法对神香草有效部位中的总黄酮和总多糖进行测定,建立了神香草抗哮喘有效部位的定性定量方法,为新药研发奠定基础。
1 仪器与试药 1.1 仪器U3000高效液相色谱仪(Thermo Fisher Scientific);BP211D电子天平(Sartorius,0.01 mg);UV-2501型紫外分析仪;SK3300H型超声清洗仪(上海科导超声仪器有限公司);UPT-11-10T优普特实验超纯水机(成都超纯科技有限公司)。
1.2 试药对照品迷迭香酸(批号111871-201102,纯度98.2%)、D-无水葡萄糖(批号0833-9501,纯度98.5%)、芦丁(批号100080-201409,纯度98.0%)均购自中国食品药品检定研究院;神香草有效部位(批号:20150816、20150830、20150914)由新疆维吾尔自治区药物研究所分析室制备;甲醇、乙腈为色谱纯(美国Fisher公司),甲酸为色谱纯(美国Dikma Technologies),水为超纯水,其余试剂均为分析纯。
2 方法与结果 2.1 HPLC法测定神香草有效部位中迷迭香酸 2.1.1 色谱条件采用Cosmosil Waters C18色谱柱(250 mm×4.6 mm,5 µm),以乙腈为流动相A,0.2%甲酸水溶液为流动相B,梯度洗脱(0~20 min,20%A→35%A;20~20.01 min,35%A→70%A;20.01~25 min,70%A;25~25.01 min,70%A→20%A;25.01~30 min,20%A),流速1.0 mL·min-1,柱温30 ℃,检测波长330 nm,进样体积10 μL。
2.1.2 对照品溶液制备取迷迭香酸对照品适量,精密称定,加30%乙腈制成每1 mL含50 µg的溶液,即得。
2.1.3 供试品溶液制备精密称定神香草有效部位约15 mg,置10 mL量瓶中,加30%乙腈适量,超声(频率59 kHz,功率160 W)15 min使溶解,放冷,用30%乙腈稀释至刻度,摇匀,即得(每1 mL约含1.5 mg)。
2.1.4 含量测定方法精密量取供试品溶液10 µL注入液相色谱仪,记录色谱图。另取迷迭香酸对照品溶液,同法测定。按外标法以峰面积计算样品中迷迭香酸的含量。见图 1。
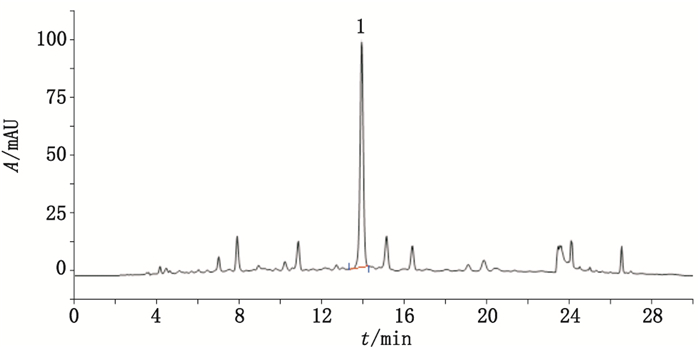
|
1.迷迭香酸(rosmarinic acid) 图 1 神香草抗哮喘有效部位HPLC色谱图 Figure 1 HPLC chromatogram of the effective parts of Hyssopus cuspidatus Boriss anti-asthmatic |
取迷迭香酸对照品适量,精密称定,加30%乙腈制成1.025 mg·m L-1的对照品储备液,再加30%乙腈稀释制成质量浓度分别为5.125、25.625、51.250、76.875、102.5 μg·m L-1的系列对照品溶液,按“2.1.1”项下色谱条件进样测定,记录峰面积,以对照品的质量浓度(X,μg·m L-1)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得回归方程:
| $ Y = 0.345\;3X - 0.186\;3\;\;\;\;r = 0.999\;9 $ |
结果表明,迷迭香酸的质量浓度在5.125~102.5 μg·m L-1范围内与峰面积呈良好的线性关系。
2.1.6 重复性试验取本品适量,按“2.1.3”项下方法平行制备6份供试品溶液,再按“2.1.1”项下色谱条件进样测定,计算含量。结果平均含量为3.75%,RSD=1.3%(n=6),表明本方法重复性良好。
2.1.7 精密度试验取“2.1.2”项下对照品溶液适量,按“2.1.1”项下色谱条件进样测定,连续进样6次,记录峰面积。结果RSD=0.35%(n=6),表明仪器精密度良好;不同日期、不同人员按“2.1”项下方法测定样品含量6次,结果RSD=0.77%(n=6),表明本方法精密度良好。
2.1.8 回收率试验精密称取已知含量的神香草有效部位适量,共6份,置于10 mL量瓶中,分别精密加入质量浓度为1.025 mg·m L-1的迷迭香酸对照品溶液0.3 mL,按“2.1.3”项下方法制备供试溶液。按“2.1.1”项下色谱条件进行测定,计算回收率,结果表明迷迭香酸的平均加样回收率为99.1%,RSD=0.86%(n=6)。
2.1.9 稳定性考察取“2.1.3”项下供试品溶液适量,分别于室温(25℃)下放置0、4、8、12、24 h,按“2.1.1”项下色谱条件进样测定,记录峰面积。结果RSD=1.6%(n=5),表明供试品溶液在室温下24 h内稳定性良好。
2.1.10 迷迭香酸含量测定结果按“2.1.4”项下含量测定法,测得神香草有效部位中迷迭香酸含量(n=3)为3.68%。
2.2 特征图谱 2.2.1 色谱条件同“2.1.1”项下色谱条件,理论塔板数按迷迭香酸峰计算应不低于8 000。
2.2.2 参照物溶液及供试品溶液的制备取“2.1.2”项下对照品溶液作为参照物溶液;取“2.1.3”项下供试品溶液作为供试品溶液。
2.2.3 测定法分别精密吸取参照溶液与供试品溶液各10 μL,注入液相色谱仪,测定,记录30 min的色谱图,即得。
2.2.4 结果样品的特征图谱中应有5个特征峰,与参照物峰相对应的峰为S峰,计算特征峰1~4的相对保留时间,其相对保留时间应在规定值的±5%之内,规定值为:0.56(峰1)、0.76(峰2)、1.09(峰3)、1.18(峰4),结果见图 2。
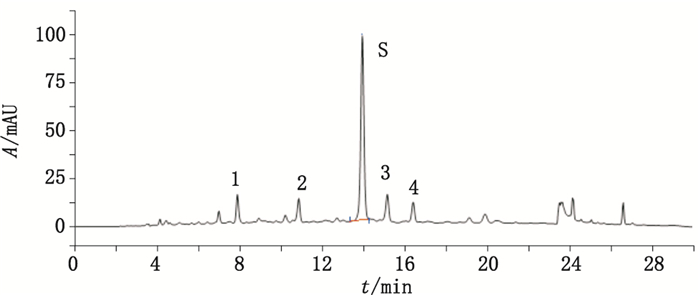
|
图 2 神香草抗哮喘有效部位特征图谱 Figure 2 HPLC specific chromatogram of the effective parts of Hyssopus cuspidatus Boriss anti-asthmatic |
取芦丁对照品适量,精密称定,加40%乙醇制成每1 mL含0.6 mg的溶液,即得。
2.3.2 标准曲线的制备精密量取对照品溶液0、0.5、1.0、2.0、3.0、4.0 mL,分别置25 mL量瓶中,各加水6 mL,加5%亚硝酸钠溶液1 mL,使混匀,放置6 min,加10%硝酸铝溶液1 mL,摇匀,放置6 min,加氢氧化钠试液10 mL,再加40 %乙醇稀释至刻度,摇匀,放置15 min,以相应的试剂为空白,照紫外-可见分光光度法(《中华人民共和国药典》2015年版四部通则0401),在510 nm的波长处测定吸收度,以吸收度(A)为纵坐标,浓度(X,μg·m L-1)为横坐标,绘制标准曲线, 得回归方程:
| $ A = 0.012\;2X - 0.013\;4\;\;\;\;r = 0.999\;7 $ |
结果表明,芦丁的质量浓度在12~96 μg·m L-1范围内与吸收度呈良好的线性关系。
2.3.3 供试品溶液的制备取神香草有效部位约12 mg,精密称定,置10 mL量瓶中,加40%乙醇适量,超声(频率59 kHz,功率160 W)10 min使溶解,放冷,用40%乙醇稀释至刻度,即得。
2.3.4 测定法精密量取40%乙醇、对照品溶液和供试品溶液各2 mL,分别置25 mL量瓶中,自“2.3.2”项下“加水6 mL”起,依法测定吸收度。从标准曲线上读出供试品溶液中芦丁的量,计算,即得。
2.3.5 重复性试验按“2.3.3”项下方法平行制备6份供试品溶液,再按“2.3.4”项下方法测定,计算含量。结果平均含量为34.89%,RSD=1.6%(n=6),表明本方法重复性良好。
2.3.6 精密度试验取“2.3.1”项下对照品溶液,按“2.3.4”项下方法测定吸收度。结果RSD=0.022%(n=6),表明仪器精密度良好。
2.3.7 回收率试验取已知含量的神香草有效部位6份,每份约6.0 mg,精密称定,分别置于10 mL量瓶中,精密加入芦丁对照品溶液(0.602 mg·m L-1)3.75 mL,加40%乙醇适量,超声(160 W,59 kHz)15 min,放冷,用40%乙醇稀释至刻度,摇匀,精密量取2 mL于25 mL量瓶中,按“2.3.4”项下方法,自“加水6 mL”起同法操作并测定,计算回收率,结果平均回收率为100.2%,RSD=1.1%(n=6)。
2.3.8 稳定性试验取“2.3.3”项下供试品溶液适量,在室温(25 ℃)下放置,分别于0、10、30、40 min测定吸收度,结果吸收度随放置时间的延长而降低,故应及时测定。
2.3.9 总黄酮含量测定结果按“2.3.4”项下方法,测定神香草有效部位中总黄酮含量(n=3)为35.10%。
2.4 UV法测定神香草有效部位中总多糖 2.4.1 对照品溶液的制备取D-无水葡萄糖对照品适量,精密称定,加40%乙醇制成每1 mL含0.1 mg的溶液,即得。
2.4.2 标准曲线的制备精密量取对照品溶液0.2、0.5、1.0、1.5、2.0 mL,分别置10 mL量瓶中,加40%乙醇至刻度,摇匀。分别精密量取上述溶液各1 mL,置具塞试管中,加水1 mL,迅速精密加入硫酸蒽酮溶液(精密称取蒽酮0.05 g,加80%硫酸100 mL使溶解,摇匀)6 mL,立即摇匀,置水浴加热15 min,立即置冰浴中冷却15 min,取出,以相应的试剂为空白,照紫外-可见分光光度法(《中华人民共和国药典》2015年版四部通则0401),在620 nm波长处测定吸收度,以对照品的质量浓度(X,μg·m L-1)为横坐标,吸收度(A)为纵坐标,绘制标准曲线,得回归方程:
| $ A = 0.004\;1X + 0.025\;1\;\;\;\;r = 0.999\;4 $ |
结果表明,D-无水葡萄糖的质量浓度在20.44~204.4 μg·m L-1范围内与吸收度呈良好的线性关系。
2.4.3 供试品溶液的制备取神香草有效部位约17 mg,精密称定,置25 mL量瓶中,加40%乙醇,超声(160 W,59 kHz)15 min使溶解,放冷,用40%乙醇溶液稀释至刻度,即得。
2.4.4 测定法精密量取40%乙醇、对照品溶液和供试品溶液各1 mL,分别置具塞试管中,自“2.4.2”项下“加水1 mL”起,依法测定吸收度。从标准曲线上读出供试品溶液中D-无水葡萄糖的量,计算,即得。
2.4.5 重复性试验按“2.4.3”项下方法平行制备6份供试品溶液,再按“2.4.4”项下方法测定,计算含量。结果平均含量为17.32%,RSD=1.4%(n=6),表明本方法重复性良好。
2.4.6 精密度试验取“2.4.1”项下对照品溶液适量,按“2.4.4”项下方法测定吸收度。结果RSD=0.11%(n=6),表明仪器精密度良好。
2.4.7 回收率试验取已知含量的神香草有效部位6份,每份约9.0 mg,精密称定,分别置25 mL量瓶中,精密加入D-无水葡萄糖对照品溶液(1.022 mg m L-1)1.3 mL,加40%乙醇适量,超声(160 W,59 kHz)15 min,放冷,用40%乙醇稀释至刻度,摇匀。精密量取1 mL于具塞试管中,按“2.4.4”项下测定法,自“加水1 mL”起测定,计算回收率,结果平均回收率为103.0%,RSD=1.1%(n=6)。
2.4.8 稳定性试验取“2.4.3”项下供试品溶液适量,在室温(25 ℃)下放置,分别于0、10、30、40 min测定吸收度,结果吸收度随放置时间的延长变化不大,但建议30 min内测定完毕。
2.4.9 总多糖含量测定结果按“2.4.4”项下方法,测定神香草有效部位中总多糖含量,结果(n=3)为17.12%。
3 结论与讨论本研究所用的神香草有效部位经药效试验,证实具有很强的抗哮喘活性,是此类药物的候选药物,对其质量控制进行深入研究意义较大。黄酮类化合物具有抗氧化、抗过敏、抗炎、免疫调节的作用,其对于防治哮喘的作用明确[6-8];神香草多糖可调节哮喘HPA轴的功能,通过改善内源性抗炎机制和抑制炎性细胞因子的释放来改善哮喘的炎症[9]。故本研究将总黄酮和总多糖作为测定指标。
本研究不仅建立HPLC方法测定了主要成分迷迭香酸的含量,结果为3.68%,并建立了特征图谱,从部分到整体化学成分的角度都对其进行控制[10-12],经测定主要成分黄酮(35.10%)和多糖(17.12%)的含量之和大于50%,具有一定的成药性[13],为进一步研究新药提供数据支持。
| [1] |
丁剑冰, 武新华, 王亚男, 等. 神香草的实验研究[J]. 新疆中医药, 2002, 2(3): 10. DING JB, WU XH, WANG YN, et al. Study on Hyssopus cuspidatus Boriss[J]. Xinjiang J Tradit Chin Med, 2002, 2(3): 10. |
| [2] |
国家药典委员会. 中华人民共和国卫生部药品标准·维吾尔药分册[S]. 乌鲁木齐: 新疆科技卫生出版社, 1999 Chinese Pharmacopoeia Commission. Drug Standard of the Ministry of Health of People's Republic of China·Uighur Medicine Fascicule[S]. Urumqi: Xinjiang Scientific and Technical Publisher, 1999 |
| [3] |
袁凤娟, 胡梦颖, 哈木拉提·哈斯木, 等. 神香草提取物防治支气管哮喘作用机制研究[J]. 中成药, 2017, 39(5): 1042. YUAN FJ, HU MY, HAMULATI HSM, et al. The research of the mechanism of Hyssopus cuspidatus Boriss in the prevention and treatment of bronchial asthma[J]. Chin J Pat Med, 2017, 39(5): 1042. |
| [4] |
袁凤娟, 孙玉华, 哈木拉提·哈斯木, 等. 神香草洗脱物对豚鼠离体气管平滑肌收缩作用的影响[J]. 中国药房, 2017, 28(13): 1790. YAN FJ, SUN YH, HAMULATI Hsimu, et al. Effect of tracheal smooth muscle contraction by Hyssopus cuspidatus extract on isolated guinea pig[J]. China Pharm, 2017, 28(13): 1790. DOI:10.6039/j.issn.1001-0408.2017.13.18 |
| [5] |
戎晓娟, 严欢, 韩阳, 等. 神香草水提物的主成分分析及含量测定[J]. 中国药房, 2015, 26(6): 808. RONG XJ, YAN H, HAN Y, et al. Analysis of main components of Hyssopus officinalis water extract and content determination[J]. China Pharm, 2015, 26(6): 808. DOI:10.6039/j.issn.1001-0408.2015.06.30 |
| [6] |
王天明, 尚云晓. 黄酮类化合物防治哮喘的研究进展[J]. 国际儿科学杂志, 2016, 43(5): 389. WANG TM, SHANG YX. Progress of flavonids in prevention and treatment of asthma[J]. Int J Pediatr, 2016, 43(5): 389. |
| [7] |
麦合苏木·艾克木, 努尔江·肉孜, 阿布都热依木·玉素甫. 维药神香草总黄酮抗炎、止咳、祛痰及平喘作用研究[J]. 新疆医科大学学报, 2014, 37(4): 403. MAHSUM Ekim, NURJAN Rozi, ABDIRYIM Yusup. On anti-inflammatory, antitussive, expectorant, and anti-asthmatic effects of total flavonoids from Uyghur medicine Hyssopus officinalis L.[J]. J Xinjiang Med Univ, 2014, 37(4): 403. |
| [8] |
阿依先木·他西. 维药神香草总黄酮对哮喘大鼠气道炎症和气道重塑的影响及其作用机制研究[D]. 乌鲁木齐: 新疆医科大学, 2015 AYXAM Tax. The Effect and Mechanism of Traditional Uyghur Medicinal Herb Hyssopus officinalis L. Total Flavonoids on Airway Inflammation and Remodeling in Rats Model of Chronic Asthma[D]. Urumqi: Xinjiang Medical University, 2015 |
| [9] |
马雪萍. 神香草多糖对哮喘大鼠细胞因子和神经内分泌免疫网络的实验研究[D]. 乌鲁木齐: 新疆医科大学, 2011 MA XP. The Effects of Polysaccharide from Hyssopus officinalis L. on Cytokine and Neuro-endocrine-immuno in Asthma Model of Asthmatic Rats[D]. Urumqi: Xinjiang Medical University, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10760-1011188267.htm |
| [10] |
昝珂, 苏蕊, 滕爱君, 等. 新疆紫草HPLC特征图谱和紫草类药材6种萘醌类成分含量测定[J]. 药物分析杂志, 2016, 36(9): 5126. ZAN K, SU R, TENG AJ, et al. HPLC specific chromatogram of Arnebia euchroma and determination of six naphthoquinones in Boraginaceous herbs[J]. Chin J Pharm Anal, 2016, 36(9): 5126. |
| [11] |
赵喜玲, 张宏, 李小云, 等. 黑骨藤超高效液相色谱特征图谱的研究[J]. 药物分析杂志, 2016, 36(11): 1963. ZHAO XL, ZHANG H, LI XY, et al. Studies on ultra performance liquid chromatography characteristic chromatogram of Periploca forrestil Schltr.[J]. Chin J Pharm Anal,, 2016, 36(11): 1963. |
| [12] |
陈佳, 钱琛, 陈桂良. 《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介[J]. 上海医药, 2016, 37(7): 3. CHEN J, QIAN C, CHEN GL. A brief introduction to quality standards of traditional Chinese medicines in the Pharmacopoeia of the People's Republic of China(2015 version)[J]. Shanghai Med, 2016, 37(7): 3. |
| [13] |
王永刚, 李沛波, 吴忠, 等. 岭南特色中药活性成分的发现与成药性研究[J]. 中南药学, 2015, 13(8): 789. WANG YG, LI PB, WU Z, et al. Discovery of the bioactive components and further druggability research of traditional Chinese herbs from Lingnan region in China[J]. Cent South Pharm, 2015, 13(8): 789. DOI:10.7539/j.issn.1672-2981.2015.08.002 |
 2018, Vol. 38
2018, Vol. 38 
