抗体药物偶联物(antibody drug conjugates,ADC)是一种有良好应用前景的新型癌症治疗药物,它由靶向特异性抗原的单克隆抗体和高效细胞毒性的小分子化学药物偶联而成。通常,抗体上的半胱氨酸和赖氨酸等氨基酸常用来作为偶联位点,使抗体与小分子药物相偶联。通过两者的结合,肿瘤特异性的抗体可以将偶联的细胞毒性物质靶向于肿瘤细胞,从而杀伤肿瘤细胞,同时避免了对正常细胞的非特异性杀伤作用[1-3]。FDA于2011年和2013年先后批准了Adcetris(brentuximabvedotin)[4-5]和Kadcyla(trastuzumabemtansine)[6] 2个ADC的上市申请,引起了外界的广泛关注。近年来,ADC技术领域的研究十分活跃,针对不同的肿瘤类型也涌现出了一些抗体偶联候选药物。
ADC作为抗体相关产品,对其质量研究的内容除了需关注糖基化、分子大小异构体等一些抗体通用特性之外,还需对偶联之后的一些产品专有特性,如药物抗体偶联比(drug antibody ratio,DAR)、DAR分布、偶联位点等进行格外关注[7-8]。DAR是ADC关键的指标,其直接决定了到达肿瘤细胞表面的小分子细胞毒药物的数量,与ADC的安全性和有效性密切相关。偶联至抗体上的小分子药物含量会对药物的代谢动力学、药效安全性等造成影响。较低的DAR可导致ADC效力低下;较高的DAR(抗体被高度修饰)则可能导致抗体与靶抗原的亲和力下降,并产生聚集沉淀等不稳定现象,加快ADC的清除;另一方面,过高的DAR值也可能会引起更强的毒副作用。ADC中抗体和小分子药物的比例对其有效性和安全性都起着至关重要的作用,所以通过相应的分析技术对ADC进行质控显得尤为重要。紫外分光光度法测定DAR广泛适用于小分子药物在紫外/可见光下有发色基团,能表现出最大吸收值的ADC中,而双波长分子排阻色谱(SEC)法则较少应用,但该方法可在测定DAR的同时,对ADC的分子大小异构体进行分析,因而具有良好的应用前景。本文通过2种技术,即双波长分子排阻色谱和紫外分光光度法,对一种通过抗体上的半胱氨酸残基偶联ADC的DAR做出分析。
1 仪器与试药Waters公司e2695高效液相色谱仪,岛津公司UV-2700紫外分光光度计。
抗体及半胱氨酸偶联的ADC样品均为中国食品药品检定研究院单克隆抗体产品室留存。ADC偶联的小分子药物为微管抑制剂澳瑞他汀衍生物,即一甲基澳瑞他汀E(monomethyl auristain E,MMAE),最大吸收波长为248 nm。
十二水合磷酸氢二钠(Na2HPO4·12H2O),货号71376;二水合磷酸二氢钠(NaH2PO4·2H2O),货号71502;L-组氨酸盐酸盐,货号104350;甘露醇,货号M9546;蔗糖,货号V900116;聚山梨酯80,货号59924;1 mol· L-1的氢氧化钠溶液,货号109137。上述试药均购自Sigma公司。
2 方法 2.1 双波长SEC法色谱条件:采用TOSOH公司TSKgel G3000SWXL(7.8 mm×30 cm,5 μm),以pH 6.8±0.2的0.1 mol· L-1磷酸盐-0.1 mol· L-1氯化钠缓冲液[精密称取十二水合磷酸氢二钠(21.84±0.01)g,二水合磷酸二氢钠(6.08±0.01)g,氯化钠(l5.84±0.01)g,加超纯水溶解至1 L,0.45 μm滤膜过滤,即得]为流动相,流速1.0 mL·min-1,柱温25 ℃,在波长248 nm和280 nm下分别对小分子药物和抗体进行检测,进样量25 μL。
将ADC样品用流动相制成质量浓度为4 mg·m L-1的溶液,12 000 r·min-1离心5 min,取上清液,在上述色谱条件下进样分离16 min,测定峰面积,计算DAR。
2.2 UV法取“2.1”项下的质量浓度为4 mg·m L-1的溶液适量,以流动相稀释至0.5 mg·m L-1,同时将ADC样品的配方缓冲液[精密称取L-组氨酸盐酸盐(2.09±0.01)g,甘露醇(30.96±0.01)g,蔗糖(29.09±0.01)g,聚山梨酯80(0.10±0.01)g,加800 mL超纯水溶解,用1 mol· L-1的氢氧化钠溶液调节pH至5.6,超纯水补充体积至1 L,0.45 μm滤膜过滤,即得]做同等比例稀释;以稀释后的配方缓冲液作为空白对照,在230~320 nm波长范围内对0.5 mg·m L-1溶液进行扫描,并选取248 nm和280 nm波长处的吸收度,计算DAR。
3 利用比尔兰伯特定律来进行DAR值计算光谱法是基于比尔兰伯特定律来对DAR值进行计算。该ADC中抗体和药物的最大吸收波长分别为280 nm和248 nm。
抗体为蛋白质,其含有苯环的氨基酸在280 nm波长处有其特征性的吸收峰,而整个蛋白由此产生在280 nm波长处的特定的消光系数,而所偶联的小分子药物则在248 nm波长处有其特征性的吸收峰,也会产生特定的消光系数。同样的抗体在248 nm波长处有吸收峰,而偶联的小分子药物在280 nm波长处同样也有吸收峰。通过测量ADC在280 nm以及248 nm波长处总的吸收度,可得出下面方程:
| $ {A_{280}} = {\varepsilon _{{\rm{Ab}}.280}} \times {C_{{\rm{ab}}}} \times l + {\varepsilon _{{\rm{D}}.280}} \times {C_{\rm{D}}} \times l $ | (1) |
| $ {\rm{ }}{A_{248}} = {\varepsilon _{{\rm{Ab}}.248}} \times {C_{{\rm{ab}}}} \times l + {\varepsilon _{{\rm{D}}.248}} \times {C_{\rm{D}}} \times l $ | (2) |
方程(2)除以方程(1),得出方程:
| $ \begin{array}{l} {\rm{DAR}} = ({\varepsilon _{{\rm{Ab}}.248}} - R \times {\varepsilon _{{\rm{Ab}}.280}})/(R \times {\varepsilon _{{\rm{D}}.280}} - {\varepsilon _{{\rm{D}}.248}})\\ R = {A_{248}}/{A_{280}} \end{array} $ | (3) |
其中A280和A248分别为ADC在280 nm和248 nm波长处的吸收度;εAb.280和εD.280分别为抗体以及小分子药物在280 nm波长处的消光系数,分别为215 380和1 500;εAb.248和εD.248分别为抗体以及小分子药物在248 nm波长处的消光系数,分别为82 921和15 900[9];CAb和CD分别为抗体以及小分子药物的浓度;l为测吸收值的光程长(本研究中为1 cm)。
利用SEC进行双波长(248 nm和280 nm)检测,分别积分2个波长下的总峰面积,带入方程(3)中,按以下方程(4)可以计算DAR:
| $ {\rm{DAR}} = 215\;380 \times \left( {R' - R} \right)/\left( {1\;500 \times R - 15\;900} \right) $ | (4) |
R=ADC在248 nm下的总峰面积除以280 nm下的总峰面积;R’=抗体在248 nm下的总峰面积除以280 nm下的总峰面积。
4 结果 4.1 双波长SEC法测定DAR通过对抗体和ADC进行双波长的SEC检测,分别计算其在248 nm和280 nm波长下的总峰面积,然后利用公式(4)计算其DAR值,结果如图 1所示,抗体在248 nm和280 nm下的总峰面积分别为4 037 818和10 054 327,ADC在248 nm和280 nm下的总峰面积分别为6 833 800和9 909 444,根据抗体和ADC在SEC双波长检测下的总峰面积,计算得到ADC的DAR值为4.17。该方法在测定ADC的DAR的同时,可以对其分子大小异构体进行检测,包括对ADC单体和多聚体的比例进行检测。如图 1和表 1所示,在280 nm检测波长下,ADC具有较好的纯度,单体 > 99.0%,多聚体含量在0.2%左右。
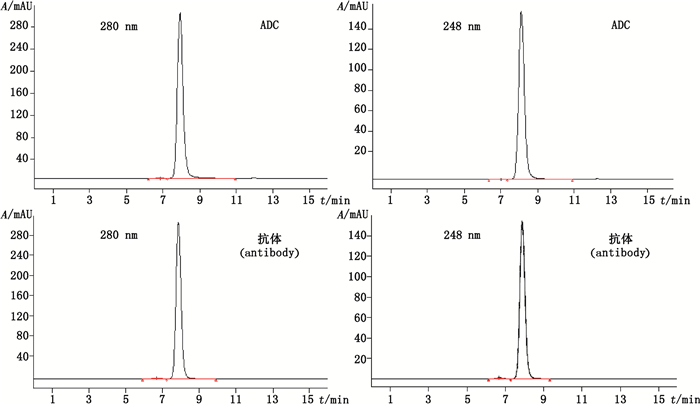
|
图 1 双波长SEC检测ADC的DAR Figure 1 DAR determination of ADC by dual wavelength SEC |
|
|
表 1 双波长SEC检测DAR方法学验证结果 Table 1 Validation of dual wavelength SEC method for DAR methodology |
同时对该方法精密性进行方法学验证,通过对3份重复制备的样品溶液以及同一样品溶液的3针连续进样的测定结果进行分析,显示(表 1)该方法在DAR测定以及大小异构体分析中具有良好的精密性,RSD为0.24%。同时,也对该方法的中间精密度进行了评价(分2 d在2台仪器上由2人分别进行独立检测,每次进行3针重复进样),DAR的RSD为0.24%。
4.2 UV法测定DAR如图 2所示,对ADC在248 nm和280 nm处的吸收度进行了测定,然后根据公式(3)计算得的DAR为3.97±0.11(n=3),RSD为2.8%。
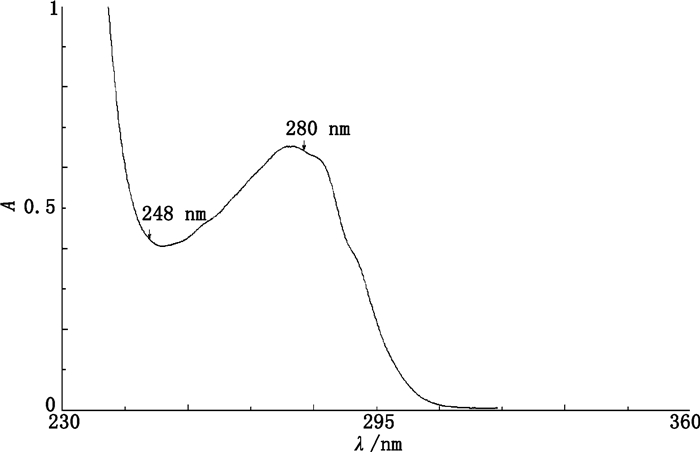
|
图 2 紫外分光光度法检测ADC的DAR Figure 2 DAR determination by UV spectrophotometry |
ADC由3部分组成:抗体、高效应的细胞毒性物质以及连接臂,连接臂可将抗体和细胞毒性物质偶联起来。药物偶联可以导致DAR以及药物在抗体上分布的异质性。由于抗体上的偶联位点(半胱氨酸、赖氨酸等氨基酸)以及药物和连接子的自身特点,包括药物是否带电荷、药物连接子存在的修饰等因素影响,准确测定DAR具有一定的挑战。目前对于ADC的DAR检测方法由疏水色谱法(HIC法)、反相高效液相色谱法(RP-HPLC法)、UV法、液质联用法(LC-MS法)等。其中HIC和RP-HPLC多用于半胱氨酸偶联的ADC的DAR分析,而UV则广泛适用于小分子药物在紫外/可见光下有发色基团,能表现出最大吸收值的ADC中[10]。MS法由于设备昂贵,操作分析复杂,在常规放行检测中较少使用,多用于ADC的表征分析[11]。
DAR作为ADC的关键质量属性,与其药效、药代和用药安全性密切相关[12-16],因此有必要建立准确、简便的分析方法用于常规质控当中。结合本研究,本文利用双波长SEC方法,对半胱氨酸偶联MMAE的ADC的DAR进行了测定,结果表明该方法具有良好的精密性。利用该方法进行ADC分析,可同时得出DAR和分子大小异构体的数据,节省实验和时间成本,同时可以避免样品配方缓冲液引起的结果干扰。因此,该方法可用于ADC的质控当中。
| [1] |
FRIGERIO M, KYLE AF. The chemical design and synthesis of linkers used in antibody drug conjugates[J]. Curr Top Med Chem, 2017, 17(32): 3393. |
| [2] |
LAMBERT JM, BERKENBLIT A. Antibody-drug conjugates for cancer treatment[J]. Annu Rev Med, 2018, 69: 191. DOI:10.1146/annurev-med-061516-121357 |
| [3] |
NASIRI H, VALEDKARIMI Z, AGHEBATI-MALEKI L, et al. Antibody-drug conjugates:promising and efficient tools for targeted cancer therapy[J]. J Cell Physiol, 2018, 233(9): 6441. |
| [4] |
CONNORS JM, JURCZAK W, STRAUS DJ, et al. Brentuximab vedotin with chemotherapy for stage Ⅲ or Ⅳ Hodgkin's lymphoma[J]. New Engl J Med, 2018, 378(4): 331. DOI:10.1056/NEJMoa1708984 |
| [5] |
YI JH, KIM SJ, KIM WS. Brentuximab vedotin:clinical updates and practical guidance[J]. Blood Res, 2017, 52(4): 243. DOI:10.5045/br.2017.52.4.243 |
| [6] |
KROP IE, KIM SB, MARTIN AG, et al. Trastuzumab emtansine versus treatment of physician's choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA):final overall survival results from a randomised open-label phase 3 trial[J]. Lancet Oncol, 2017, 18(6): 743. DOI:10.1016/S1470-2045(17)30313-3 |
| [7] |
CHEN T, CHEN Y, STELLA C, et al. Antibody-drug conjugate characterization by chromatographic and electrophoretic techniques[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1032: 39. DOI:10.1016/j.jchromb.2016.07.023 |
| [8] |
DONAGHY H. Effects of antibody, drug and linker on the preclinical and clinical toxicities of antibody-drug conjugates[J]. MAbs, 2016, 8(4): 659. DOI:10.1080/19420862.2016.1156829 |
| [9] |
HAMBLETT KJ, SENTER PD, CHACE DF, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate[J]. Clin Cancer Res, 2004, 10(20): 7063. DOI:10.1158/1078-0432.CCR-04-0789 |
| [10] |
CHEN Y. Drug-to-antibody ratio (DAR)by UV/vis spectroscopy[J]. Methods Mol Biol, 2013, 1045: 267. DOI:10.1007/978-1-62703-541-5 |
| [11] |
DAVIS JA, KAGAN M, READ J, et al. Immunoprecipitation middle-up LC-MS for in vivo drug-to-antibody ratio determination for antibody-drug conjugates[J]. Bioanalysis, 2017, 9(20): 1535. DOI:10.4155/bio-2017-0148 |
| [12] |
MALIK P, PHIPPS C, EDGINTON A, et al. Pharmacokinetic considerations for antibody-drug conjugates against cancer[J]. Pharm Res, 2017, 34(12): 2579. DOI:10.1007/s11095-017-2259-3 |
| [13] |
SAUERBORN M, van DONGEN W. Practical considerations for the pharmacokinetic and immunogenic assessment of antibody-drug conjugates[J]. BioDrugs, 2014, 28(4): 383. DOI:10.1007/s40259-014-0096-z |
| [14] |
EXCOFFIER M, JANIN-BUSSAT MC, BEAU-LARVOR C, et al. A new anti-human Fc method to capture and analyze ADCs for characterization of drug distribution and the drug-to-antibody ratio in serum from pre-clinical species[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1032: 149. DOI:10.1016/j.jchromb.2016.05.037 |
| [15] |
GOLDMACHER VS, AMPHLETT G, WANG L, et al. Statistics of the distribution of the abundance of molecules with various drug loads in maytansinoid antibody-drug conjugates[J]. Mol Pharm, 2015, 12(6): 1738. DOI:10.1021/mp5007536 |
| [16] |
JACKSON D, ATKINSON J, GUEVARA CI, et al. In vitro and in vivo evaluation of cysteine and site specific conjugated herceptin antibody-drug conjugates[J]. PLoS One, 2014, 9(1): e83865. DOI:10.1371/journal.pone.0083865 |
 2018, Vol. 38
2018, Vol. 38 
