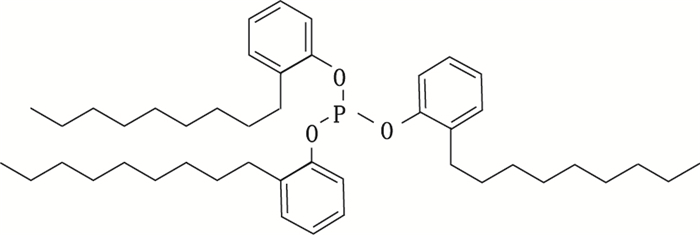
近年来,多层共挤膜凭借其良好的阻隔性能,重量轻,运输便捷等优点,逐渐取代玻璃、聚丙烯、聚氯乙烯等材料,越来越多地用于输液包装。随着其在国内外的广泛应用,其与药物的相容性问题也日益受到关注。为延长材料的寿命,抑制或延缓聚合物的氧化降解,在共挤膜生产过程中需要加入抗氧剂。常用的抗氧剂有酚类和亚磷酸酯类,其中三(壬苯基)亚磷酸盐(简称TNPP,结构见图 1)就是亚磷酸酯类抗氧剂的一种[1],其在共挤膜中的加入量大都介于0.05%~3%之间。由于TNPP也广泛用于食品接触包装中,欧洲委员会健康与消费者保护总司发布的风险评估报告中指出,普通消费者的TNPP日摄入量约为0.033 7 mg[2]。TNPP的水溶性较低(0.6 mg· L-1),口服毒性低[3]。动物毒理试验数据表明,大鼠口服的LD50为19 500 mg·kg-1[4]。考虑到TNPP油水分配系数log Pow较高(> 6)[3],如果从输液膜中迁出后被注射进入人体内,存在蓄积风险。因此,在药品和包装材料相容性研究中仍需对其进行定量。
|
图 1 TNPP(CAS No. 26523-78-4)的结构式 Figure 1 Structure of tris(nonylphenyl)phosphite (CAS No. 26523-78-4) |
目前,关于抗氧剂TNPP含量测定的方法报道甚少[5-6],且常见的亚磷酸酯类抗氧剂(如抗氧剂168)多采用液液萃取或固相萃取后直接采用液相色谱测定的方法[7-10]。但是,抗氧剂TNPP容易被氧化,在提取试验和样品处理等过程中可能存在稳定性的问题;另外,抗氧剂TNPP的亲水性弱,在反向色谱柱上保留较强,若采用一般抗氧剂的分析方法,不仅分析时间长,且灵敏度低。因此,本文建立了柱前衍生化-反相高效液相色谱法,对5种提取介质(水、0.9%氯化钠注射液、pH 3.5缓冲液、pH 8.0缓冲液和15%乙醇溶液)[11]中TNPP的迁移量进行测定。
1 仪器和试药高效液相色谱仪(Agilent infinity 1290);电子天平(梅特勒,XS205);低速台式离心机(上海安亭科学仪器厂,TDL-80-2B);微型涡旋混合仪(上海沪西分析仪器厂有限公司,XW-80A);SANYO高压蒸汽灭菌器(MLS-3750);烘箱(Binder FDL115)。
TNPP对照品(Sigma Aldrich,批号MKBW3609V);过氧化氢叔丁基(国药集团化学试剂有限公司,化学纯,批号20160715);0.9%氯化钠(上海华源长富药业,批号1506240101);pH 3.5缓冲液(取磷酸8 mL与三乙胺14 mL,加水稀释至1 500 mL,用三乙胺调节pH 3.5);pH 8.0缓冲液(称取磷酸氢二钾5.59 g与磷酸二氢钾0.41 g,加水稀释至1 000 mL,即得);15%乙醇(取无水乙醇150 mL,加水稀释至1 000 mL);乙腈,色谱纯;异丙醇,色谱纯;乙酸乙酯,色谱纯;水为实验室自制纯化水;3批输液膜均为五层共挤输液膜,由生产厂家提供。
2 方法和结果 2.1 色谱条件色谱柱:Agilent Eclipse XDB-C8(4.6 mm×150 mm,5 μm);流动相:乙腈-异丙醇(90:10);流速:1 mL·min-1;分析时间:18 min;柱温:35 ℃;检测波长:220 nm;进样量:20 μL。
2.2 对照品储备液的配制精密称取TNPP对照品110.35 mg,置于25 mL量瓶中,加入二氯甲烷1 mL溶解,用乙腈稀释至刻度;精密移取上述溶液1.0 mL,置于25 mL量瓶中,用乙腈稀释至刻度,得对照品储备液(176.6 mg· L-1)。
2.3 提取试验将包装材料清洗干净,裁成0.5 cm×2 cm条状,作为供试品,放入密闭容器内,按接触面积6 cm2·m L-1比例加入提取溶剂进行浸提(按表 1条件)。
|
|
表 1 提取试验条件 Table 1 Extraction condition |
分别取乙酸乙酯和过氧化氢叔丁基各50 mL,置分液漏斗中,振摇使混匀,静置分层,取上层溶液,即得。
2.4.2 衍生化方法精密移取样品溶液2.0 mL,分别置10 mL具塞试管中,精密加入衍生化试剂2.0 mL,涡旋30 s后,3 800 r·min-1离心2 min,取上层溶液,即得供试品溶液。
2.4.3 衍生化原理和结果本文通过在样品溶液中加入叔丁基过氧化氢,将TNPP由亚磷酸酯氧化成更加稳定的磷酸酯[12](见公式1)后,采用乙酸乙酯萃取后测定。
| $ {\left( {{\rm{C}}{{\rm{H}}_{\rm{3}}}} \right)_{\rm{3}}}{\rm{COOH}}{\left( {{{\rm{C}}_{\rm{9}}}{{\rm{H}}_{{\rm{23}}}}{\rm{O}}} \right)_{\rm{3}}}{\rm{P}} \to {\left( {{{\rm{C}}_{\rm{9}}}{{\rm{H}}_{{\rm{23}}}}{\rm{O}}} \right)_{\rm{3}}}{\rm{P = O + }}{\left( {{\rm{C}}{{\rm{H}}_{\rm{3}}}} \right)_{\rm{3}}}{\rm{COH}} $ | (1) |
将TNPP完全氧化后进行测定,增加了溶液稳定性和方法准确性。另外,由于TNPP的氧化型(磷酸酯)极性强于TNPP(亚磷酸酯),在反相色谱柱上的保留弱,因此缩短了分析时间,改善了色谱峰形,增加了检测灵敏度(见图 2)。

|
a. TNPP(亚磷酸酯)[TNPP(phosphite)] b. TNPP的氧化型(磷酸酯)[oxidized TNPP(phosphate)] 图 2 高效液相色谱图 Figure 2 HPLC chromatograms |
取对照品储备液适量,用水逐步稀释,按照“2.4.2”项下方法衍生化后进样,以信噪比为3时测得检测下限,信噪比为10时测得定量下限,测得本方法的检测下限为0.4 mg· L-1,定量下限为0.9 mg· L-1。
2.5.2 线性关系考察取对照品储备液适量,用水稀释,配得质量浓度分别为0.9、1.8、3.5、5.3、9、14、18 mg· L-1的线性对照溶液,按照“2.4.2”项下方法衍生化后进样,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,按照最小二乘法进行线性回归,得到线性方程:
| $ Y = 16.878\;7X + 1.837\;0\;\;\;\;r = 0.999\;9 $ |
线性范围为0.9~18 mg·m L-1。
2.5.3 精密度试验取质量浓度为8 mg· L-1的对照品溶液,按照“2.4.2”项下方法进行衍生化,平行配制6份衍生化溶液后进样测定,结果RSD为0.8%。
2.5.4 回收率试验精密移取对照品储备液0.1、0.25、0.4 mL,分别置5 mL量瓶中,用注射用水、0.9%氯化钠注射液、pH 3.5缓冲液、pH 8.0缓冲液和15%乙醇稀释并定容至刻度,按“2.4.2”项下方法衍生化,同一浓度平行制备3份后进样测定,结果见表 2。
|
|
表 2 抗氧剂TNPP在5种提取介质中的回收率(n=3) Table 2 Results of recovery test of tris(nonylphenyl)phosphite in five different extraction solvents |
取质量浓度为8 mg· L-1的对照品溶液,按照“0”项下方法衍生化后,在0 h和24 h分别进样3次,结果RSD为0.6%。
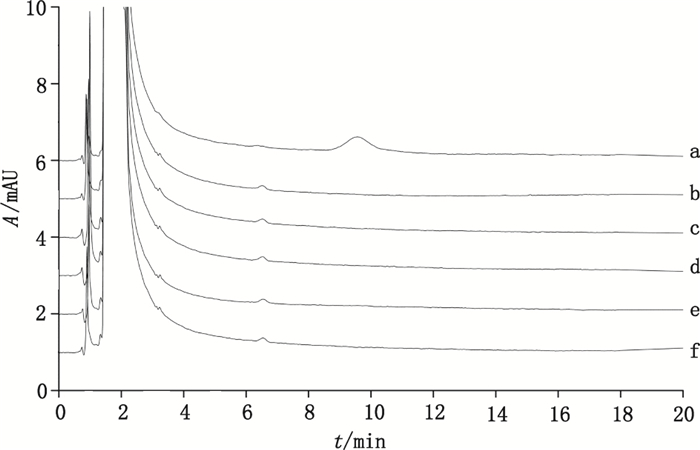
2.6 样品测定按照“2.4.2”项下方法制备供试品溶液,对3批样品中TNPP在5种提取介质中的迁移量进行测定。检测结果(典型图谱见图 3)表明,TNPP在5种提取介质中均未检出(检测限为0.4 mg· L-1)。这可能是由于其极性小,在水性提取介质中的溶解度低,不易从包装材料中迁出。
|
a.检测下限溶液(solution of detection limit)b.水(water)c. 0.9%氯化钠注射液(0.9% NaCl injection)d. pH 3.5缓冲液(pH 3.5 buffer)e. pH 8.0缓冲液(pH 8.0 buffer)f. 15%乙醇溶液(15% ethanol solution) 图 3 样品提取试验结果的典型高效液相色谱图(目标物保留时间:9.5 min) Figure 3 Typical HPLC chromatograms of the extraction testing results(target compound retention time:9.5 min) |
欧盟规定,食品接触材料中TNPP的特定迁移量不得过30 mg·kg-1[13],但是,目前未检索到相关标准或文献报道其在药品包装材料中的限度。欧洲化学品管理局报告中显示,TNPP对大鼠在2年给药周期内口服的未观察到有害作用剂量(no observed adverse effect level,NOAEL)为每日167 mg·kg-1[4],因此,可以按照ICH提供的公式推算注射液包装材料中TNPP的迁移量限度[14]。用100作为暴露途径的不确定因子(按照口服生物利用度 < 1%计算),用5作为物种之间差异系数,用10作为个体差异系数,其余可变系数均为1,按成人体重50 kg,计算得到TNPP静脉注射的PDE为每日1.67 mg。假定注射液每日最大用药剂量为1 000 mL,则分析评价阈值(AET)为1.67 mg· L-1,高于方法检测下限(0.4 mg· L-1)。因此,本方法不仅可以满足提取试验的灵敏度要求,同样可以用于迁移试验中TNPP迁移量的测定。
3 讨论本文建立了柱前衍生化-反相高效液相色谱法,对5种提取介质中抗氧剂TNPP的迁移量进行测定,为包装材料与药液的相容性研究和其安全性评价奠定了基础[15-16]。本方法将液液萃取和衍生化合并为一步操作,相较于固相萃取法[7],具有简单、快速和便于操作等优点。而且萃取溶剂采用乙酸乙酯不仅有良好的回收率,而且与常用的二氯甲烷相比[8],大大降低了对操作人员的健康危害。采用柱前衍生化法,不仅解决了抗氧剂由于易被氧化而产生的溶液稳定性问题,而且降低了待测物的色谱保留,缩短了分析时间,改善了色谱峰形,增加了检测灵敏度,可以满足提取和迁移试验中对TNPP的迁移量测定要求。另外,本方法的建立也为其他亚磷酸酯类抗氧剂在分析过程中遇到的稳定性和灵敏度问题提供了有益的参考。
| [1] |
叶芳胜, 韩晓辉, 李树岗, 等. 三(壬苯基)亚磷酸酯抗氧剂的合成新工艺[J]. 塑料工业, 2007, 35(12): 10. YE FS, HAN XH, LI SG, et al. Novel technology for synthesis of tris (nonylphenyl)phosphite antioxidant[J]. China Plast Ind, 2007, 35(12): 10. DOI:10.3321/j.issn:1005-5770.2007.12.004 |
| [2] |
European Commission. Opinion on risk assessment report on tris (nonylphenyl)phosphite (TNPP)[EB/OL]. 2006[2017-06-01]. http://ec.europa.eu/health/archive/ph_risk/committees/04_scher/docs/scher_o_039.pdf
|
| [3] |
European Chemicals Agency. Tris(nonylphenyl)phosphite summary risk assessment report[EB/OL]. 2007[2017-06-01]. https://echa.europa.eu/documents/10162/13630/trd_rar_hh_france_tnpp_en.pdf/8d3c74bb-fa76-4b25-a071-6d2d09a8ec95
|
| [4] |
European Chemicals Agency. Proposal for harmonized classification and labeling, tris(nonylphenyl)phosphite (26523-78-4)[EB/OL]. 2009[2017-06-01]. https://echa.europa.eu/documents/10162/a78f34cd-dac8-42d0-b515-c5df6aa77d25
|
| [5] |
MOTTIER P, FRANK N, DUBOIS M, et al. LC-MS/MS analytical procedure to quantify tris(nonylphenyl)phosphite, as a source of the endocrine disruptors 4-nonylphenols, in food packaging materials.[J]. Food Add Cont Part A Chem Anal Cont Exp Risk Ass, 2014, 31(5): 962. DOI:10.1080/19440049.2014.896481 |
| [6] |
SCHABRON JF, BRADFIELD DZ. Determination of tris(nonylphenyl)phosphite and nonylphenol in butadiene-styrene copolymers by high-performance liquid chromatography[J]. Anal Chim Acta, 1981, 129(8): 243. |
| [7] |
李兴春, 路杰, 李洁, 等. HPLC法测定高密度聚乙烯桶包装血液透析浓缩液中抗氧剂1010、抗氧剂330、抗氧剂1076、抗氧剂168的含量[J]. 药学研究, 2016, 35(2): 86. LI XC, LU J, LI J, et al. Determination of antioxidant 1010, antioxidant 330, antioxidant 1076 and antioxidant 168 in high denesity polyethylene barrels for blood dialysis concentrate packing by HPLC[J]. J Pharm Res, 2016, 35(2): 86. |
| [8] |
李樾, 孙会敏, 张烜. 塑料输液包装材料与容器中抗氧剂含量测定方法的建立及其在注射液中的迁移研究[J]. 中国药学杂志, 2016, 51(19): 1699. LI Y, SUN HM, ZHANG H. Determination of antioxidants in plastic infusion packaging materials and containers and the migration to injections[J]. China Pharm J, 2016, 51(19): 1699. |
| [9] |
黄萍, 刘兴兰. SPE-HPLC法测定三层共挤输液袋中抗氧剂在氧氟沙星氯化钠注射液中的迁移量[J]. 中国药师, 2016, 19(12): 2267. HUANG P, LIU XL. Determination of antioxygen migration amount in ofloxacin and sodium chloride injection from three layer coextrusion infusion bags by SPE-HPLC[J]. China Pharm, 2016, 19(12): 2267. DOI:10.3969/j.issn.1008-049X.2016.12.018 |
| [10] |
王军, 曲春浩, 邱利平, 等. 抗氧化剂168的高效液相色谱法分析[J]. 应用化工, 2012, 41(9): 1635. WANG J, QU CH, QIU LP, et al. Analysis of antioxidants 168 by high performance liquid chromatography[J]. Appl Chem Ind, 2012, 41(9): 1635. |
| [11] |
国家食品药品监督管理局. 化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)[EB/OL]. 2012[2017-06-01]. http://www.sda.gov.cn/WS01/CL0844/75197.html China Food and Drug Administration. Technical guidelines for the research on the compatibility of chemical medicine injection and plastic packing materials (Trial Implementaion)[EB/OL]. 2012[2017-06-01]. http://www.sda.gov.cn/WS01/CL0844/75197.html |
| [12] |
程媛媛, 陈旻, 童敏伟, 等. 亚磷酸酯类抗氧剂的合成和发展[J]. 塑料助剂, 2016(2): 5. CHENG YY, CHEN M, TONG MW, et al. Review of the synthesis and development of tris (nonylphenyl)phosphite antioxidant[J]. Plast Add, 2016(2): 5. |
| [13] |
European Union, Office Publications. Commission regulation (EU)No 10/2011 of 14 January 2011 on plastic materials and articles intended to come into contact with food Text with EEA[EB/OL]. 2011[2017-06-01]. http://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1482902855638&uri=CELEX:32011R0010
|
| [14] |
ICH. Guidline for elemental impurities[EB/OL]. 2014[2017-06-01]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3D/Q3D_Step_4.pdf
|
| [15] |
刘小慧, 印晖, 严方, 等. 预装式注射器与药物相容性的研究进展[J]. 中国药科大学学报, 2016, 47(3): 275. LIU XH, YIN H, YAN F, et al. Compatibility of pre-filled syringes with phamaceutical product[J]. J China Pharm Univ, 2016, 47(3): 275. DOI:10.11665/j.issn.1000-5048.20160304 |
| [16] |
JENKE D. Safety risk categorization of organic extractables associated with polymers used in packaging, delivery and manufacturing systems for parenteral drug products[J]. Pharm Res, 2015, 32(3): 1105. DOI:10.1007/s11095-014-1523-z |
 2018, Vol. 38
2018, Vol. 38 