近年来, 苯二氮䓬类药物、抗精神病药物和抗抑郁药物单独使用或合并用药的处方量越来越高[1-3]。由于这些药物的治疗窗较窄, 个体变异较大及不良反应严重, 如抗精神病药物所致的急性心源性死亡、抗抑郁药所致的血清素毒性综合症及慢性苯二氮䓬类药物服用所致的跌倒和交通事故风险增高[3-6], 因此, 根据AGNP指南[7], 应该对精神科药物进行治疗药物浓度检测。由于氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林的有效治疗参考浓度范围和实验室警戒浓度较低, 常规的高效液相色谱法较难达到定量下限, 本文建立了这6个药物在线柱切换高效液相色谱串联质谱(high performance liquid chromatography-mass-mass, HPLC-MS/MS)方法, 并根据生物样品定量分析方法指导原则(草案)[8]进行了验证。
1 对照品和试剂对照品氟哌啶醇(批号MJE-594A, Sigma)、阿普唑仑(批号9201, 国家麻醉品实验室), H3-利培酮(内标)(3-KHI-168-3, Toronto Research chemicals, TRC); 对照品氟奋乃静(批号100162)、氟哌噻吨(批号100043)、丁螺环酮(批号1078733)和米安色林(批号100812)购自中国食品药品检定研究院。甲醇和乙腈(HPLC级), 氨水(HPLC级), 购自Merck公司。
2 仪器API 4000 Qtrap AB四极杆线性离子肼混合质谱仪:美国Applied Biosystems SCIEX公司, 配备电喷雾离子源(electrospray ionization, ESI)以及Analyst1.6.1数据处理软件; 美国赛默飞公司U3000型高效液相色谱仪。
3 方法的建立及验证 3.1 溶液的配制 3.1.1 混合对照品工作液6个抗精神病药物用纯甲醇配制终质量浓度为1 mg·mL-1的储备液备用; 精密吸取氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的储备液各100 µL及米安色林和阿普唑仑的储备液各400 µL, 置25 mL量瓶中, 充分混匀, 加甲醇定容至25 mL, 制备终质量浓度分别为4、4、4、4、16、16 µg·mL-1混合对照品工作液, -20 ℃储存, 备用。
3.1.2 内标工作液用乙腈配制H3-利培酮质量浓度为1 mg·mL-1的储备液, 稀释成2 ng·mL-1的内标工作液, 4 ℃储存, 备用。
3.1.3 标准曲线溶液精密吸取氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、米安色林和阿普唑仑的混合对照品工作液100 µL, 置10 mL量瓶中, 加入多个来源的混合血清, 充分混匀后, 定容; 依次倍比稀释成质量浓度分别为含氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮40、20、10、5、2.5、1.25、0.625 ng·mL-1和米安色林、阿普唑仑160、80、40、20、10、5、2.5 ng·mL-1的系列标准曲线溶液。
3.1.4 质量控制样品取空白血清, 按照标准曲线制备方法, 分别配制含氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、米安色林和阿普唑仑的高、中、低质量控制样品, 其对应浓度:氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮分别为32、6.4和1.6 ng·mL-1; 米安色林和阿普唑仑分别为128、64和6.4 ng·mL-1。
3.2 血样处理40 µL血清样本加入乙腈450 µL(含2 ng·mL-1的H3-利培酮内标)进行蛋白质沉淀, 4℃离心(4 000 r·min-1)10 min。后取上清液20 µL进样。
3.3 色谱条件的建立固相萃取柱: Waters XbridgeTM C8(5 µm, 2.1 mm×30 mm); 柱温:室温; 流动相:见表 1; 流速: 0.5 mL·min-1。
|
|
表 1 固相萃取柱的流动相梯度模式 Table 1 The HPLC gradient mode of mobile phase in SPE column |
分析柱: Waters XbridgeTM C18(3.5 µm, 2.1 mm×150 mm); 柱温:室温; 流动相:乙腈-1%氨水(pH 11)(70:30);流速: 0.2 mL·min-1。
3.4 在线固相萃取(on-line solid phase extraction)过程在线柱固相萃取系统由2个三元梯度泵和1个六通阀组成(见图 1)。如图 1-A所示, 样本进入固相萃取柱, 在左泵系统[乙腈-1%氨水(pH 11)(5:95)]下洗脱0.8 min, 由于精神科药物的pKa大多数在8~10之间, 因此, 在pH 11的洗脱条件下, 亲脂性待测物保留在固相萃取柱上, 亲水性的干扰物冲洗出固相萃取柱进入废液瓶。冲洗0.8 min, 六通阀切换(图 1-B), 固相萃取柱接通到分析柱, 在左泵系统的洗脱条件下洗脱[乙腈-1%氨水(pH 11) (70:30)], 待测物从固相萃取柱洗脱进入分析柱, 并进行色谱分离。

|
A.分析物的提取(extraction of the analytes) B.洗脱步骤(elution step) 图 1 在线固相萃取过程 Figure 1 On-line SPE procedure |
电喷雾离子源(ESI)的离子化方式为正离子方式; 以多反应监测(multiple reaction monitoring, MRM)方式进行检测, MRM参数见表 2, 各化合物子离子谱见图 2。
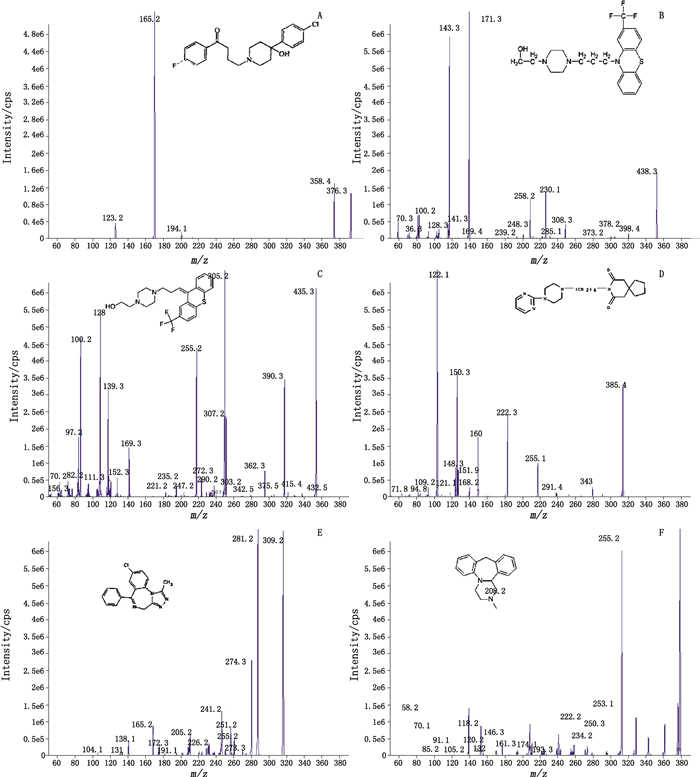
|
图 2 氟哌啶醇(A)、氟奋乃静(B)、氟哌噻吨(C)、丁螺环酮(D)、阿普唑仑(E)、米安色林(F)的子离子谱图 Figure 2 The ion mass spectra of haloperidol(A), fluphenazine(B), flupentixol(C), buspirone(D), alprazolam(E), mianserin(F) |
|
|
表 2 HPLC-MS/MS多反应监测参数 Table 2 HPLC-MS/MS multiple reaction monitoring parameters |
考察不同来源的6份空白血清样品、空白血清加入内标或定量下限氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑及米安色林混合物。在6个化合物保留时间处, 空白血清和内标处均未出现干扰峰(图 3~5)。
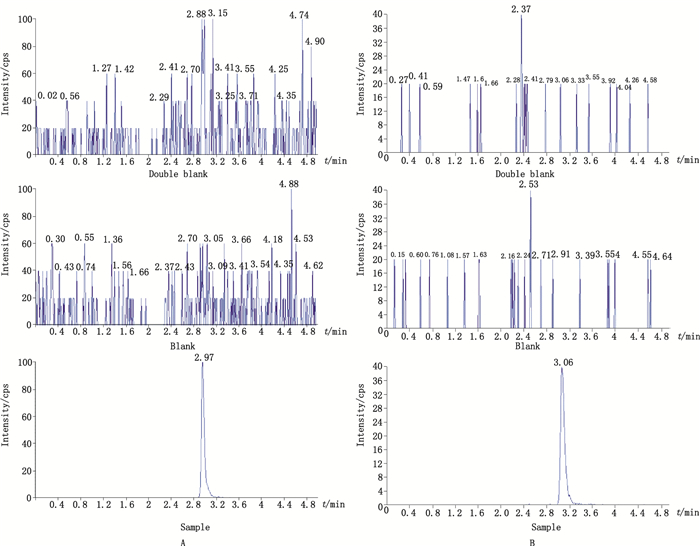
|
A.氟哌啶醇(haloperidol) B.氟奋乃静(fluphenazine) 图 3 空白血清、加有内标的空白血清及加内标和氟哌啶醇、氟奋乃静、定量下限血清样本的MRM谱图 Figure 3 Representative MRM chromatograms for haloperidol and fluphenazine from a blank serum sample, a blank serum sample spiked with internal satnadard, and the LLOQ samples spiked with internal standard |
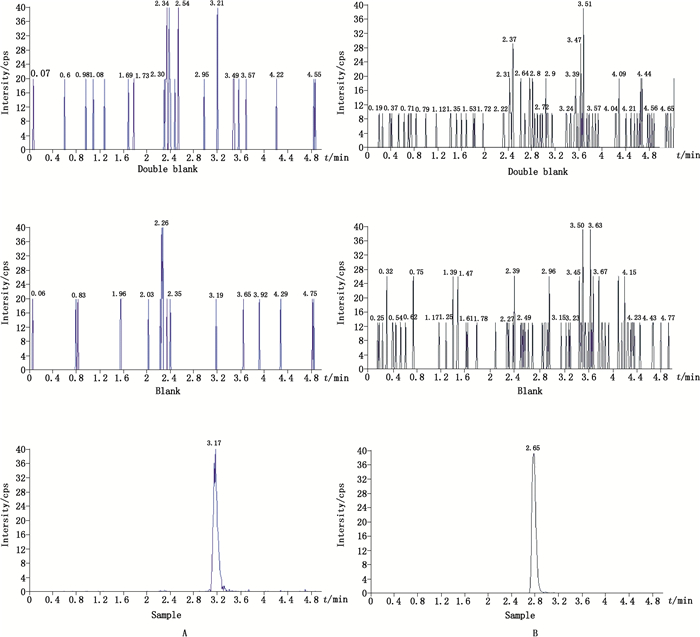
|
A.氟哌噻吨(flupentixol) B.丁螺环酮(buspirone) 图 4 空白血清、加有内标的空白血清加内标氟哌噻吨和丁螺环酮定量下限浓度血清样本的MRM谱图 Figure 4 Representative MRM chromatograms for flupentixol and buspirone from a blank serum sample, a blank serum sample spiked with internal satnadard, and the LLOQ samples spiked with internal standard |
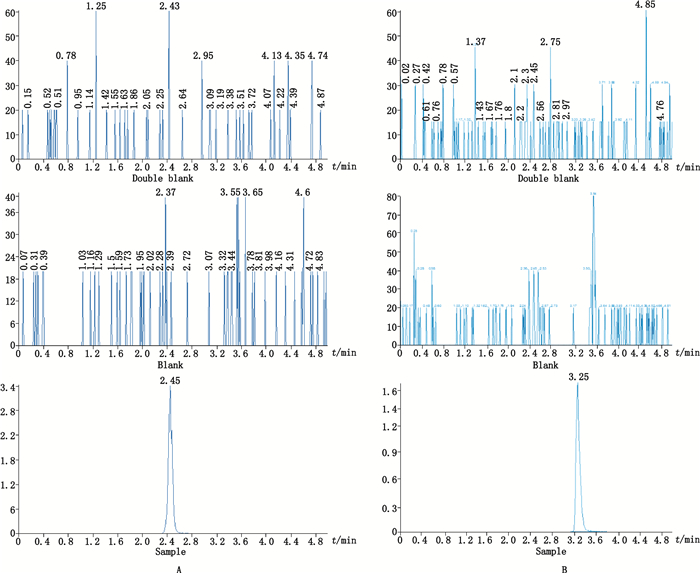
|
A.阿普唑仑(alprazolam) B.米安色林(mianserin) 图 5 空白血清、加有内标的空白血清及加内标和阿普唑仑及米安色林定量下限血清样本的MRM谱图 Figure 5 Representative MRM chromatograms for alprazolam and mianserin from a blank serum sample, a blank serum sample spiked with internal satnadard, and the LLOQ samples spiked with internal standard. |
为考察高浓度样本的残留效应, 在高浓度样本(线性最高浓度点)进样后, 进空白血清样本, 空白血清样本在氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林出峰处的峰高分别为定量下限峰高的0.20%、1.48%、2.04%、0.15%、0.99%和0.70%。提示本方法检测氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林残留效应不影响分析测定。
3.6.3 定量下限本方法中氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的定量下限浓度为0.625 ng·mL-1, 阿普唑仑和米安色林的为2.5 ng·mL-1。上述6个化合物的6个分析批的定量下限浓度测定结果符合相关要求, 其准确度分别为-1.4%、3.0%、-2.7%、0.48%、-5.9%、-2.5%, 精密度分别为3.9%、3.0%、0.74%、4.0%、4.7%、3.6%。
3.6.4 检测下限本方法中氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的检测下限为0.015 6 ng·mL-1; 阿普唑仑和米安色林的为0.062 5 ng·mL-1。
3.6.5 标准曲线线性及定量范围取标准血清样品, 按“3.2”项下方法处理, 以血清中待测物浓度为横坐标, 待测物与内标物的峰面积比为纵坐标, 用加权最小二乘法进行回归计算, 求得氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的标准曲线方程:
Y=0.010 8+0.994 0X r=0.999 4
Y=0.005 4+0.999 5X r=0.999 8
Y=0.004 9+0.996 2X r=0.999 1
Y=0.007 3+0.998 0X r=0.999 2
Y=0.077 2+1.014 7X r=0.998 6
Y=0.016 0+1.004 5X r=0.999 2
氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮质量浓度在0.625~40 ng·mL-1、阿普唑仑和米安色林质量浓度在2.5~160ng·mL-1范围内线性良好(表 3), r均 > 0.99, 每个待测物测定校正标样后计算出浓度均值的RSD < 15%(n=7), 校正标样计算的浓度均在标示值的±15%范围内(见表 3)。
|
|
表 3 氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林校正样本回算后的准确度 Table 3 The accuracies(% of deviation)of haloperidol, fluphenazine, flupentixol, buspirone, alprazolam and mianserin calibration standards |
考察了6个来源的空白人血清在3个浓度范围内的基质效应, 其中氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的质量浓度分别为32、6.4、1.6 ng·mL-1, 阿普唑仑和米安色林的质量浓度分别为128、64和6.4 ng·mL-1。氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林及内标的基质效应分别见表 4, 氟哌啶醇、丁螺环酮和米安色林表现出轻度的基质抑制作用; 氟哌噻吨和氟奋乃静表现出重度基质抑制作用; 阿普唑仑和氘代利培酮表现出轻度基质增强作用。同时, 氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林的基质效应在3个浓度水平内的准确度和三个浓度间的精密度RSD均 < 15%。
|
|
表 4 6个药物和内标的基质效应 Table 4 The matrix effects of six drugs and internal standard |
取高、中、低质量控制液及定量下限各5份, 在不同天分别制备并测定3个分析批, 计算批内、批间精密度和准确度。氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林的批内、批间精密度和准确度见表 5, 符合批内、批间精密度和准确度在15%范围内, 定量下限在20%范围内的标准。
|
|
表 5 批内、批间精密度和准确度 Table 5 The intra-and inter-assay precisions and accuracies |
氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑仑和米安色林的3个水平的质控样本在室温放置12 h、处理后自动进样器中12 h及冻融3次(-80~25 ℃)等条件下性质稳定, 含量没有下降, 见表 6。
|
|
表 6 质控样本在不同条件的稳定性 Table 6 The stabilities of QC samples under different conditions(n=5) |
氟哌啶醇、氟奋乃静、氟哌噻吨为第1代抗精神病药物, 其临床治疗参考质量浓度范围为1~10 ng·mL-1, 实验室警戒质量浓度15 ng·mL-1; 抗焦虑药丁螺环酮和阿普唑仑临床治疗参考质量浓度范围分别为1~4和5~50 ng·mL-1, 实验室警戒质量浓度8和100 ng·mL-1; 抗抑郁药米安色林临床治疗参考质量浓度范围15~70 ng·mL-1, 实验室警戒质量浓度140 ng·mL-1。根据最新的指导原则, 氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮、阿普唑和米安色林在临床应用过程中, 氟哌啶醇和氟奋乃静强烈推荐进行临床治疗药物浓度监测(therapeutic drug monitoring, TDM); 氟哌噻吨推荐TDM; 丁螺环酮和米安色林TDM有临床意义; 阿普唑伦TDM可能有临床意义[7]。因此, 这6个化合物在临床应用中有必要进行TDM。
为了临床TDM的需要, 本方法的线性范围覆盖这6个化合物的临床参考治疗浓度范围和实验室警戒浓度, 氟哌啶醇、氟奋乃静、氟哌噻吨和丁螺环酮的线性范围为0.625~40 ng·mL-1, 阿普唑伦和米安色林的线性范围为2.5~160 ng·mL-1。
生物样本分析过程中, 样本的前处理是一个比较费时、费力, 同时也明显影响分析结果的限速过程[9]。蛋白质沉淀是一种比较常用的样本前处理方法, 能够防止色谱分析过程中色谱柱的堵塞, 质谱分析过程中的离子源污染[10], 因此, 蛋白质沉淀方法广泛用于抗精神病药物和抗抑郁药物的治疗药物浓度监测, 并且回收率能达到90%以上[11], 但蛋白质沉淀技术用于质谱分析的前处理可以导致严重的基质效应。在线柱切换技术是在固相萃取技术发展起来的一种自动化的技术, 因此, 继承了固相萃取技术的优点:高效、低毒和便于操作等[12-15]。本方法结合蛋白质沉淀和在线柱切换技术, 先通过蛋白质沉淀, 再经在线柱切换技术充分洗脱掉血清中内源性干扰物, 使得进入分析柱的待测物更加干净, 因此, 本方法的干扰少, 重复性好, 操作简便, 缩短了样品处理周期[16]。此外, 可以同时测定6个化合物, 分析时间仅5 min, 用于临床TDM极具优势。2014年Cristina[17]报道一篇方法学文章, 氟哌啶醇、氟奋乃静、丁螺环酮和米安色林的检测下限分别为0.9、6.9、1.2和3.9 ng·mL-1。本方法中, 氟哌啶醇、氟奋乃静、氟哌噻吨、丁螺环酮的检测下限仅为0.015 6 ng·mL-1, 阿普唑仑和米安色林的为0.062 5 ng·mL-1, 明显低于文献报道的结果, 可能与样本前处理方法有关。
5 结论本方法根据生物样品定量分析方法指导原则进行了验证, 相关指标均符合指导原则的要求。证实了方法稳定性和可靠性。
| [1] |
ISACSSON G, AHLNER J. Antidepressants and the risk of suicide in young persons-prescription trends and toxicological analyses[J]. Acta Psychiatr Scand, 2014, 129(4): 296. DOI:10.1111/acps.12160 |
| [2] |
VERDOUX H, TOURNIER M, BEGAUD B. Antipsychotic prescribing trends:a review of pharmaco-epidemiological studies[J]. Acta Psychiatr Scand, 2010, 121(1): 4. DOI:10.1111/acp.2009.121.issue-1 |
| [3] |
CLAY E, FALISSARD B, MORRE N, et al. Contribution of prolonged-release melatonin and anti-benzodiazepine campaigns to the reduction of benzodiazepine and Z-drugs consumption in nine European countries[J]. Eur J Clin Pharmacol, 2013, 69(4): 1. DOI:10.1007/s00228-012-1424-1 |
| [4] |
BIANCHI S, BIANCHINI E, SCANAVACCA P. Use of antipsychotic and antidepressant within the psychiatric disease centre, regional health service of ferrara[J]. BMC Clin Pharmacol, 2011, 11(21): 1. |
| [5] |
RAYWA, CHUNGCP, MURRAY KT, et al. Atypical antipsychotic drugs and the risk of sudden cardiac death[J]. N Engl J Med, 2009, 360(3): 225. DOI:10.1056/NEJMoa0806994 |
| [6] |
SAAR E, BEYER J, GEROSTAMOULOS D, et al. The time-dependant post-mortem redistribution of antipsychotic drugs[J]. Forensic Sci Int, 2012, 222(1-3): 223. DOI:10.1016/j.forsciint.2012.05.028 |
| [7] |
HIEMKE C, BAUMANN P, BERGEMANN N, et al. AGNP consensus guidelines for therapeutic drug monitoring in psychiatry:update 2011[J]. Pharmacopsychiatry, 2011, 44(6): 195. DOI:10.1055/s-0031-1286287 |
| [8] |
钟大放, 李高, 刘昌孝. 生物样品定量分析方法指导原则(草案)[J]. 药的评价研究, 2011, 24(6): 409. ZHONG DF, LI G, LIU CX. Guideline on bioanalysis:method validation and analysis of study samples(draft)[J]. Drug Eval Res, 2011, 24(6): 409. |
| [9] |
ASHRIASHRI NY, ABDEL-REHIM M. Sample treatment based on extraction techniques in biological matrices[J]. Bioanalysis, 2011, 3(17): 2003. DOI:10.4155/bio.11.201 |
| [10] |
CHEN L, WANG H, ZENG Q, et al. On-line coupling of solid-phase extraction to liquid chromatography-a review[J]. J Chromatogr Sci, 2009, 47(8): 614. DOI:10.1093/chromsci/47.8.614 |
| [11] |
SISTIK P, TURJAP M, IORDACHE AM, et al. Quantification of selected antidepressants and antipsychotics in clinical samples using chromatographic methods combined with mass spectrometry:a review(2006-2015)[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2016, 160(1): 39. DOI:10.5507/bp.2015.065 |
| [12] |
CAGLAR S, MORELLO R, BOOS KS. Development and validation of an on-line multidimensional SPE-LC-MS/MS method for the quantitation of tetrandrine in blood samples[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 988: 25. DOI:10.1016/j.jchromb.2015.02.021 |
| [13] |
PENSI D, DE NICOLO A, PINON M, et al. An UPLC-MS/MS method coupled with automated on-line SPE for quantification of tacrolimus in peripheral blood mononuclear cells[J]. J PharmBiomed Anal, 2015, 107: 512. |
| [14] |
FERNANDEZ-RAMOS C, SATINSKY D, SOLICH P. New method for the determination of carbamate and pyrethroid insecticides in water samples using on-line SPE fusedcore column chromatography[J]. Talanta, 2014, 129: 579. DOI:10.1016/j.talanta.2014.06.037 |
| [15] |
ROGEBERG M, MALEROD H, ROBERG-LARSEN H, et al. On-line solid phase extraction-liquid chromatography, with emphasis on modern bioanalysis and miniaturized systems[J]. J Pharm Biomed Anal, 2014, 87: 120. DOI:10.1016/j.jpba.2013.05.006 |
| [16] |
KIRCHHERR H, KUHN-VELTEN WN. Quantitative determination of forty-eight antidepressants and antipsychotics in human serum by HPLC tandem mass spectrometry:a multi-level, single-sample approach[J]. J Chromatogr B, 2006, 843(1): 100. DOI:10.1016/j.jchromb.2006.05.031 |
| [17] |
SEMPIO C, MORINI L, VIGNALI C, et al. Simple and sensitive screening and quantitative determination of 88 psychoactive drugs and their metabolites in blood through LC-MS/MS:application on postmortem samples[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 970: 1. DOI:10.1016/j.jchromb.2014.08.039 |
 2018, Vol. 38
2018, Vol. 38 
