2. 河西学院化学化工学院, 张掖 734000;
3. 兰州大学药学院, 兰州 730000
2. College of Chemistry and Chemical Engineering, Hexi University, Zhangye 734000, China;
3. College of Pharmacy, Lanzhou University, Lanzhou 730000, China
出于对人工合成的抗氧化剂的安全性考虑, 越来越多的学者倾向于从植物资源中开发天然的抗氧化剂。植物资源中抗氧化活性成分的传统筛选思路为“活性成分分离-结构鉴定-抗氧化活性测定”, 该方法费时费力, 还难以筛选到一些具有高活性的痕量抗氧化物质。1, 1-二苯基-2-三硝基苯肼自由基(1, 1-diphenyl-2-piciylhydrazyl free radical, DPPH·)在517 nm处具有特征吸收, 以一定浓度的DPPH·甲醇溶液作为流动相, 可在高效液相色谱517 nm检测波长下得到平整的基线。当有自由基清除剂存在时, 自由基清除剂与DPPH·反应, 其吸收减弱, 在色谱图上表现为负峰, 从而利用该原理进行抗氧化活性成分的在线筛选。目前, HPLC-DPPH·在线筛选技术已成为植物资源抗氧化活性成分筛选的主要方法之一。崔玉雷等[1]采用此方法从雪灵芝提取物中筛选得到5种抗氧化活性成分; Vasilisa等[2]采用此方法从可可粉的浓缩多酚提取物中筛选得到11种抗氧化活性成分; 张晓霞等[3]在HPLC-DPPH·-UV/Vis技术基础上结合了MS技术, 从梅花中筛选得到21种抗氧化活性物质。
蔷薇科鲜卑花属植物共4种, 分布于南欧、西伯利亚和中国。中国有鲜卑花Sibiraea laevigata(L.)Maxim.、窄叶鲜卑花Sibiraea angustata(Rehd.)Hand.-Mazz.和毛叶鲜卑花Sibiraea tomentosa Diels 3种, 其中窄叶鲜卑花S. angustata资源储备丰富, 主要分布于西藏、青海、甘肃、四川等地, 生长于海拔2 400~3 500 m的高山、溪边或林缘[4-5]。藏族民间常用其叶作茶饮, 主治热证、疫病及食后腹胀等原因引起的消化不良症状, 藏药名为“尼阿措”。现代药理学研究表明, 窄叶鲜卑花叶具有调节脂质代谢[6]、促消化[7]、抑制K562肿瘤细胞生长[8]、保护肝损伤[9]、促进免疫功能[10]等作用, 这些作用的发挥与其抗氧化性[11-12]密不可分。近年来, 窄叶鲜卑花的抗氧化活性越来越受到人们的关注, 部分企业已利用其抗氧化活性开发美容产品, 但目前笔者还未见有文献对其发挥抗氧化活性的确切成分进行报道。在前期研究工作中, 笔者采用铁氰化钾与三氯乙酸体系、DPPH·模型评价了窄叶鲜卑花叶的抗氧化性[13], 本实验在此基础上, 采用HPLC-DPPH·-UV/Vis-MS方法对其发挥抗氧化活性的确切成分进行筛选和鉴定, 旨在为窄叶鲜卑花的开发利用提供更多的理论依据。
1 仪器与材料 1.1 仪器Agilent 1260高效液相色谱仪, 包括四元泵, 二极管阵列检测器, 智能化柱温箱, OpenLAB工作站(美国安捷伦公司); SPD-10Avp高效液相色谱仪, 包括SLC-10Avp系统控制器, LC-10ADvp高压泵, SPD-M10Avp检测器, CLASS-VP控制系统(日本岛津公司); Agilent 1290高效液相色谱仪(美国安捷伦公司)-MicrOTOF-Q Ⅲ高分辨质谱仪(瑞士布鲁克公司); DZF-6020型真空干燥箱(上海博迅实业有限公司); AUW120D电子分析天平(日本岛津公司); KQ250B超声波清洗仪(昆山市超声仪器有限公司)。
1.2 材料及试剂10份窄叶鲜卑花叶样品分别采自青海省祁连县、青海省西宁市郊、甘肃省张掖市山丹县、甘肃省张掖市肃南县、甘肃省定西市漳县、甘肃省甘南州当周草原、甘肃省甘南州达宗湖、西藏那曲县、西藏拉萨市郊、西藏夺底沟, 经兰州大学杨永建教授鉴定, 为蔷薇科鲜卑花属植物窄叶鲜卑花Sibiraea angustata(Rehd.)Hand.-Mazz的叶, 每份样品按照标准株(大小、高低适中)规格, 于同年8月在每个产地不同地点采集8~10株, 分别取叶后混合备用。对照品绿原酸(批号110753-200413)、金丝桃苷(批号111521-200303)、柠檬酸(批号111679-200701)、阿魏酸(批号0773-9910)、异槲皮苷(批号140329-200407)均购自中国食品药品检定研究院, 供含量测定用; 对照品新绿原酸(纯度≥98%, 批号12061129)购自成都曼斯特生物科技有限公司; DPPH·(纯度≥96%, 批号1505020)购自阿拉丁试剂有限公司。甲醇、乙腈为色谱纯, 水为超纯水, 其他试剂为分析纯。
2 方法与结果 2.1 方法 2.1.1 HPLC-DPPH·-UV/Vis法在线筛选实验流程HPLC-DPPH·-UV/Vis法在线筛选窄叶鲜卑花叶中抗氧化活性成分的流程图见图 1。样品提取液经HPLC1输液泵输送, 过色谱柱分离后, 进入HPLC1检测器, 此时HPLC1会记录该样品325 nm下的正峰色谱图; DPPH·甲醇溶液由HPLC2输液泵控制流速, 进入三通阀后与来自HPLC1检测器出口的样品液汇合, 两者在一定长度PEEK管中进行反应, 由于抗氧化活性成分会消耗DPPH·的量, 所以与325 nm色谱图对比, 抗氧化活性成分会在517 nm色谱图中出现负峰。
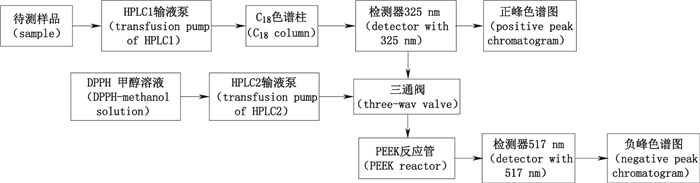
|
图 1 在线筛选实验流程图 Figure 1 The flow chart of on-line screening of free radical scavenging compounds |
HPLC1部分:采用Agilent 1260型高效液相色谱仪, Thermo AcclaimTM 120 C18色谱柱(250 mm×4.6 mm, 5 μm), 流动相为乙腈(A)-0.2%甲酸水溶液(B), 梯度洗脱(0~15 min, 10%A→15%A; 15~30 min, 15%A→16%A; 30~45 min, 16%A→25%A; 45~55 min, 25%A→27%A; 55~65 min, 27% A→60%A), 流速为1.0 mL·min-1; 柱温30 ℃; 检测波长325 nm; 进样量为10 μL。
HPLC2部分:采用SPD-10Avp型高效液相色谱仪, 流动相为30 μg·mL-1的DPPH·甲醇溶液, 流速为0.3 mL·min-1。
PEEK反应管: 11 m, 0.254 mm。
2.1.3 液相色谱-质谱联用仪条件采用Agilent 1290高效液相色谱仪-Bruker Micr OTOF-Q Ⅲ质谱仪, 流动相采用三通阀分流, 流速控制为0.5 mL·min-1, 其他色谱条件均与“2.1.2”中HPLC1部分相同。质谱的离子源为电喷雾离子源(electron-spray ionization, ESI), 采用负离子模式。毛细管电压3 kV, 干燥气温度250 ℃, 干燥气流速8.0 mL·min-1, 碰撞能量40 eV, 扫描范围为m/z 150~1000。
2.1.4 供试液的制备窄叶鲜卑花叶经低温干燥后粉碎, 过60目筛, 取药材0.5 g, 用63.7%乙醇水31 mL浸泡60 min后, 61 ℃超声(250 W, 50 Hz)提取67 min, 抽滤后将滤液置于50 mL量瓶中定容, 用0.45 μm微孔滤膜过滤后备用[13]。该方法参考了笔者前期对窄叶鲜卑花叶中黄酮和多酚提取工艺进行的响应面法优化结果。
2.1.5 混合对照品溶液的制备分别精密称取对照品绿原酸2.32 mg, 金丝桃苷10.6 mg, 用63.7%乙醇水溶解并定容至10 mL量瓶中, 配制成绿原酸质量浓度为0.23 mg·mL-1, 金丝桃苷质量浓度为1.06 mg·mL-1的混合对照品溶液。
2.2 在线筛选条件的优化 2.2.1 样品分离的高效液相色谱条件的考察实验对比了甲醇-水、乙腈-水、乙腈-0.1%磷酸水、乙腈-0.1%甲酸水、乙腈-0.2%甲酸水、乙腈-0.5%甲酸水这几个流动相体系, 并通过改变流动相中有机相和水相的比例和流速来观察分离效果。以乙腈-0.2%甲酸水体系, 流速为1.0 mL·min-1, 采用梯度程序洗脱时, 分离效果最佳。对比波长为280、325、360 nm时的出峰情况, 结果当检测波长为325 nm时, 色谱峰个数最多, 多数峰的面积最大, 基线最好(见图 2), 故选择325 nm作为HPLC1进行样品分离观察的最佳波长。
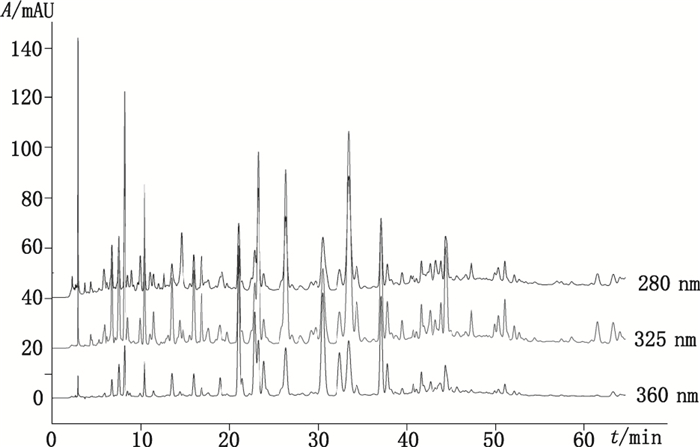
|
图 2 不同波长下窄叶鲜卑花叶样品色谱图 Figure 2 Chromatograms obtained at different wavelengths for Sibiraea angustata leaves extracts |
采用相同的样品分离色谱条件, 见“2.1.2”, 考察不同浓度DPPH·甲醇溶液时的负峰出峰情况。结果表明, 当DPPH·甲醇溶液浓度为30 μg·mL-1时, 出现负峰的个数和峰面积不再明显增加, 所以选择30 μg·mL-1作为最佳的DPPH·甲醇溶液浓度。见图 3。
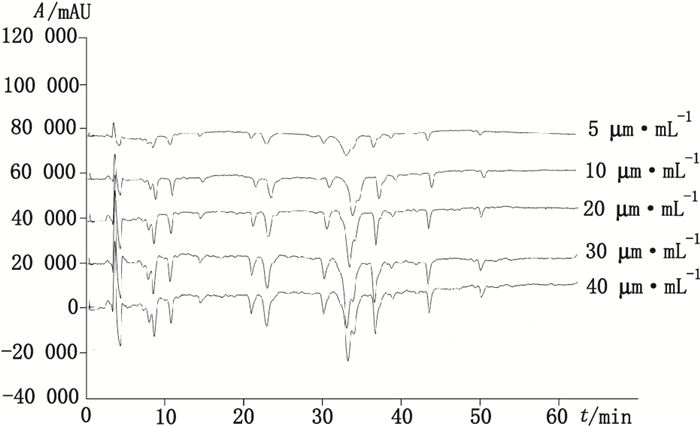
|
图 3 DPPH·甲醇溶液浓度的考察 Figure 3 Chromatograms obtained with different concentrations of DPPH·-methanol solution |
采用相同的样品分离色谱条件, 见“2.1.2”。当DPPH·甲醇溶液浓度为30 μg·mL-1时, 考察不同PEEK反应管长度对结果的影响。结果表明, 当反应管长度为11 m时, 负峰的个数和峰面积不再明显增加, 所以选择11 m作为PEEK反应管(直径0.254 mm)的最佳长度, 见图 4。
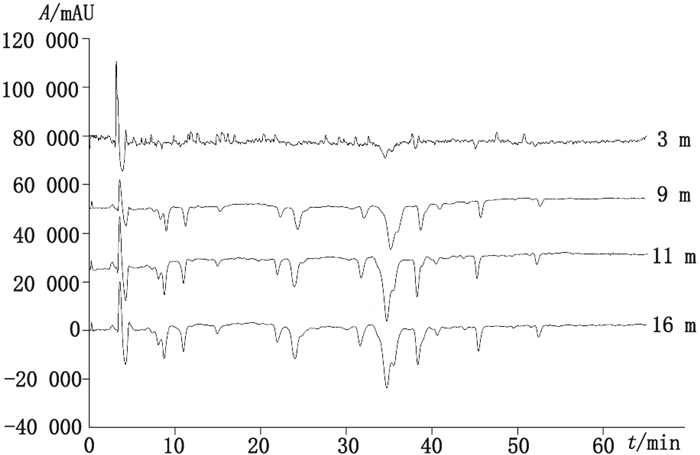
|
图 4 PEEK反应管长度的考察 Figure 4 Chromatograms obtained with different lengths of PEEK reactor |
采用相同的样品分离色谱条件, 见“2.1.2”。当DPPH·甲醇溶液浓度为30 μg·mL-1、PEEK反应管长度为11 m时, 考察不同的DPPH·甲醇溶液流速对实验结果的影响。结果表明, 随着流速的增加, 负峰个数逐渐增多, 峰面积逐渐增大, 当流速为0.3 mL·min-1时, 达到最大值, 继续增加流速未见明显影响。故选择0.3 mL·min-1作为DPPH·甲醇溶液的最佳流速, 见图 5。

|
图 5 DPPH·甲醇溶液流速的考察 Figure 5 Chromatograms obtained with different flow rates of DPPH·-methanol solution |
取绿原酸和金丝桃苷的混合对照品溶液, 按“2.1.2”项下色谱条件进行筛选, 连续进样6次, 测得绿原酸和金丝桃苷对应负峰峰面积的RSD分别为2.1%和1.1%, 表明仪器精密度良好。
2.3.2 重复性试验按照“2.1.4”项下方法, 制备6份窄叶鲜卑花(定西市漳县样品)供试品溶液, 按“2.1.2”项下色谱条件, 以峰面积较大的10个负峰峰面积进行计算, RSD在0.76%~3.6%之间, 表明该筛选方法的重复性良好。
2.3.3 稳定性试验取同一份窄叶鲜卑花(定西市漳县样品)供试品溶液, 按“2.1.2”项下色谱条件, 分别在0、2、4、8、12、24 h进行筛选, 以峰面积较大的10个负峰峰面积进行计算, RSD在0.98%~2.3%之间, 表明供试品溶液及DPPH·反应溶液在24 h内均保持稳定。
2.4 高效液相色谱在线筛选结果如图 6所示, 提取物中14个组分正峰(325 nm)相对应的DPPH·自由基检测谱图(517 nm)可观察到负峰, 该结果明确验证了窄叶鲜卑花叶中含有丰富的可清除DPPH·自由基的抗氧化活性物质。同时, 利用二极管阵列检测器(diode array detector, DAD)检测, 可得到窄叶鲜卑花叶中抗氧化物质的紫外光谱数据, 见表 1。
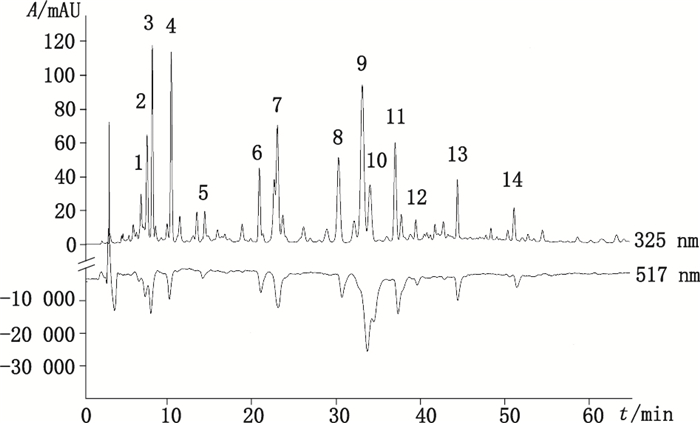
|
图 6 窄叶鲜卑花叶中抗氧化活性成分筛选的HPLC图 Figure 6 HPLC chromatograms of the antioxidant components screening from Sibiraea angustata leaves |
|
|
表 1 窄叶鲜卑花叶中抗氧化活性物质的鉴定 Table 1 HPLC-DAD-ESI-TOF-MS data for the identification of the antioxidant components from Sibiraea angustata leaves |
通过HPLC-ESI-TOF-MS负离子扫描, 获得了窄叶鲜卑花叶提取物中筛选得到的14个抗氧化活性物质的分子离子及碎片离子信息, 见表 1。通过已有对照品对相应色谱峰进行指认, 同时结合本植物相关文献报道[14-16], 最终确定了其中7个化合物的结构。
2.6 不同产地窄叶鲜卑花叶中抗氧化活性成分的对比本实验对10个不同产地的窄叶鲜卑花叶筛选得到的抗氧化活性化合物进行了对比, 见图 7。从图中倒峰个数和峰面积来看, 青海省西宁市郊和祁连县所产窄叶鲜卑花叶提取物中抗氧化活性成分个数最多, 峰面积最大, 提示青海省所产窄叶鲜卑花叶抗氧化活性最好; 其次为甘南州当周草原、甘南州达宗湖、西藏夺底沟、拉萨市郊和定西漳县样品; 甘肃张掖肃南、山丹两县所产窄叶鲜卑花叶抗氧化物筛选结果不理想。说明不同产地, 由于气候、环境、土壤等差异会导致植物体内活性成分不同, 青海省西宁、祁连和甘南州当周草原、达宗湖等地环境更利于窄叶鲜卑花叶中抗氧化物质的积累。化合物1~4、7、8、9、11、13、14这10个抗氧化活性物质为不同产地窄叶鲜卑花叶共有。青海西宁市郊、祁连县和甘南州当周草原和达宗湖4处样品所含化合物1~4、7和14这6个成分明显高于别处。
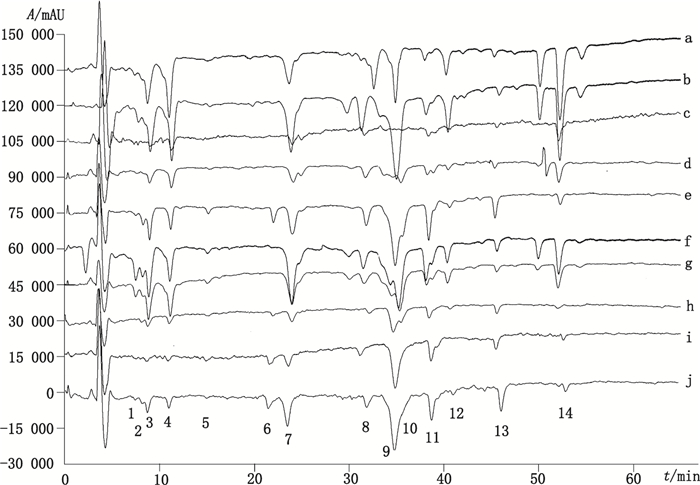
|
a.青海祁连县(Qilian in Qinghai Province) b.青海西宁市郊(Suburb of Xining in Qinghai Province) c.张掖山丹县(Shandan in Zhangye of Gansu Province) d.张掖肃南县(Sunan in Zhangye of Gansu Province) e.定西漳县(Zhangxian in Dingxi of Gansu Province) f.甘南当周草原(Dangzhou steppe in Gannan of Gansu Province) g.甘南达宗湖(Dazong lake in Gannan of Gansu Province) h.西藏那曲(Naqu in Tibet) i.拉萨市郊(Suburb of Lhasa in Tibet) j.西藏夺底沟(Duodigou in Tibet) 图 7 不同产地窄叶鲜卑花叶中抗氧化活性成分筛选图 Figure 7 The screening chromatograms of different Sibiraea angustata samples from different habitats |
本实验在HPLC-DPPH·-UV/Vis技术基础上联用了质谱技术, 实现了窄叶鲜卑花叶中抗氧化物质的高通量筛选及鉴定。通过单因素实验优化了窄叶鲜卑花叶提取物中抗氧化活性成分的在线筛选方法, 结果表明, 当DPPH·甲醇溶液浓度为30 μg·mL-1、流速为0.3 mL·min-1、PEEK反应管(0.254 mm)长度为11 m时, 检测到的抗氧化物质负峰个数最多, 面积最大。最终从窄叶鲜卑花叶提取物中筛选得到14个抗氧化活性物质, 通过HPLC-ESI-TOF-MS负离子扫描得到其结构信息, 最终通过对照品和相关文献指认了其中7个化合物, 分别是柠檬酸、新绿原酸、绿原酸、阿魏酸、金丝桃苷、异槲皮苷和1, 6-山梨醇-O-二咖啡酸酯。通过对10个不同产地窄叶鲜卑花叶样品中抗氧化活性物质进行对比, 确定了10个共有成分, 青海西宁市郊和祁连县样品中含较为丰富的抗氧化成分。本研究为窄叶鲜卑花作为天然抗氧剂的开发利用提供了理论依据。
| [1] |
CUI YL, SHEN N, YUAN X, et al. Two-dimensional chromatography based on on-line HPLC-DPPH bioactivity-guided assay for the preparative isolation of analogue antioxidant compound from Arenaria kansuensis[J]. J Chromatogr B, 2017, 1046(1): 81. |
| [2] |
PEDAN V, FISCHER N, ROHN S, et al. An online NP-HPLC-DPPH method for the determination of the antioxidant activity of condensed polyphenols in cocoa[J]. Food Res Int, 2016, 89(3): 890. |
| [3] |
ZHANG XX, LIN ZT, FANG JG, et al. An on-line high-performance liquid chromatography-diode-array-detector-electrospray ionization-ion-trap-time-of-flight-mass spectrometry total antioxidant capacity detection system applying two antioxidant methods for activity evaluation of the edible flowers from Prunus mume[J]. J Chromatogr A, 2015, 1414(1): 88. |
| [4] |
甘肃省卫生局. 甘肃中草药手册. 第3册[M]. 兰州: 甘肃人民出版社, 1973: 1554 The Gansu Board of Health. Handbook of Chinese Herbal Medicines in Gansu. Vol 3[M]. Lanzhou: Gansu People's Publishing House, 1973: 1554 |
| [5] |
赵汝能. 甘肃中草药资源志[M]. 兰州: 甘肃科学技术出版社, 2004, 31. ZHAO RN. The Gansu Herbal Medicine Resource Records[M]. Lanzhou: Gansu Science and Technology Press, 2004, 31. |
| [6] |
夏苗, 王晶宇, 马晓燕, 等. 藏药柳茶提取物调节肥胖大鼠脂代谢的作用机制研究[J]. 中药材, 2011, 34(6): 922. XIA M, WANG JY, MA XY, et al. Effects and mechanism of Sibiraea angustata on lipid matabolism in high-fatted rats[J]. Chin Med Mat, 2011, 34(6): 922. |
| [7] |
姚莉, 鞠洋. 窄叶鲜卑花促消化作用的实验研究[J]. 中国中西医结合消化杂志, 2009, 17(6): 376. YAO L, JU Y. Effects of Sibiraea angustata on digestive system[J]. Chin J Integr Trad West Med Dig, 2009, 17(6): 376. |
| [8] |
刘昕, 潘兴斌, 李兴玉. 藏药柳茶提取物对K562肿瘤细胞生长的影响[J]. 中国病理生理杂志, 2003, 19(2): 253. LIU X, PAN XB, LI XY. Effect of Liucha extract on tumor K562 cell growth[J]. Chin J Pathophysiol, 2003, 19(2): 253. |
| [9] |
姚莉, 骆勤, 李红卫, 等. 柳茶对D-半乳糖胺肝损伤的保护作用及机制[J]. 中国医院药学杂志, 2010, 30(6): 483. YAO L, LUO Q, LI HW, et al. Protective actions of Liu Tea on D-galactosamine induced acute liver injury in rats and its machanism of action[J]. Chin Hosp Pharm J, 2010, 30(6): 483. |
| [10] |
段博文, 李运, 刘昕, 等. 柳茶多糖对小鼠免疫功能的影响[J]. 中国中药杂志, 2010, 35(11): 1466. DUAN BW, LI Y, LIU X, et al. Effect of polysaccharides in processed Sibiraea on immunologic function of immunosuppression mice[J]. Chin J Chin Mater Med, 2010, 35(11): 1466. |
| [11] |
武燕, 何华, 刘健. 藏药柳茶挥发油的抗氧化及抑菌活性[J]. 中国医院药学杂志, 2012, 32(22): 1819. WU Y, HE H, LIU J. Antimicrobial and antioxidant properties of the essential oil of Sibiraea angustata RCHD[J]. Chin Hosp Pharm J, 2012, 32(22): 1819. |
| [12] |
刘昕, 潘兴斌, 封士兰, 等. 柳茶对小鼠抗氧化能力及免疫器官影响的实验观察[J]. 兰州医学院学报, 1994, 20(3): 143. LIU X, PAN XB, FENG SL, et al. A experimental investigation about Sibiraea angustata influence upon the ability of antioxidation and immune organs in mice[J]. J Lanzhou Univ Med Sci, 1994, 20(3): 143. |
| [13] |
卫阳飞, 刘东花, 张宏曦, 等. 窄叶鲜卑花叶中黄酮和多酚的超声提取工艺及抗氧化性研究[J]. 中药材, 2017, 40(1): 158. WEI YF, LIU DH, ZHANG HX, et al. Ultrasound-assisted extraction technology and antioxidant activity of flavonoids and polyphenols in Sibiraea angustata leaves[J]. J Chin Med Mater, 2017, 40(1): 158. |
| [14] |
陈璐, 陶婷婷, 王天志. RP-HPLC测定藏药柳茶中阿魏酸和异阿魏酸的含量[J]. 华西药学杂志, 2006, 21(2): 196. CHEN L, TAO TT, WANG TZ. Determination of ferulic acid and isoferulic acid in Sibiraea angustata by RP-HPLC[J]. West China J Pharm Sci, 2006, 21(2): 196. |
| [15] |
闫志慧, 陈立书, 朱仝飞, 等. 藏药柳茶叶乙醇水提取物中化学成分的鉴定[J]. 应用化学, 2014, 31(2): 237. YAN ZH, CHEN LS, ZHU TF, et al. Determination of the chemical constituents in aqueous alcohol extract of Sibiraea angustata(Rehd.)Hand-Mazz.leaf[J]. Chin J Appl Chem, 2014, 31(2): 237. |
| [16] |
LI B, CHEN XT, WANG ZW, et al. Two new monoterpenes and one dicaffeic acid ester from Sibiraea angustata with hypolipidemic activities in HepG2 cells in vitro[J]. Phytochem lett, 2015, 13(7): 319. |
 2018, Vol. 38
2018, Vol. 38 