2. 福建承天药业有限公司, 南平 354099
2. Fujian Chengtian Pharmaceutical Co., Ltd., Nanping 354099, China
泽泻是我国栽培历史悠久的传统常用中药材,是水生或沼生草本泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎[1],冬春季茎叶开始枯萎时采挖,洗净,干燥,除去须根及粗皮。中医理论认为,泽泻利水渗湿,泄热通淋;现代药理研究表明,泽泻具有降脂、降糖、降血压、利尿、抗肿瘤、抗炎、抗脂肪肝等作用[2-7]。
目前,《中华人民共和国中医药法》已颁布并实施,中药材和中成药的标准化项目研究也在同步实施开展。建泽泻作为福建省著名道地药材,为国家中药标准化行动计划的入选药材之一,如何更好地对泽泻进行质量控制变得尤其重要。近年来,刘昌孝院士提出了中药质量标志物Q-marker概念,中药Q-marker是药材固有的或加工、制备过程中形成的,且是与中药的功能属性密切相关的化学物质,因其是反映中药安全性、有效性的标志性物质,在研究中需要对其进行质量控制[8]。现代化学研究表明,泽泻三萜类成分是其主要成分,是泽泻降脂、降糖、降血压、利尿等多重药理作用的药效物质基础[9-10],因此,泽泻三萜类成分是泽泻的重要Q-marker。泽泻质量控制研究已有报道,对于多成分鉴定方面:Zhao等[11]采用HPLC-DAD-Q-TOF-MS对泽泻药材进行研究,共鉴定了25个三萜类成分,并分析了福建和四川2个产地泽泻的差异;Li等[12]利用组合质谱的方法,从泽泻中共鉴定80个化合物,并发现14个新三萜,为全面表征泽泻化学组分提供了新的方法;在含量测定方面,许文等[13]建立了HPLC法同时测定泽泻提取物中12个三萜类成分;罗张炎等[14]通过HPLC-ELSD方法测定泽泻药材中4个泽泻醇成分的含量;赵万里等建立HPLC同时测定泽泻11个三萜类成分含量[15],建立UFLC同时测定泽泻药材中6个三萜成分[16],采用一测多评法同时分析了泽泻药材中4个主要成分[17];丘建芳等[18]采用HPLC-DAD-ELSD联用方法,利用DAD测定泽泻中具有紫外吸收的三萜成分含量,利用ELSD测定无紫外、末端吸收的三萜类成分含量,实现了泽泻的多指标同时检测;Xu等[19]采用UHPLC-MS/MS法分析了泽泻提取物口服后大鼠血及组织中的5个三萜类成分,并应用于泽泻药动学及组织分布研究,这些研究对泽泻的三萜类成分的鉴定、检测、质量控制提升发挥了重要的作用。然而,以上研究多集中在三萜类的多成分鉴定或提取物的多成分检测;部分采用HPLC法进行检测分析时间过长(从30 min到80 min不等),且泽泻三萜类多为末端吸收,在紫外208 nm下检测干扰较大,基线存在漂移;而采用ELSD检测灵敏度不够,难以检识低含量的三萜类化合物。
随着现代分析技术的发展,超高效液相色谱串联三重四极杆质谱(UPLC-MS/MS)由于其分离速度快,超高灵敏度,测定专属性强而被广泛运用于中药及复方制剂的分析中[20-21]。本文建立一种UPLC-MS/MS法同时测定不同产地泽泻药材中16个成分,为泽泻药材的质量控制提供新的技术手段。
1 仪器与试药ACQUITY UPLC I-Class超高效液相色谱仪(Waters公司);Xevo TQS三重四极杆质谱仪(Waters公司);CPA225D型十万分之一分析天平(Sartorius公司);KQ-500E台式超声波清洗器(昆山市超声仪器有限公司);DFY-500型中药粉碎机(温岭市林大机械有限公司);乙腈和甲酸为色谱纯(德国Merck公司),Milli-Q超纯水仪(Millipore公司),其余试剂均为分析纯。
对照品16-氧代泽泻醇A、16-氧代-24-乙酰泽泻醇A、泽泻醇C、11-去氧泽泻醇C、泽泻醇L、23-乙酰泽泻醇L、11-去氧泽泻醇B、11-去氧23-乙酰泽泻醇B,购自上海源叶生物科技有限公司,泽泻醇F、23-乙酰泽泻醇C、24-乙酰泽泻醇F、泽泻醇A、24-乙酰泽泻醇A、泽泻醇G、泽泻醇B、均购自成都曼思特生物科技有限公司;23-乙酰泽泻醇B(批号111846-201504)购自中国食品药品检定研究院,以上对照品经面积归一法测定,纯度均大于98%,其化学结构见图 1;内标甘草次酸购自成都曼思特生物科技有限公司;24批泽泻药材分别收购于泽泻主产地福建、江西和四川,其中FJ1~FJ8产自福建,JX1~JX8产自江西,SC1~SC8产自四川;所有批次泽泻药材,依据《中华人民共和国药典》2015年版,经福建中医药大学药用植物学教研室范世明高级实验师和生药教研室林青青鉴定为泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎,样本存放于福建中医药大学标准化项目研究样品室,所有批次泽泻药材粉碎,过80目筛,备用。
|
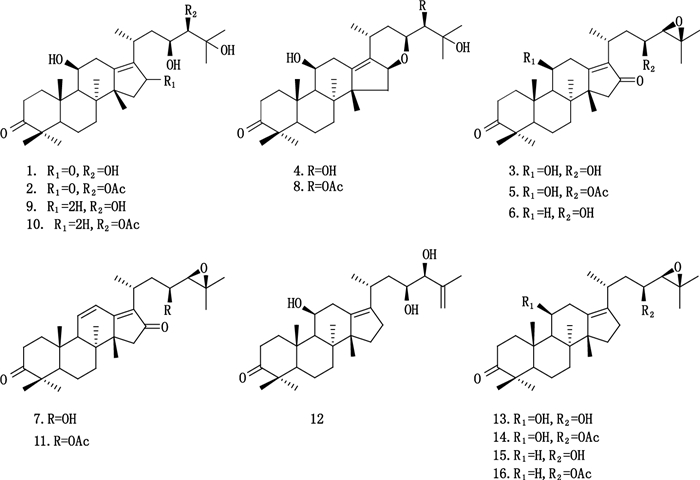
1. 16-氧代泽泻醇A(16-oxo-alisol A) 2. 16-氧代-24-乙酰泽泻醇A(16-oxo-alisol A 24-actetate) 3.泽泻醇C(alisol C) 4.泽泻醇F(alisol F) 5. 23-乙酰泽泻醇C(alisol C 23-acetate) 6. 11-去氧泽泻醇C(11-deoxy-alisol C) 7.泽泻醇L(alisol L) 8.24-乙酰泽泻醇F(alisol F 24-actetate) 9.泽泻醇A(alisol A) 10. 24-乙酰泽泻醇A(alisol A 24-acetate) 11. 23-乙酰泽泻醇L(alisol L 23-acetate) 12.泽泻醇G(alisol G) 13.泽泻醇B(alisol B) 14. 23-乙酰泽泻醇B(alisol B 23-acetate) 15. 11-去氧泽泻醇B(11-deoxy-alisol B) 16. 11-去氧-23-乙酰泽泻醇B(11-deoxy-alisol B 23-acetate) 图 1 泽泻16个成分的化学结构图 Figure 1 The Chemical structures of 16 compounds of Alismatis Rhizoma |
采用Waters Cortecs C18色谱柱(2.1 mm×100 mm,1.6 μm);流动相乙腈(A)-(0.1%甲酸)水(B),梯度洗脱(0~1.0 min,30%A→55%A;1.0~5.0 min,55%A→75%A;5.0~7.0 min,75%A→90%A;7.0~8.5 min,90%A;8.5~8.6 min,90%A→30%A;8.6~10 min,30%A),流速0.25 mL·min-1;柱温40 ℃;进样量2 μL。
2.1.2 质谱条件采用电喷雾正离子模式,毛细管电压3.50 kV,脱溶剂气流:氮气800 L·h-1,脱溶剂温度500 ℃,锥孔气流:氮气150 L·h-1,离子源温度:150 ℃,二级锥孔萃取电压:3.00 V,碰撞气体:氩气。
2.2 溶液的制备 2.2.1 供试品溶液取泽泻粉末0.20 g,精密称定,置25 mL量瓶中,精密加入纯乙腈20 mL,密塞,超声处理(功率250 W,频率50 kHz)30 min,放冷,用纯乙腈定容至25 mL,摇匀,提取液于10 000 r·min-1离心10 min,0.22 μm滤膜滤过,取续滤液,按1: 1(500 μL:500 μL)加入内标溶液,摇匀,即得供试品溶液。
2.2.2 对照品溶液取16-氧代泽泻醇A、16-氧代-24-乙酰泽泻醇A、泽泻醇C、泽泻醇F、23-乙酰泽泻醇C、11-去氧泽泻醇C、泽泻醇L、24-乙酰泽泻醇F、泽泻醇A、24-乙酰泽泻醇A、23-乙酰泽泻醇L、泽泻醇G、泽泻醇B、23-乙酰泽泻醇B、11-去氧泽泻醇B和11-去氧-23-乙酰泽泻醇B的对照品适量,精密称定,加入乙腈制成质量浓度分别为1.088、0.776、1.063、1.016、0.980、0.612、1.008、0.765、0.920、0.336、1.041、0.960、1.001、1.022、0.258、0.828 mg·mL-1的单一对照品储备液;分别精密量取上述对照品储备液适量,置同一容量瓶中,加入50%乙腈水至刻度,即得16个化合物质量浓度分别为54.42、38.81、53.15、50.80、49.02、30.62、50.43、38.25、46.06、16.81、52.05、48.04、50.05、51.10、12.91、41.43 μg·mL-1的混合对照品储备液,其他不同质量浓度的对照品混合溶液由混合对照品储备液逐级稀释,即得。
2.2.3 内标溶液内标采用同样三萜结构的甘草次酸,取其对照品适量,精密称定,加入乙腈制备成质量浓度为400 ng·mL-1的内标溶液。
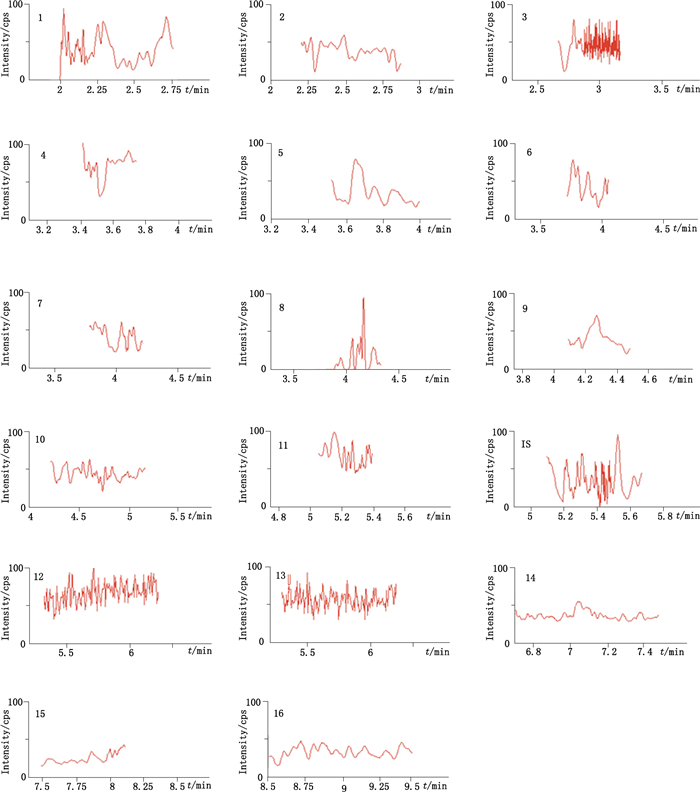
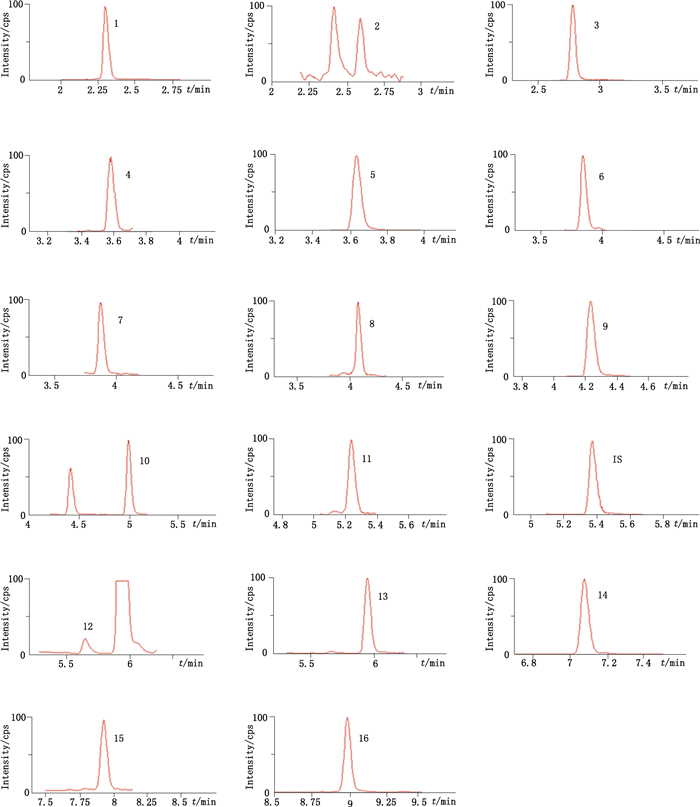
2.3 UPLC-MS/MS定量方法学考察 2.3.1 质谱测定方法采用正离子多反应监测(MRM)定量模式,16个分析物的代表性成分的二级质谱图见图 2,它们及内标的质谱分析条件参数见表 1。泽泻药材样品和混合对照品在“2.1”项色谱和质谱条件下分析得到UPLC-MS/MS的MRM色谱图,16个成分及内标均分离良好,符合定量分析要求,见图 3~5。
|
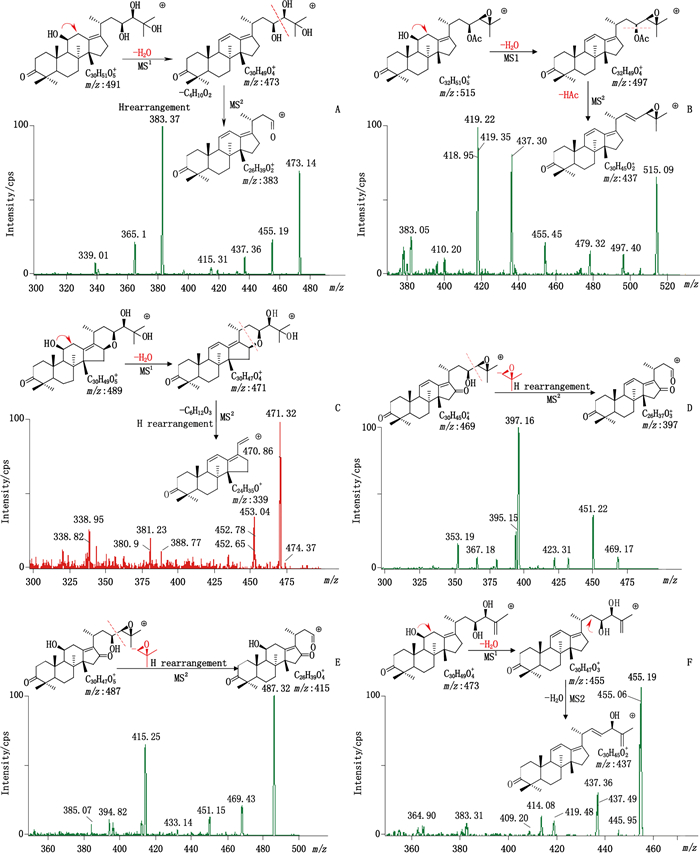
A.泽泻醇A(alisol A) B.23-乙酰泽泻醇B(alisol B 23-acetate) C.泽泻醇F(alisol F) D.泽泻醇L(alisol L) E.泽泻醇C(alisol C) F.泽泻醇G(alisol G) 图 2 代表性化合物质谱裂解过程 Figure 2 Representative decomposition process of composite material spectrum |
|
|
表 1 16个分析物及内标(IS)的质谱测定条件 Table 1 MS parameters for 16 compounds and internal standards |
|
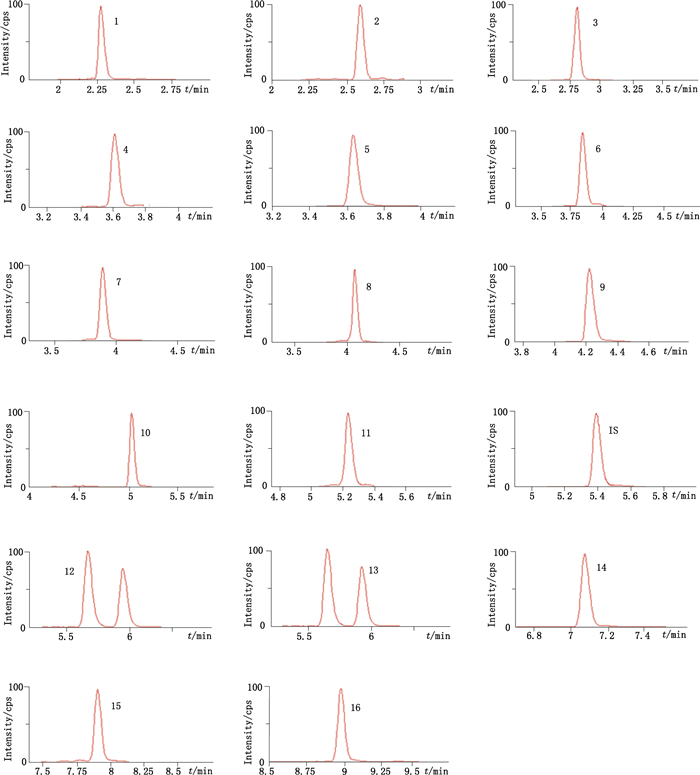
1~16.同图 1(same as Fig. 1) 图 4 对照品UPLC-MS/MS色谱图 Figure 4 UPLS-MS/MS chromatogrcams of reference substances |
|
1~16.同图 1(same as Fig. 1) 图 5 泽泻样品(C)的UPLC-MS/MS色谱图 Figure 5 UPLC-MS/MS chromatograms of Alismatis Rhizoma sample |
取“2.2.2”项下各对照品储备液适量,用色谱乙腈稀释配制系列梯度浓度的对照品混合溶液,测定前按1: 1(500μL: 500μL)加入内标。在“2.1”项条件下测定峰面积,以峰面积与内标峰面积的比值(Y)对分析物浓度(X)作线性回归,绘制标准曲线,得到回归方程和相关系数,并以信噪比(S/N)=10为定量下限,结果见表 2。
|
|
表 2 泽泻药材中16个分析物的回归方程、线性范围、检测下限、定量下限 Table 2 Regression equations, linear range, LOQ and LOD of 16 detected compounds |
取同一份对照品的混合溶液,按“2.2.1”项下方法制备供试品溶液,在“2.1”项条件下进行峰面积测定,1 d内连续进样6次测定日内精密度,连续测定3 d,每天进样3针测定日间精密度,分别计算各对照品与内标物的峰面积比值及比值的RSD,其日内精密度和日间精密度结果见表 3,表明仪器精密度良好。
|
|
表 3 泽泻中16个分析物的精密度、稳定性、重复性实验 Table 3 Precision, stability, repeatability of 16 detected compounds |
按“2.2.1”项下方法制备供试品溶液,分别于0、2、6、10、12和24 h按“2.1”项下条件进样测定,根据标准曲线计算各成分的浓度及其RSD,结果见表 3,表明供试品溶液在24 h内基本稳定。
2.3.5 重复性试验精密称取同一批泽泻药材样品(批号:SC1)6份,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下条件测定,根据标准曲线计算16个分析物的含量及其RSD,结果见表 3,表明方法重复性良好。
2.3.6 回收率试验精密称取“2.3.5”项下已知含量的泽泻药材粉末6份,约0.10 g,分别精密加入16个对照品的混合溶液,按“2.2.1”项下方法制备供试溶液,按“2.1”项下色谱和质谱条件进行峰面积测定,根据标准曲线计算成分含量,计算回收率,结果见表 4。
|
|
表 4 泽泻中16个分析物的回收率试验结果(n=6) Table 4 Recoveries of 16 detected compounds of Alismatis Rhizoma |
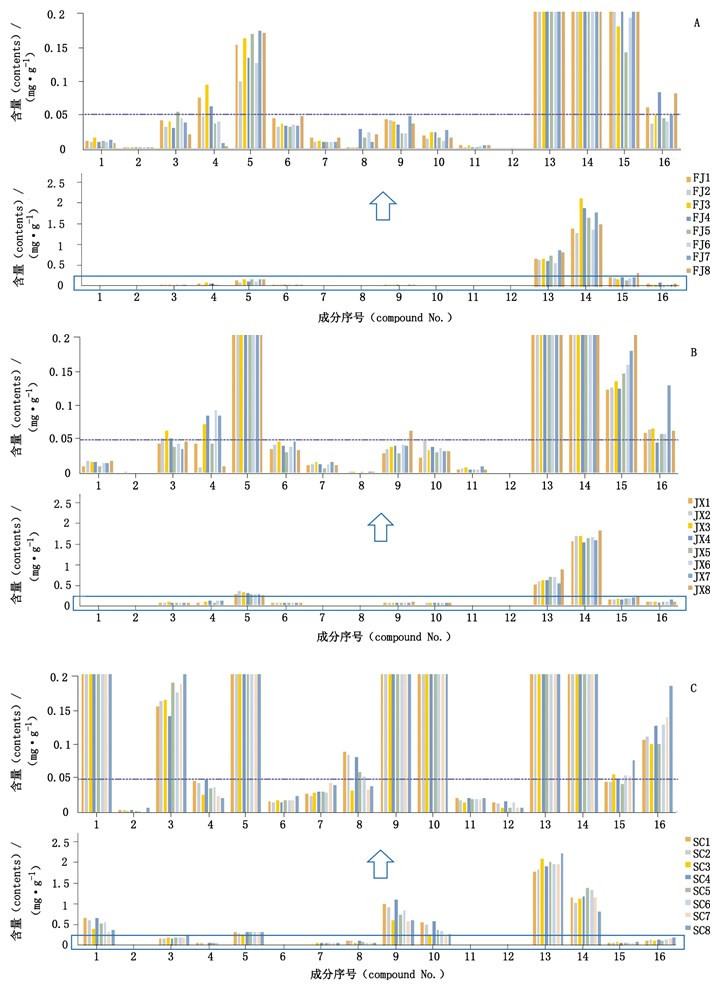
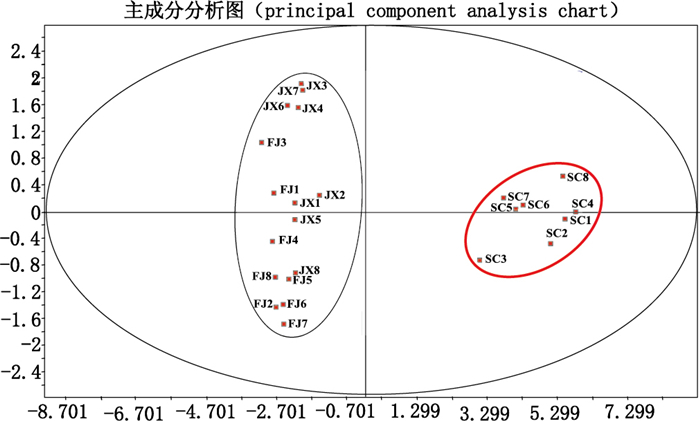
分别精密称取不同批次的泽泻样品粉末,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下条件测定峰面积,根据标准曲线计算其含量,结果见表 5和图 6。并对24批次样品16个成分的含量进行主成分分析,见图 7。
|
|
表 5 泽泻药材样品中待测成分的含量(mg·g-1,n=3) Table 5 Contents of compounds to be measured in Alismatis Rhizoma |
|
1~16.同图 1(same as Fig. 1) 图 6 福建(A)、江西(B)和四川(C)产泽泻含量结果柱形图 Figure 6 Content column charts of Alismatis Rhizoma in Fujian(A), Jiangxi(B)and Sichuan(C) |
|
图 7 泽泻中16个成分含量的PCA分析 Figure 7 PCA analysis of 16 components in Alismatis Rhizoma |
比较回流提取和超声提取,针对测定的16个成分,2种方法结果显示无明显差异,故确定采用超声提取。另外,比较了乙腈和甲醇提取及其不同提取倍量的效果,结果表明纯乙腈作为提取溶剂,提取倍量为100倍时提取效果最佳。在此基础上,考察了超声提取的次数,溶剂用量及提取时间对实验结果的影响,结果表明纯乙腈超声提取1次、125倍量、提取30 min即可。
3.2 色谱条件的选择考察了不同粒径超高效液相色谱柱ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)、Waters HSS T3 C18(2.1 mm×100 mm,1.8 μm)、Waters Cortecs C18(2.1 mm×100 mm,1.6 μm)对泽泻药材16个成分的分离效果,结果表明1.6 μm UPLC色谱柱的分离度和灵敏度均高于其他超高效液相色谱柱,故选择Waters Cortecs C18色谱柱(2.1 mm×100 mm,1.6 μm)。先后考察了4种流动相系统(乙腈-0.1%甲酸水、乙腈-水、甲醇-0.1%甲酸水、甲醇-水),结果乙腈-0.1%甲酸水最佳,仅仅10 min即实现了泽泻中16个成分的分离定量,单针样品溶剂消耗量低于3 mL,明显优于高效液相色谱法。
3.3 质谱条件的选择本实验采用MRM模式,通过Mass Tune对16个待测成分质谱参数进行优化,质谱条件考察了正、负离子模式对检测的响应情况,结果发现三萜类成分正离子模式优于负离子模式,最终选择正离子监测模式,并对每个化合物的MRM条件进行优化,优选最佳的定量离子对。23-乙酰泽泻醇L和11-去氧-23-乙酰泽泻醇B最佳灵敏度母离子是[M+H]+,子离子均是母离子峰失去乙酸基团(60)的[M+H-HAc]+峰;23-乙酰泽泻醇C最佳灵敏度子离子是母离子是[M+H]+连续失去乙酸基团和一分子水的[M+H-HAc-H2O]+峰;泽泻醇C、11-去氧泽泻醇C和泽泻醇L最佳定量子离子均为母离子[M+H]+峰通过氢重排解离C4H8O产生定量子离子[M+H-C4H8O]+峰;16-氧代泽泻醇A最佳定量子离子是其母离子[M+H]+峰失去C4H10O2产生的m/z 415.3 [M+H-C4H10O2]+;泽泻醇A、泽泻醇F、23-乙酰泽泻醇B、16-氧代-24-乙酰泽泻醇A、24-乙酰泽泻醇F、泽泻醇G和泽泻醇B与上述化合物不同,母离子均为[M+H-H2O]+,泽泻醇A最佳定量子离子为母离子失去C4H10O2的子离子峰m/z 383.3 [M+H-H2O-C4H10O2]+,泽泻醇F最佳子离子是失去C4H10O2得到m/z 381.3 [M+H-H2O-C4H10O2]+进一步裂解失去C2H2O产生的m/z 339.3 [M+H-H2O-C4H10O2-C2H2O]+,23-乙酰泽泻醇B二级最佳子离子是母离子m/z 497.3 [M+H-H2O]+裂解失去乙酸基产生最佳子离子[M+H-H2O-HAc]+,16-氧代-24-乙酰泽泻醇A二级最佳定量子离子的裂解方式为m/z 415.3 [M+H-C6H12O3]+,24-乙酰泽泻醇F是母离子裂解失去C6H12O3和C2H2O产生的m/z 339.3 [M+H-H2O-C6H12O3-C2H2O]+;泽泻醇G和泽泻醇B二级最佳定量子离子均为m/z 437.3 [M+H-2H2O]+;24-乙酰泽泻醇A最佳定量母离子是[M+H-2H2O]+,其失去C6H13O3产生最佳定量子离子[M+H-C6H13O3-2H2O]+峰。11-去氧泽泻醇B一级产生[M+H-C4H8O]+峰,裂解失去一分子H2O产生最佳定量子离子[M+H-C4H8O-H2O]+峰。
3.4 泽泻药材含量分析分析24批次泽泻药材三萜类成分含量测定结果。首先,福建产泽泻16个成分中含量最高的是23-乙酰泽泻醇B,含量达到1.2~2.1 mg·g-1;其次是泽泻醇B,含量达到0.5~0.8 mg·g-1;此外,23-乙酰泽泻醇C含量较高,达到0.1~0.17 mg·g-1,而泽泻醇G、16-氧代泽泻醇A、泽泻醇L、23-乙酰泽泻醇L和24-乙酰泽泻醇A含量较低,均低于0.05 mg·g-1,其中泽泻醇G含量最低甚至未检测。其次,江西产泽泻的含量结果与福建的相似,从生源地理上认为,江西为建泽泻引种,两者生源较近[22],都是“建泽泻”,因此两者化学成分比较接近。第三,四川产泽泻与上述两者不同,含量最高的是泽泻醇B,达1.8~2.3 mg·g-1,23-乙酰泽泻醇B的含量位居其次,16-氧代泽泻醇A、泽泻醇C、23-乙酰泽泻醇C、泽泻醇A、24-乙酰泽泻醇A和11-去氧-23-乙酰泽泻醇B成分含量较高,均到达0.1 mg·g-1以上,其中16-氧代泽泻醇A、泽泻醇A和24-乙酰泽泻醇A含量明显高于福建和江西产泽泻,该结果与Zhao等[11]研究结果一致。另外,16-羰基-24-乙酰泽泻醇A(2号峰)和24-乙酰泽泻醇A(10号峰)前面的峰(见图 5)分别是其同分异构体16-羰基-23-乙酰泽泻醇A和23-乙酰泽泻醇A,两者不稳定,容易转化成其24位乙酰化的异构体。从主成分分析来看,3种泽泻PCA聚类分为两类,与含量结果分析一致,四川产泽泻明显区别于福建、江西产泽泻,而建泽泻和江西泽泻则较接近,PCA无法区分。计算24批次泽泻的主成分贡献,进一步分析聚类方程,对泽泻质量起到主成分贡献最大作用的为23-乙酰泽泻醇B、泽泻醇B,而且现代药理研究表明,23-乙酰泽泻醇B具有降血脂[9]、促进葡萄糖摄取[3]、激活PPARs受体[23]、利尿[5]等作用;泽泻醇B具有抗炎[7]、抗草酸钙结晶[24]、抗骨质疏松[10]、利尿[5]等作用。因此,初步认为23-乙酰泽泻醇B和泽泻醇B应该作为泽泻重点质控的Q-maker成分。
本实验建立超高效液相色谱串联质谱法,测定24批泽泻药材中16个主要成分,为泽泻药材成分全面质量评价和泽泻产地品质研究提供了一种快速、高效的分析方法,为综合评价泽泻药材质量提供参考。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 229 ChP 2015. Vol Ⅰ[S]. 2015: 229 |
| [2] |
MIAO H, ZHANG L, CHEN DQ, et al. Urinary biomarker and treatment mechanism of Rhizoma Alismatis on hyperlipidemia[J]. Biomed Chromatogr, 2017, 31(4): 3829. DOI:10.1002/bmc.3829 |
| [3] |
许文, 罗奋熔, 赵万里, 等. 泽泻降糖活性提取物化学成分研究[J]. 中草药, 2014, 45(22): 3238. XU W, LUO FR, ZHAO WL, et al. Chemical constituents from Alisma orientalis extracts with hypoglycemic effect[J]. Chin Tradit Herb Drugs, 2014, 45(22): 3238. DOI:10.7501/j.issn.0253-2670.2014.22.005 |
| [4] |
CHU Y, JIANG H, JU J, et al. A metabolomic study using HPLC-TOF/MS coupled with ingenuity pathway analysis:Intervention effects of Rhizoma Alismatis on spontaneous hypertensive rats[J]. J Pharm Biomed Anal, 2016, 117: 446. DOI:10.1016/j.jpba.2015.09.026 |
| [5] |
ZHANG X, LI XY, LIN N, et al. Diuretic activity of compatible triterpene components of Alismatis Rhizoma[J]. Molecules, 2017, 22(9): 1459. DOI:10.3390/molecules22091459 |
| [6] |
XU W, LI T, QIU JF, et al. Anti-proliferative activities of terpenoids isolated from alisma orientalis and their structure-activity relationships[J]. Anti-Cancer Agents Med Chem, 2015, 15(2): 228. DOI:10.2174/1871520614666140601213514 |
| [7] |
ZENG L, TANG W, YIN J, et al. Alisol A 24-acetate prevents hepatic steatosis and metabolic disorders in HepG2 cells[J]. Cell Physiol Biochem, 2016, 40(3-4): 453. DOI:10.1159/000452560 |
| [8] |
刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker):中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443. LIU CX, CHEN SL, XIAO XH, et al. A new concept on quality marker of Chinese materia medica:quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs, 2016, 47(9): 1443. DOI:10.7501/j.issn.0253-2670.2016.09.001 |
| [9] |
ZHANG, L L, XU W, XU YL, et al. Therapeutic potential of rhizoma alismatis:a review on ethnomedicinal application, phytochemistry, pharmacology, and toxicology[J]. Ann NY Acad Sci, 2017, 1401(1): 90. DOI:10.1111/nyas.2017.1401.issue-1 |
| [10] |
TIAN T, CHEN H, ZHAO YY, et al. Traditional uses, phytochemistry, pharmacology, toxicology and quality control of Alisma orientale(Sam.)Juzep:a review[J]. J Ethnopharmacol, 2014, 158: 373. DOI:10.1016/j.jep.2014.10.061 |
| [11] |
ZHAO WL, HUANG XQ, LI XY, et al. Qualitative and quantitative analysis of major triterpenoids in Alismatis Rhizoma by high performance liquid chromatography/diode-array detector/quadrupole-time-of-flight mass spectrometry and ultra-performance liquid chromatography/triple quadrupole mass[J]. Molecules, 2015, 20(8): 13958. DOI:10.3390/molecules200813958 |
| [12] |
LI S, JIN S, SONG C, et al. The strategy for establishment of the multiple reaction monitoring based characteristic chemical profile of triterpenes in Alismatis Rhizoma using two combined tandem mass spectrometers[J]. J Chromatogr A, 2017, 1524: 121. DOI:10.1016/j.chroma.2017.09.057 |
| [13] |
许文, 徐明涛, 赵万里, 等. 泽泻提取物三萜类成分含量测定研究[J]. 药物分析杂志, 2015, 35(2): 210. XU W, XU MT, ZHAO WL, et al. Determination of triterpenoids in Rhizoma Alismatis extracts[J]. Chin J Pharm Anal, 2015, 35(2): 210. |
| [14] |
罗张炎, 周爱存, 张朝凤, 等. HPLC同时测定泽泻中4种泽泻醇成分的含量[J]. 中国中药杂志, 2010, 35(24): 3306. LUO ZY, ZHOU AC, ZHANG CF, et al. Simultaneous determination of four alisols in Rhizoma Alismatis by RP-HPLC[J]. China J Chin Mater Med, 2010, 35(24): 3306. |
| [15] |
赵万里, 黄小强, 许文, 等. RP-HPLC-DAD同时测定泽泻中11个三萜类成分[J]. 中草药, 2016, 47(16): 2933. ZHAO WL, HUANG XQ, XU W, et al. Simultaneous determination of 11 triterpenoids in Alismatis Rhizoma by RP-HPLC-DAD[J]. Chin Tradit Herb Drugs, 2016, 47(16): 2933. DOI:10.7501/j.issn.0253-2670.2016.16.027 |
| [16] |
赵万里, 许文, 丘建芳, 等. UFLC同时测定泽泻中6种三萜类成分含量[J]. 中国实验方剂学杂志, 2015, 21(1): 64. ZHAO WL, XU W, QIU JF, et al. Simultaneous determination of six triterpenoids in Alismatis Rhizoma by UFLC[J]. Chin J Exp Tradit Med Form, 2015, 21(1): 64. |
| [17] |
赵万里, 张方方, 黄小强, 等. 一测多评法测定泽泻中4种三萜类成分的含量[J]. 中国药学杂志, 2015, 50(15): 1347. ZHAO WL, ZHANG FF, HUANG XQ, et al. Simultaneous quantitative analysis of four triterpenoids in Alismatis Rhizoma by quantitative analysis of multi-components by single marker[J]. Chin Pharm J, 2015, 50(15): 1347. |
| [18] |
丘建芳, 林婧, 许文, 等. HPLC-DAD-ELSD测定泽泻药材中4种三萜类成分含量[J]. 中国实验方剂学杂志, 2014, 20(2): 42. QIU JF, LIN J, XU W, et al. HPLC-DAD-ELSD simultaneous determination of four triterpenoids in Rhizoma Alismatis[J]. Chin J Exp Tradit Med Form, 2014, 20(2): 42. |
| [19] |
XU W, LI X, LIN N, et al. Pharmacokinetics and tissue distribution of five major triterpenoids after oral administration of Rhizoma Alismatis extract to rats using ultra high-performance liquid chromatography-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2017, 146: 314. DOI:10.1016/j.jpba.2017.09.009 |
| [20] |
黄秋妹, 许舒瑜, 邰艳妮, 等. UPLC-MS/MS同时测定金牡感冒片中15个成分[J]. 药物分析杂志, 2017, 37(8): 1453. HUANG QM, XU SY, TAI YN, et al. Simultaneous determination of fifteen components in Jinmu Ganmao tablets by UPLC-MS/MS[J]. Chin J Pharm Anal, 2017, 37(8): 1453. |
| [21] |
刘杰, 许文, 李煌, 等. UPLC-MS/MS法同时测定白芍饮片中10种成分[J]. 药物分析杂志, 2015, 35(4): 635. LIU J, XU W, LI H, et al. Simultaneous determination of ten components in Radix Paeoniae Alba pieces by UPLC-MS/MS[J]. Chin J Pharm Anal, 2015, 35(4): 635. |
| [22] |
陈菁瑛, 苏海兰, 黄玉吉, 等. 泽泻不同种质资源特性比较研究[J]. 中国中药杂志, 2009, 34(21): 2713. CHEN JY, SU HL, HUANG YJ, et al. Comparative studies on genetic resource of characteristics of Alisma[J]. China J Chin Mater Med, 2009, 34(21): 2713. DOI:10.3321/j.issn:1001-5302.2009.21.005 |
| [23] |
李小艳, 王小花, 黄小强, 等. PPARs激动剂体外筛选模型的建立及其在泽泻活性成分筛选中的应用[J]. 中国中药杂志, 2016, 41(21): 4015. LI XY, WANG XH, HUANG XQ, et al. Development of a cell-based peroxisome proliferator-activated receptors(PPARs)screening model and its application for evaluation of triterpenoids isolate from Alismatis Rhizoma[J]. China J Chin Mater Med, 2016, 41(21): 4015. |
| [24] |
黄锦芳, 李小艳, 黄小强, 等. 基于均匀设计的泽泻体外抗草酸钙结晶的有效组分配伍研究[J]. 中草药, 2016, 47(23): 4160. HUANG JF, LI XY, HUANG XQ, et al. Research on effective components compatibility of Alismatis Rhizoma resisting calcium oxalate calculus in vitro based on uniform design[J]. Chin Tradit Herb Drugs, 2016, 47(23): 4160. |
 2018, Vol. 38
2018, Vol. 38