2. 北京以岭药业有限公司, 北京 102600;
3. 石家庄以岭药业股份有限公司, 石家庄 050035
2. Beijing Yiling Pharmaceutical Co., Ltd, Beijing 102600, China;
3. Shijiazhuang Yiling Pharmaceutical Co., Ltd., Shijiazhuang, 050035, China
广藿香(Pogostemonis Herba)为唇形科植物广藿香Pogostemon cablin(Blanco)Benth.的干燥地上部分,具有芳香化浊,和中止呕,发表解暑的功效,用于湿浊中阻,脘痞呕吐,暑湿表证,湿温初起,发热倦怠,胸闷不舒,寒湿闭暑,腹痛吐泻,鼻渊头痛[1-2]。广藿香原产东南亚等国,我国的广藿香主要由越南、马来西亚等国家引种,均为栽培,现主要分布于广东、海南等地,是我国十大南药之一。广藿香传统商品药材按产地分为石牌广藿香、高要广藿香、海南广藿香(包括湛江产),但目前市场上流通的主流商品产地主要是广东湛江以及海南万宁地区[3-5]。《中华人民共和国药典》2015年版以百秋李醇的含量对广藿香进行质量控制[1],该方法只针对广藿香的挥发性成分,不能对广藿香药材进行全面有效的质量控制。广藿香中化学成分有多种,主要有黄酮类、苯乙醇苷、萜类和甾体等[6-8]。本课题组通过对广藿香的水提部位进行化学成分研究,分离得到含量较高的毛蕊花糖苷、异毛蕊花糖苷、列当苷以及新西兰牡荆苷2,另外通过液质联用指认出广藿香中含有藿香黄酮醇和广藿香酮,其中毛蕊花糖苷、异毛蕊花糖苷、列当苷属于苯乙醇苷类,新西兰牡荆苷2和藿香黄酮醇属于黄酮类。研究表明,广藿香酮和广藿香中黄酮类具有抗菌活性[9-11],苯乙醇苷类化合物具有抗菌、抗病毒、抗氧化、抗肿瘤、神经保护、免疫调节、增强记忆等作用[6, 12]。为了提高广藿香药材质量控制水平,建立更加科学、合理的质量标准,本试验采用UPLC对广藿香药材中6个成分进行含量测定,为提高广藿香药材乃至其相关制剂的质量控制方法提供实验依据。
1 实验部分 1.1 仪器与试剂Waters Acquity UPLC(Ultra-performance liquid chromatography)H-Class超高效液相色谱系统,配有四元超高压溶剂系统、自动进样恒温样本管理器、柱温箱、PDA检测器和Empower 3色谱工作站;色谱柱为Waters Acquity UPLC BEH C18(1.7 μm,2.1 mm×100 mm);KQ250DB型超声波清洗器(昆山市超声仪器有限公司),AL204型和AB135-S型电子分析天平(瑞士Mettler-Toledo International Inc.),Milli-Q超纯水机(美国Millipore公司)。
1.2 试药与药材对照品毛蕊花糖苷(批号111530-201411,含量以94.4%计算,购于中国食品药品检定研究院)、异毛蕊花糖苷(批号PN1115SB13,含量大于98%,购于上海源叶生物科技有限公司)、藿香黄酮醇(批号X22S7L21715,含量大于98%,购于上海源叶生物科技有限公司)、广藿香酮(批号111822-201102,购于中国食品药品检定研究院),新西兰牡荆苷2和列当苷为自制(HPLC面积归一化法检测纯度 > 98%),乙腈(色谱纯),其他试剂均为分析纯。广藿香药材采于广东省湛江市雷州市英利镇,经石家庄以岭药业股份有限公司药材资源部田清存主任中药师鉴定为广藿香Pogostemon cablin(Blanco)Benth.的干燥地上部分。
2 方法与结果 2.1 溶液的制备 2.1.1 混合对照品溶液精密称取毛蕊花糖苷、异毛蕊花糖苷、藿香黄酮醇、广藿香酮、新西兰牡荆苷2和列当苷的对照品各10 mg,分别置10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得质量浓度约为1 mg·mL-1单一对照品溶液。精密吸取上述溶液适量,配制成系列浓度的混合对照品溶液。
2.1.2 供试品溶液取广藿香药材粉碎,过二号筛,取药材粉末1 g,精密称定,置于50 mL具塞锥形瓶中,加入75%甲醇25 mL,密塞,称量,超声处理(功率250 W,频率40 kHz)45 min,取出,放冷,再称量,用75%甲醇补足减失的量,摇匀,取上清液,滤过,取续滤液,过0.22 μm滤膜,即得。
2.2 色谱条件色谱柱:Waters Acquity UPLC BEH C18(1.7 μm,2.1 mm×100 mm);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~10 min,8%A→14.5%A;10~20 min,14.5%A;20~20.1 min,14.5%A→40%A;20.1~32 min,40%A;32~40 min,40%A→52%A),流速:0.4 mL·min-1;柱温:30 ℃;检测波长:309 nm;进样体积:2 μL;运行时间:40 min。上述色谱条件的色谱图见图 1。
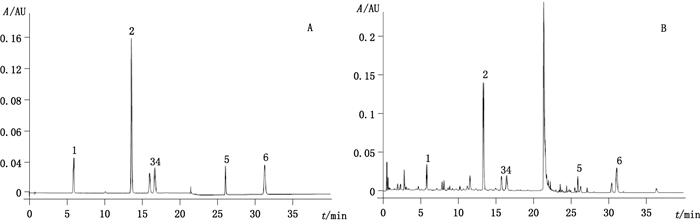
|
1.新西兰牡荆苷2(vicenin-2) 2.毛蕊花糖苷(verbascoside) 3.异毛蕊花糖苷(isoverbascoside) 4.列当苷(crenatoside) 5.藿香黄酮醇(pachypodol) 6.广藿香酮(pogostone) 图 1 混合对照品(A)和广藿香样品(B)色谱图 Figure 1 UPLC chromatograms of mixed reference substances(A)and Pogostemonis Herba(B) |
按上述色谱条件,精密吸取6个不同浓度(新西兰牡荆苷2的质量浓度分别为2.18、10.90、21.80、43.60、54.50和109.00 μg·mL-1,毛蕊花糖苷的质量浓度分别为8.66、43.31、86.62、173.24、216.54和433.11 μg·mL-1,异毛蕊花糖苷的质量浓度分别为2.12、10.60、21.20、42.40、53.00和106.00 μg·mL-1,列当苷的质量浓度分别为1.81、9.04、18.08、36.16、45.20和90.40 μg·mL-1,藿香黄酮醇的质量浓度分别为0.90、4.50、9.00、18.00、22.50和45.00 μg·mL-1,广藿香酮的质量浓度分别为1.09、5.42、10.85、21.70、27.12和54.24 μg·mL-1)的混合对照品溶液各2 μL,注入UPLC仪,检测峰面积,以进样浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,进行线性回归,结果见表 1。
|
|
表 1 广藿香中6个成分的标准曲线和线性范围 Table 1 Standard curve and linear range of six components in Pogostemonis Herba |
取“2.1.1”项下对照品溶液,按“2.2”项下色谱条件测定,连续进样6次,测定峰面积,结果新西兰牡荆苷2、毛蕊花糖苷、异毛蕊花糖苷、列当苷、藿香黄酮醇、广藿香酮峰面积的RSD分别为1.6%、1.5%、1.7%、1.5%、1.2%、0.10%,表明仪器的精密度良好。
2.5 稳定性试验取同一供试品溶液,按照“2.2”项下色谱条件分别于制备后0、2、4、6、8、12、24 h进UPLC分析,测定新西兰牡荆苷2、毛蕊花糖苷、异毛蕊花糖苷、列当苷、藿香黄酮醇、广藿香酮的峰面积,结果RSD分别为2.7%、2.0%、2.9%、1.6%、1.5%、1.4%,表明供试品溶液在24 h内稳定。
2.6 重复性试验取同一批样品粗粉6份,每份1 g,精密称定,按“2.1.2”项下方法制备6份供试品溶液,按“2.2”项下条件进行分析,结果样品中新西兰牡荆苷2、毛蕊花糖苷、异毛蕊花糖苷、列当苷、藿香黄酮醇、广藿香酮含量的平均值分别为0.825、3.818、1.026、0.823、0.343、0.627 mg·g-1,RSD分别为2.5%、1.5%、1.6%、1.6%、1.3%、1.3%,表明该方法的重复性良好。
2.7 回收率试验取已知含量的样品粗粉9份,每份0.5 g,精密称定,按低、中、高浓度(0.8倍、1倍、1.2倍)分别加入一定量新西兰牡荆苷2、毛蕊花糖苷、异毛蕊花糖苷、列当苷、藿香黄酮醇、广藿香酮对照品,按“2.1.2”项下方法制备9份供试品溶液,按“2.2”项下条件进行分析,结果(表 2)表明回收率试验符合要求。
|
|
表 2 广藿香中6个成分的加样回收率(n=9) Table 2 Results of recovery test of 6 components in Pogostemonis Herba |
按“2.1.2”项下方法操作,采用“2.2”项下条件对10批药材进行含量测定,结果见表 3。
|
|
表 3 10批广藿香药材中6个不同成分的含量(mg·g-1) Table 3 Contents of six components in ten batches of Pogostemonis Herba |
本试验比较了乙腈-0.1%磷酸溶液、甲醇-0.1%磷酸溶液2种流动相,通过调整流动相比例,并比较不同流速(0.3、0.4和0.5 mL·min-1)和不同柱温(25、30和35 ℃)下各待测成分的分离度,最后确定以乙腈-0.1%磷酸溶液作为流动相进行梯度洗脱,流速为0.4 mL·min-1,柱温为30 ℃时,可以达到满意的分离效果。采用二极管阵列检测器,在210~400 nm波长下对供试品溶液中的待测成分和混合对照品溶液进行了全波长扫描,结果6个待测成分在309 nm处均有较大吸收峰,因此最终选择309 nm作为检测波长,在此波长获得的图谱杂质峰干扰少,各目标峰峰形较好。
3.2 提取方法的选择本试验比较了不同的提取溶剂,分别为等量的75%甲醇溶液、甲醇、75%乙醇溶液和乙醇,提取方法分别为加热回流和超声提取,提取体积分别为20、25和50 mL,提取时间分别为30、45和60 min,结果表明,以75%甲醇溶液超声提取45 min,提取效率略优,且方法简便,故提取方法确定为1 g药材加入75%甲醇溶液25 mL,超声提取45 min。
3.3 小结本研究建立了同时测定广藿香中新西兰牡荆苷2、毛蕊花糖苷、异毛蕊花糖苷、列当苷、藿香黄酮醇和广藿香酮的UPLC分析方法,结果不同批次广藿香药材中6个成分的含量差异较大。该方法同时分析了广藿香中不同类别的化学成分,与前期报道的广藿香质量分析方法相比[4, 13-18],更能全面地反映广藿香药材的质量。经方法验证,所建立的测定方法符合定量分析要求,操作简单,结果准确、可靠,重现性好,可为广藿香药材及其制剂定量控制指标的选择提供参考,为广藿香药材及其制剂的质量标准的建立提供一定的科学依据。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 45 ChP 2015. VolⅠ[S]. 2015: 45 |
| [2] |
张英, 周光雄. 广藿香的本草考证研究[J]. 中药材, 2015, 38(9): 1986. ZHANG Y, ZHOU GX. The textual research of Pogostemon cablin[J]. J Chin Med Mater, 2015, 38(9): 1986. |
| [3] |
吴友根, 郭巧生, 郑焕强. 广藿香本草及引种历史考证的研究[J]. 中国中药杂志, 2007, 32(20): 2114. WU YG, GUO QS, ZHENG HQ. Texual research on history of introduction and herbal medicine of Pogostemon cablin[J]. China J Chin Mater Med, 2007, 32(20): 2114. DOI:10.3321/j.issn:1001-5302.2007.20.007 |
| [4] |
叶超, 刘芳, 陈宝龙, 等. 高效液相色谱法测定广藿香中毛蕊花糖苷的含量[J]. 中南药学, 2014, 12(12): 1248. YE C, LIU F, CHEN BL, et al. HPLC determination of verbascoside in Pogostemon cablin[J]. Cent South Pharm, 2014, 12(12): 1248. DOI:10.7539/j.issn.1672-2981.2014.12.024 |
| [5] |
陈英, 吴友根, 张军锋, 等. 广藿香生物活性和遗传多样性研究进展[J]. 热带生物学报, 2013, 4(3): 276. CHEN Y, WU YG, ZHANG JF, et al. Advances on biological activity and genetic diversity of Pogostemon cablin[J]. J Trop Biol, 2013, 4(3): 276. |
| [6] |
王大海, 殷志琦, 张庆文, 等. 广藿香非挥发性化学成分的研究[J]. 中国中药杂志, 2010, 20(10): 2704. WANG DH, YIN ZQ, ZHANG QW, et al. Nonvolatile chemical constituents from Pogostemon cabin[J]. China J Chin Mater Med, 2010, 20(10): 2704. |
| [7] |
周勤梅, 彭成, 李小红, 等. 广藿香地上部分化学成分研究[J]. 中药材, 2013, 36(6): 915. ZHOU QM, PENG C, LI XH, et al. Study on constituents of the aerial parts of Pogostemon cablin[J]. J Chin Med Mater, 2013, 36(6): 915. |
| [8] |
黄烈军, 穆淑珍, 张建新, 等. 中药广藿香非挥发性化学成分的研究[J]. 中国中药杂志, 2009, 34(4): 410. HUANG LJ, MU SZ, ZHANG JX, et al. Chemical constituents from involatile moiety of Pogostemon cablin[J]. China J Chin Mater Med, 2009, 34(4): 410. |
| [9] |
张广文, 蓝文键, 苏镜娱, 等. 广藿香精油化学成分分析及其抗菌活性(Ⅱ)[J]. 中草药, 2002, 33(3): 210. ZHANG GW, LAN WJ, SU JY, et al. Chemical constituents and their antifungal and antibacterial activities of essential oil of Pogostemon cablin Ⅱ[J]. Chin Tradit Herb Drugs, 2002, 33(3): 210. |
| [10] |
张广文, 马祥全, 苏镜娱, 等. 广藿香中的黄酮类化合物[J]. 中草药, 2001, 32(10): 871. ZHANG GW, MA XQ, SU JY, et al. Flavonoids isolated from Pogostemon cablin[J]. Chin Tradit Herb Drugs, 2001, 32(10): 871. |
| [11] |
赵思蕾, 熊亮, 王振强, 等. 基于成分敲除/敲入研究广藿香油抗菌主要药效物质[J]. 天然产物研究与开发, 2016, 28: 707. ZHAO SL, XIONG L, WANG ZQ, et al. Analysis of main antibacterial components in patchouli oil based on constituent knock-out/knock-in[J]. Nat Prod Res Dev, 2016, 28: 707. |
| [12] |
LIU F, CAO W, DENG C, et al. Polyphenolic glycosides isolated from Pogostemon cablin(Blanco)Benth.as novel influenza neuraminidase inhibitors[J]. Chem Cent J, 2016, 10: 51. DOI:10.1186/s13065-016-0192-x |
| [13] |
张颖梅, 陈海明, 吴晓丽, 等. HPLC同时测定广藿香中雷杜辛黄酮醇及广藿香酮的含量[J]. 中国实验方剂学杂志, 2013, 19(16): 160. ZHANG YM, CHEN HM, WU XL, et al. Simultaneous determination of retusine and pogostone in Pogostemon cablin by HPLC[J]. Chin J Exp Tradit Med Form, 2013, 19(16): 160. |
| [14] |
陈海明, 易宇阳, 彭绍忠, 等. 高效液相色谱法测定广藿香中广藿香酮的含量[J]. 广州中医药大学学报, 2011, 28(6): 645. CHEN HM, YI YY, PENG SZ, et al. Determination of pogostone in Pogostemon cablin(Blanco)Benth.by HPLC[J]. J Guangzhou Univ TCM, 2011, 28(6): 645. |
| [15] |
LI P, YIN ZQ, LI SL, et al. Simultaneous determination of eight flavonoids and pogostone in Pogostemon cablin by high performance liquid chromatography[J]. J Liq Chromatogr Relat Technol, 2014, 37: 1771. DOI:10.1080/10826076.2013.809545 |
| [16] |
黄月纯, 魏刚. 气相色谱法测定广藿香中百秋李醇的含量[J]. 时珍国医国药, 2006, 17(4): 503. HUANG YC, WEI G. Determination of patchouli alcohol in herba pogostemonis by GC[J]. Lishizhen Med Mater Med Res, 2006, 17(4): 503. |
| [17] |
ZHAO Z, LU J, LEUNG KF, et al. Determination of patchoulic alcohol in Herba Pogostemonis by GC-MS-MS[J]. Chem Pharm Bull, 2005, 53(7): 856. DOI:10.1248/cpb.53.856 |
| [18] |
甄亚钦, 田伟, 王迎春, 等. HPLC波长切换法同时测定广藿香配方颗粒中咖啡酸、毛蕊花糖苷、异毛蕊花糖苷和广藿香酮的含量[J]. 中国实验方剂学杂志, 2017, 23(11): 57. ZHEN YQ, TIAN W, WANG YC, et al. Simultaneous determination of caffeic acid, acteoside, isoacteoside and pogostone in Pogostemonis Herba Formula granules by HPLC with changing wavelength[J]. Chin J Exp Tradit Med Form, 2017, 23(11): 57. |
 2018, Vol. 38
2018, Vol. 38 
