2. 中国食品药品检定研究院, 北京 100050;
3. 西安交通大学药学院, 西安 710061
2. National Institutes for Food and Drug Control, Beijing 100050, China;
3. School of Pharmacy, Xi'an Jiaotong University, Xi'an 710061, China
加味逍遥丸由柴胡、当归、白芍、白术(麸炒)、茯苓、甘草、牡丹皮、栀子(姜炙)、薄荷9味药组成。剂型为小蜜丸、大蜜丸或水丸。功能主治为疏肝清热,健脾养血。其质量标准收载于《中华人民共和国药典》2015年版一部[1]、《卫生部药品标准》中药成方制剂第十一册和国家药品标准WS3-B-2124-96-1。其中,药典收载的标准相对完善,包括性状,显微鉴别,薄层色谱鉴别牡丹皮、柴胡、白术和栀子,相关检查项以及HPLC测定白芍和牡丹皮中的芍药苷含量。
上述质量标准无法全面、准确地控制加味逍遥丸的质量。已有的关于加味逍遥丸的定量文献主要集中在芍药苷、甘草苷、甘草酸、丹皮酚、栀子苷中的1个或2个成分[2-9],这些研究检测指标少,不能全面反映制剂的整体质量。另外也有测定加味逍遥丸中8个成分[10]、22个成分[11]以及指纹图谱[12]研究的报道,这些文献选择了更多的指标进行综合质量控制,但收集的样品批次不多,代表性不强。
本研究在上述研究的基础上简化了色谱条件,收集了10个企业的93批样品,建立了8个成分的含量测定及24个成分的指纹图谱分析法,并在较多样本的基础上采用了雷达图、聚类热图分析、夹角余弦相似度分析等方法进行较全面的数据分析与评价,为加味逍遥丸的整体质量评价和相关标准修订提供了参考。
1 仪器与试药Waters e2695高效液相色谱仪,2998PDA检测器(Waters公司)。ChemPattern 2017 pro软件(科迈恩(北京)科技有限公司)。DFT-200型高速万能粉碎机(温岭市林大机械有限公司)。SB3200D超声波清洗机(宁波新芝生物科技股份有限公司)。XS 105DU十万分之一电子天平(METTLER TOLEDO)。Milli-Q超纯水处理系统。
对照品芍药苷(批号110736-201640)、阿魏酸(批号110773-201614)、丹皮酚(批号110708-201407)、甘草酸铵(批号110731-201619)、甘草苷(批号111610-201607)、栀子苷(批号110749-201718)、西红花苷Ⅰ(批号111588-201303)、西红花苷Ⅱ(批号111589-201304)购自于中国食品药品检定研究院。色谱纯试剂甲醇、乙腈购自Fisher公司,分析纯试剂甲醇、磷酸购自北京化学试剂厂。加味逍遥丸样品来自10个生产企业,见表 1。
|
|
表 1 样品信息 Table 1 Information of samples |
采用阿克苏诺贝尔公司Kromasil C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈为流动相A,0.2%磷酸水溶液为流动相B,进行梯度洗脱(0~40 min,5%A→22%A;40~60 min,22%A→50%A;60~75 min,50%A→90%A;75~80 min,90%A),流速1 mL·min-1,柱温35 ℃,检测波长为234 nm和440 nm,并进行200~700 nm全波长扫描。
2.2 混合对照品溶液的制备精密称取芍药苷、阿魏酸、丹皮酚、甘草酸铵、甘草苷、栀子苷、西红花苷Ⅰ、西红花苷Ⅱ的对照品适量,加甲醇制成质量浓度依次为137.08、4.60、117.80、88.82、31.98、10.28、0.83和4.34 μg·mL-1的混合溶液,即得。
2.3 供试品溶液的制备称取样品粉末1 g,精密称定。置于具塞锥形瓶中,精密加入甲醇50 mL,称量,超声处理30 min(功率250 W,频率33 kHz),放冷,再称量,用甲醇补充减失的量,使用0.45 μm孔径滤膜滤过,取续滤液即得。
2.4 测定及数据分析精密吸取上述混合对照品溶液供试品溶液各4 μL,注入高效液相色谱仪,记录色谱图。计算样品的含量并进行统计分析。将采集的HPLC数据以ANDI格式导出,再导入至ChemPattern 2017 pro软件,样品色谱峰峰面积积分后进行Pareto标度化处理,再进行夹角余弦相似度、聚类热图和主成分分析。含量测定结果采用雷达图分析。
3 结果与讨论 3.1 色谱条件与前处理条件的优化对已发表多指标分析文献[10-12]的色谱条件进行了一定程度的简化。简化后的条件既保证了分离的色谱峰数量和分离度,又保证了分析时间适中,确定为最终色谱条件。已发表的多指标分析文献有采用甲醇超声30 min的方式[10]或者50%乙腈水回流1 h的方式[11]。本研究在参考上述文献的基础上比较了不同甲醇浓度(50%甲醇水、75%甲醇水和100%甲醇)、不同提取时间(30、45和60 min)的提取效率,最终选择了超声处理30 min。
3.2 色谱峰的指认及归属本法采用2个检测波长,以保证对制剂中不同化合物均能较好地检测,图 1、2分别为234 nm和440 nm波长下的对照品、药材和样品的典型色谱图。
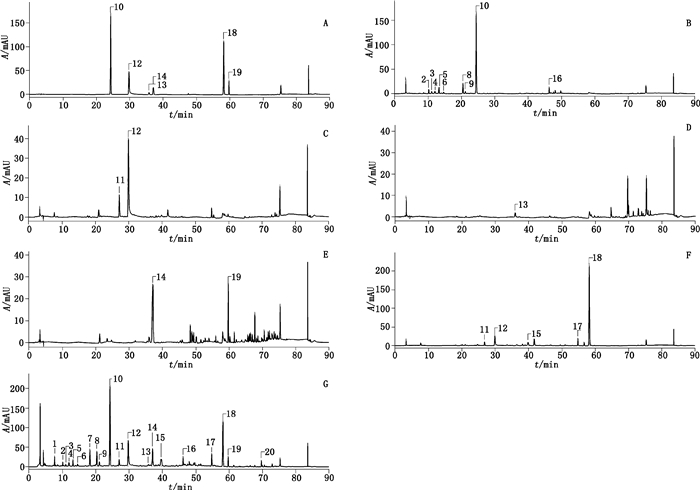
|
1.牡丹皮peak 1(peak 1 of Moutan Cortex)2.栀子peak 1(peak 1 of Gardeniae Fructus)3.栀子peak 2(peak 2 of Gardeniae Fructus)4.栀子peak 3(peak 3 of Gardeniae Fructus)5.栀子peak 4(peak 4 of Gardeniae Fructus)6.栀子peak 5(peak 5 of Gardeniae Fructus)7.芍药苷亚硫酸酯(paeoniflorin sulfonate)8.栀子peak 6(peak 6 of Gardeniae Fructus)9.栀子peak 7(peak 7 of Gardeniae Fructus)10.栀子苷(geniposide)11.白芍peak 2(peak 2 of Paeoniae Radix Alba)12.芍药苷(paeoniflorin)13.阿魏酸(ferulic acid)14.甘草苷(liquiritin)15.牡丹皮peak 2(peak 2 of Moutan Cortex)16.栀子peak 9(peak 9 of Gardeniae Fructus)17.牡丹皮peak 3(peak 3 of Moutan Cortex)18.丹皮酚(paeonol)19.甘草酸(glycyrrhizic acid)20.当归peak 2(peak 2 of Angelicae Sinensis Radix) A.对照品(reference substances)B.栀子药材(Gardeniae Fructus)C.白芍药材(Paeoniae Radix Alba)D.当归药材(Angelicae Sinensis Radix)E.甘草药材(Glycyrrhizae Radix et Rhizoma)F.牡丹皮药材(Moutan Cortex)G.厂家I样品(sample of enterprise I) 图 1 HPLC色谱图(234 nm) Figure 1 HPLC chromatograms(234 nm) |
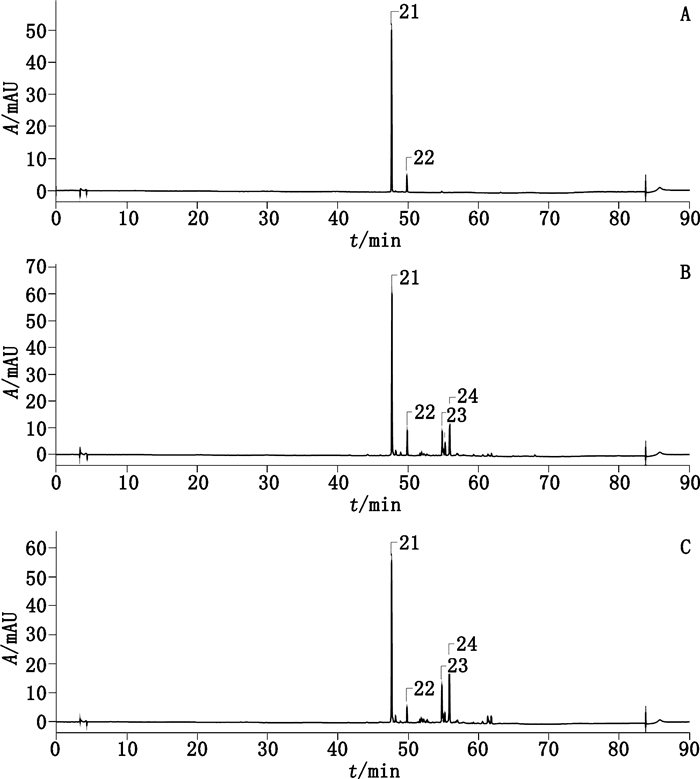
|
21.西红花苷Ⅰ(crocin Ⅰ)22.西红花苷Ⅱ(crocin Ⅱ)23.栀子peak 12(peak 12 of Gardeniae Fructus)24.栀子peak 13(peak 13 of Gardeniae Fructus) A.对照品(reference substances)B.栀子药材(Gardeniae Fructus)C.厂家Ⅰ样品(sample of enterprise Ⅰ) 图 2 HPLC色谱图(440 nm) Figure 2 HPLC chromatograms (440 nm) |
234 nm检测波长用于检测白芍、当归、牡丹皮、甘草、栀子中的成分。本文选择样品中峰面积较高的、在各厂家样品均稳定出现的且与其他药材基本不存在干扰的色谱峰作为特征峰,色谱图见图 1。其中10号峰(栀子苷)、12号峰(芍药苷)、13号峰(阿魏酸)、14号峰(甘草苷)、18号峰(丹皮酚)和19号峰(甘草酸)在《中华人民共和国药典》对应药材的各论里被选做含量测定指标,因此进行了含量测定。7号峰仅在某些厂家的样品中出现,进一步发现该峰在部分厂家提供的白芍原料中存在,最后经与文献[13]比较,认为是芍药苷亚硫酸酯,表明部分厂家或使用了经硫磺熏蒸的白芍作为原料。
3.2.2 440 nm检测的色谱峰栀子尚含有西红花苷Ⅰ、Ⅱ等二萜类成分,因此选择它们的最大吸收波长440 nm为检测波长。根据典型色谱图(图 2),药材中的特征峰主要有4个,作者对21号峰(西红花苷Ⅰ)和22号峰(西红花苷Ⅱ)进行了含量测定。
3.3 方法学验证精密吸取混合对照品溶液1、2、4、10、20 μL,分别进样测定;以进样量为横坐标,峰面积为纵坐标,进行线性回归,结果见表 2。
|
|
表 2 线性关系 Table 2 Linearity of eight components |
精密吸取混合对照品溶液4 μL,连续进样测定6次;结果芍药苷、阿魏酸、丹皮酚、甘草苷、甘草酸、栀子苷、西红花苷Ⅰ和西红花苷Ⅱ峰面积的RSD分别为0.73%、1.1%、1.6%、1.0%、2.5%、0.75%、0.58%和0.96%,表明仪器精密度良好。
精密吸取供试品溶液4 μL,分别于供试品溶液制备后0、4、8、12、16、20 h进样测定;结果上述8个成分峰面积的RSD分别为0.58%、1.7%、1.8%、1.2%、2.8%、0.78%、0.32%和0.84%,表明供试品溶液在20 h内稳定性良好。
平行制备同一样品的供试品溶液6份,进样测定;结果上述8个成分的平均含量分别为3.593、0.111、2.361、0.869、1.653、7.121、0.225和0.016 mg·g-1,RSD分别为0.77%、1.7%、2.4%、1.4%、2.1%、0.79%、1.6%和2.6%,表明方法重复性良好。
称取样品粉末0.5 g,共6份,精密称定,分别置于具塞锥形瓶中,精密加入甲醇25 mL和混合对照品溶液25 mL,后续操作照“2.3”项下方法进行,制得供试溶液,进样测定;结果上述8个成分的平均回收率分别为100.2%、96.6%、103.5%、96.2%、97.7%、96.6%、96.7%和98.7%,RSD分别为1.1%、0.31%、0.47%、0.85%、0.80%、0.70%、1.5%和1.6%,表明回收率良好。
对分析24个色谱峰的指纹图谱方法也进行了仪器精密度(n=6)、20 h稳定性(n=6)和重复性(n=6)的方法学考察。即以丹皮酚为参照物,计算各特征峰相对保留时间的RSD和相对峰面积的RSD,结果均小于3%。
3.4 含量测定结果分析按上述方法测定10个生产企业93批样品,结果见表 3。从表 3可以看出企业A、E、F、G、H、I样品的批间差异较小,产品质量较为均一;而企业B、C、D、J的产品质量均一性稍低。这8个成分中芍药苷含量差异稍小,表明质量标准中进行含量测定质量控制有一定的积极意义。
|
|
表 3 样品含量(平均值±SD,mg·g-1) Table 3 Determination results (mean±SD, mg·g-1) |
为了进一步显示各生产企业样品的含量特征,绘制了各企业样品含量(mg·g-1)的平均雷达图,见图 3。由于各成分含量存在一定差异,各成分含量乘以相应系数以使各成分含量在修正后的数值上比较接近,具体系数:芍药苷为1,阿魏酸为40,丹皮酚为2,甘草苷为4,甘草酸为2,栀子苷为0.5,西红花苷Ⅰ为15,西红花苷Ⅱ为150。由图 3可见,企业A、C、D、E、F、H、I的轮廓形状比较均匀且接近,说明各成分含量都较适中且成分含量较接近,提示质量可能较好。其余企业如B的轮廓在某些方向上有明显的凹陷,表明有些成分含量过低;也有一些企业如G和J整体轮廓较小,表明各成分含量均较低,提示上述两类样品质量可能不佳。
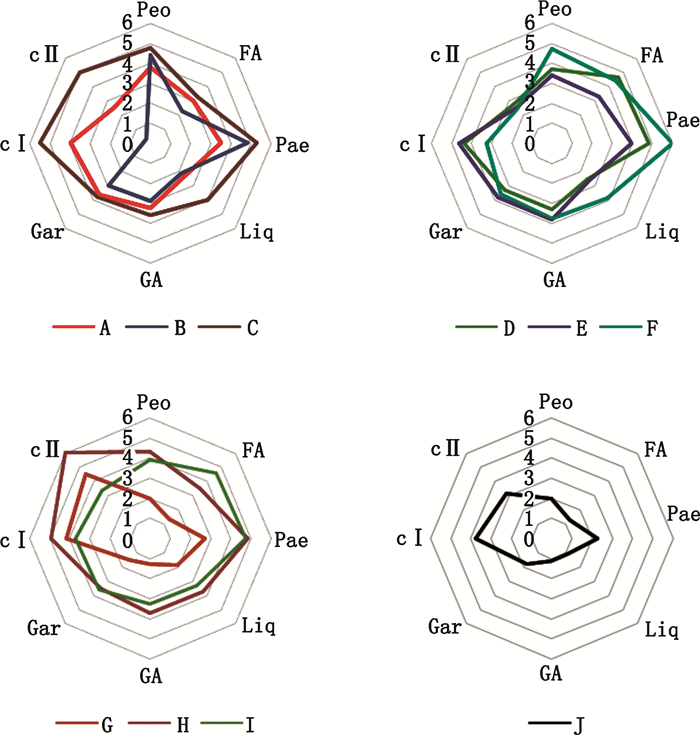
|
Peo(paeoniflorin) FA(ferulic acid) Pae(paeonol) Liq(liquiritin)GA(glycyrrhizic acid) Gar(geniposide) CⅠ(crocin Ⅰ) CⅡ(crocin Ⅱ) 图 3 各企业样品平均含量雷达图 Figure 3 Radar chart of mean contents |
综合考虑企业内部产品质量均一性及不同企业间的差异,作者认为企业A、E、F、H、I的产品质量较好。
3.5 化学计量学分析以欧氏距离、连接方法采用远邻法图进行聚类热图分析,结果见图 4。其中,横向聚类样品,纵向聚类色谱峰,热图颜色代表归一化百分比峰面积。由图可见,各企业样品基本各自聚为一类,表明同一厂家的样品较为一致且各厂家的样品间存在一定差异。但也有一些同企业样品未完全聚为一类,如企业C、D、G、I和J,表明批间尚存在一些差异。区分各样品的强特征峰为栀子苷峰、芍药苷峰、丹皮酚峰、栀子peak 6、甘草苷峰、西红花苷Ⅰ峰和牡丹皮peak 2。
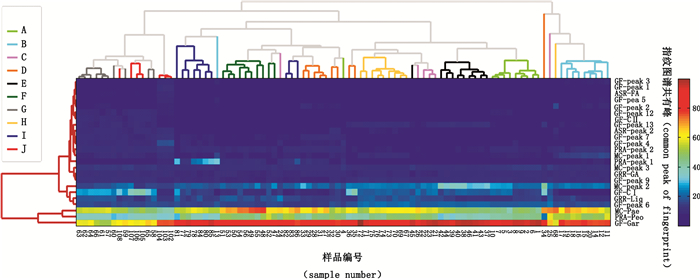
|
图 4 聚类热图分析结果 Figure 4 HCA heatmap results |
根据含量测定结果和聚类热图结果,选择质量相对较优的企业I的样品作为代表性样品,生成共有模式1;此外,以全部样品生成共有模式2,经比较2种共有模式的差异不大。采用共有模式1计算所有样品的夹角余弦相似度,结果见图 5。相似度分析显示所有样品相似度值均在0.9以上,表明这些样品较为相似。但含量测定和聚类热图分析结果表明样品间有一定差异,这说明夹角余弦相似度分析存在局限性。夹角余弦相似度分析的局限性主要是由于该算法导致大峰掩盖小峰,这与文献[14-16]的结论基本一致。
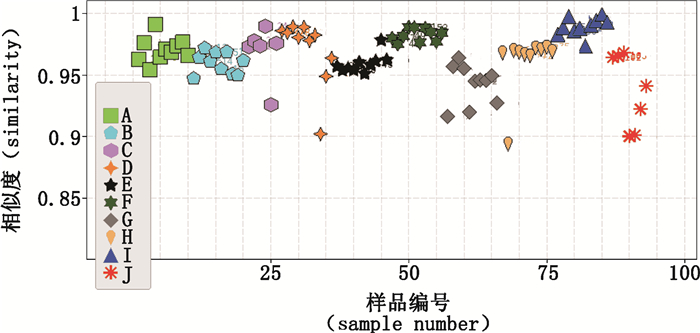
|
图 5 夹角余弦相似度分析结果 Figure 5 Cosine similarity results |
为了同时分析各种类型的成分,本研究采用了多波长检测建立了测定加味逍遥丸中8个成分的含量并对24个成分进行化学计量学分析的方法。样品涵盖10个企业共计93批,具有较强的代表性和较广的覆盖面。通过雷达图、聚类热图和夹角余弦相似度等分析法,综合地评价了不同企业间样品的异同点、含量特征与成分特征,为加味逍遥丸的综合质量控制和评价提供了参考。
| [1] |
中华人民共和国药典2010年版. 一部[S]. 2010: 816 ChP 2010. Vol Ⅰ[S]. 2010: 816 |
| [2] |
张庆, 沈美琼. HPLC法测定加味逍遥丸中芍药苷的含量[J]. 中国药师, 2009, 12(4): 468. ZHANG Q, SHEN MQ. Determination of paeoniflorin in Jiaweixiaoyao pills by HPLC[J]. China Pharm, 2009, 12(4): 468. |
| [3] |
李珂, 贾宝秀, 刘彩红, 等. 高效液相色谱法测定加味逍遥丸中丹皮酚的含量[J]. 医药导报, 2010, 29(10): 1354. LI K, JIA BX, LIU CH, et al. Determination of paeonol in Jiaweixiaoyao pills by HPLC[J]. Her Med, 2010, 29(10): 1354. DOI:10.3870/yydb.2010.10.038 |
| [4] |
任红心. RP-HPLC法测定加味逍遥丸中栀子苷的含量[J]. 中医研究, 2012, 25(5): 71. REN HX. Determination of geniposide in Jiaweixiaoyao pills by RP-HPLC[J]. Tradit Chin Med Res, 2012, 25(5): 71. |
| [5] |
陈玉杰. 高效毛细管电泳法测定加味逍遥丸中芍药苷、栀子苷的含量[J]. 中国实验方剂学杂志, 2012, 18(10): 146. CHEN YJ. Determination of paeoniflorin and geniposide in Jiawei Xiaoyao pills by high performance capillary electrophoresis[J]. Chin J Exp Tradit Med Form, 2012, 18(10): 146. DOI:10.3969/j.issn.1005-9903.2012.10.042 |
| [6] |
魏龙. 高效液相色谱法测定加味逍遥丸芍药苷的含量[J]. 中国医药指南, 2013, 11(29): 47. WEI L. Determination of paeoniflorin in Jiaweixiaoyao pills by HPLC[J]. Guide China Med, 2013, 11(29): 47. DOI:10.3969/j.issn.1671-8194.2013.29.032 |
| [7] |
杜蓉, 张孟佑. HPLC法测定加味逍遥丸中芍药苷与甘草苷的含量[J]. 中国药房, 2015, 26(18): 2571. DU R, ZHANG MY. Content determination of paeoniflorin and liquoritin in Jiaweixiaoyao pills by HPLC[J]. China Pharm, 2015, 26(18): 2571. DOI:10.6039/j.issn.1001-0408.2015.18.44 |
| [8] |
杨庆胜, 冯朝岭, 司根令. HPLC同时测定加味逍遥丸中栀子苷和芍药苷的含量[J]. 中国现代中药, 2015, 17(1): 61. YANG QS, FENG CL, SI GL. Determination of geniposide and paeoniflorin in Jiaweixiaoyao pills by HPLC[J]. Mod Chin Med, 2015, 17(1): 61. |
| [9] |
钱鑫, 徐飞. 高效液相色谱法测定加味逍遥丸中甘草酸[J]. 现代药物与临床, 2013, 28(2): 194. QIAN X, XU F. Determination of glycyrrhizic acid in Jiawei Xiaoyao pills by HPLC[J]. Drugs Clin, 2013, 28(2): 194. |
| [10] |
陈帅, 王磊, 高双, 等. HPLC-DAD法同时测定加味逍遥丸中8种成分[J]. 中草药, 2016, 47(21): 3829. CHEN S, WANG L, GAO S, et al. Simultaneous determination of eight components in Jiawei Xiaoyao pills by HPLC-DAD[J]. Chin Tradit Herb Drugs, 2016, 47(21): 3829. |
| [11] |
QIN F, HUANG J, QIU X, et al. Quality control of modified Xiaoyao San through the determination of 22 active components by ultra-performance liquid chromatography[J]. J AOAC Int, 2011, 94(6): 1778. DOI:10.5740/jaoacint.10-422 |
| [12] |
李明月, 周立红, 章顺楠, 等. 加味逍遥提取物超高效液相色谱指纹图谱研究[J]. 药物评价研究, 2016, 39(2): 230. LI MY, ZHOU LH, ZHANG SN, et al. UPLC fingerprint of extract of modified Xiaoyao[J]. Drug Eval Res, 2016, 39(2): 230. |
| [13] |
王赵, 陈玉武, 王琼, 等. 硫熏白芍的质量评价[J]. 中国中药杂志, 2014, 16(8): 3074. WANG Z, CHEN YW, WANG Q, et al. Quality assessment of sulfur-fumigated Paeoniae Alba Radix[J]. China J Chin Mater Med, 2014, 16(8): 3074. |
| [14] |
孙国祥, 侯志飞, 张春玲, 等. 色谱指纹图谱定性相似度和定量相似度的比较研究[J]. 药学学报, 2007, 42(1): 75. SUN GX, HOU ZF, ZHANG CL, et al. Comparison between the qualitative similarity and the quantitative similarity of chromatographic fingerprints of traditional Chinese medicines[J]. Acta Pharm Sin, 2007, 42(1): 75. |
| [15] |
孙国祥, 宋杨, 毕雨萌, 等. 色谱指纹图谱全定性相似度和全定量相似度质控体系研究[J]. 中南药学, 2007, 5(3): 263. SUN GX, SONG Y, BI YM, et al. Quality control system of overall qualitative similarities and overall quantitative similarities of chromatographic fingerprints[J]. Cent South Pharm, 2007, 5(3): 263. |
| [16] |
孙国祥, 任培培, 毕雨萌, 等. 双定性双定量相似度法评价银杏达莫注射液的高效液相色谱指纹图谱[J]. 色谱, 2007, 25(4): 518. SUN GX, REN PP, BI YM, et al. Quality assessment of high performance liquid chromatographic fingerprints of Ginkgo leaf extract and dipyridamole injection by double qualitative similarities and double quantitative similarities[J]. Chin J Chromatogr, 2007, 25(4): 518. |
 2018, Vol. 38
2018, Vol. 38 
