2. 齐齐哈尔市第一医院中西医结合科, 齐齐哈尔 161005;
3. 齐齐哈尔市食品药品检验检测中心, 齐齐哈尔 161005
2. Combination of Chinese Medicine and Western Medicine of the First Hospital of Qiqihar City, Qiqihar 161005, China;
3. Qiqihar Institute for Food and Drug Control, Qiqihar 161005, China
桑菊感冒片是由清代著名温病名医吴瑭的方剂“桑菊饮”经过现代加工而制成的中成药制剂[1]。本成方由桑叶、菊花、连翘、薄荷素油、苦杏仁、桔梗、甘草、芦根共计8味药组成[2-5]。临床上,桑菊感冒片多用于风热感冒、上呼吸道感染、流行性结膜炎、麻疹、流感等外感热病初起,邪气轻浅发热不重者等等。经国家食品药品监督管理局批准并生产的桑菊感冒片中,共有由百余家药厂生产的132个品种之多,因此建立一个好的标准对其质量进行全面的控制就显得尤为重要。桑菊感冒片的现行标准中,《中华人民共和国药典》2015年版一部只对连翘苷的含量进行了控制[6]1464,另有文献报道采用HPLC-UV、HPLC-ELSD等方法对其有效成分进行检测[7-12]。这些方法存在灵敏度低,分离效果不佳,专属性差等的缺点,用以检测成分复杂的中成药结果差异较大。近年来,高效液相色谱-串联质谱(HPLC-MS/MS)以其专属性强及灵敏度高等优势在中药有效成分含量测定中应用日益广泛[13-18]。
桑菊感冒片处方中含有桑叶、菊花、连翘、桔梗、甘草、薄荷、苦杏仁和芦根8味药材,《中华人民共和国药典》2015年一部对这8味药材均有收载,并对其主要化学成分进行了含量测定,其中桑叶测定了芦丁的含量[6]297,菊花测定了绿原酸的含量[6]310,连翘测定了连翘苷的含量[6]170,桔梗测定了桔梗皂苷D的含量[6]277,苦杏仁测定了苦杏仁苷的含量[6]201。有文献报道这些化学成分也正是该药材的主要成分或有效成分[2-4],因此有针对性地选择这5个化学成分进行测定,对保证桑菊感冒丸的质量及药用效果有十分重要的意义。本试验采用LC-MS/MS法同时测定桑菊感冒片中芦丁、绿原酸、连翘苷、桔梗皂苷D和苦杏仁苷的含量,以期为桑菊感冒片的全面质量评价提供科学依据。
1 仪器与试药 1.1 仪器Agilent 1200高效液相色谱仪(安捷伦公司);Agilent 6460三重四极杆质谱仪配有电喷雾离子源(安捷伦公司);B.05.00 Masshunter色谱工作站(安捷伦公司);BP 211D十万分之一电子天平(赛多利斯公司);LC-600B型数控超声波仪(济宁市中区鲁超仪器厂);超纯水仪(Millipore公司)。
1.2 试药对照品芦丁(批号100080-201409)、绿原酸(批号110753-201415)、连翘苷(批号110821-201514)、桔梗皂苷D(批号111851-201406)、苦杏仁苷(批号110820-201506),均购自中国食品药品检定研究院;桑菊感冒片共3批,批号分别为S154601、S154602、S151603,均为市售品(广西某药厂);乙腈为色谱纯,购自DikmaPure公司(批号R141095),水为超纯水,其他试剂为分析纯(天津市光复科技发展有限公司)。
2 方法与结果 2.1 色谱条件采用Waters Atlantis C18色谱柱(2.1 mm×150 mm,5 μm),流动相为乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~3 min,20%A;3~15 min,20%A→60%A;15~ 23 min,60%A;23~24 min,60%A→20%A;24~30 min,20%A),流速0.2 mL·min-1,柱温35 ℃,进样量10 μL。对照品和样品的离子流色谱图见图 1。
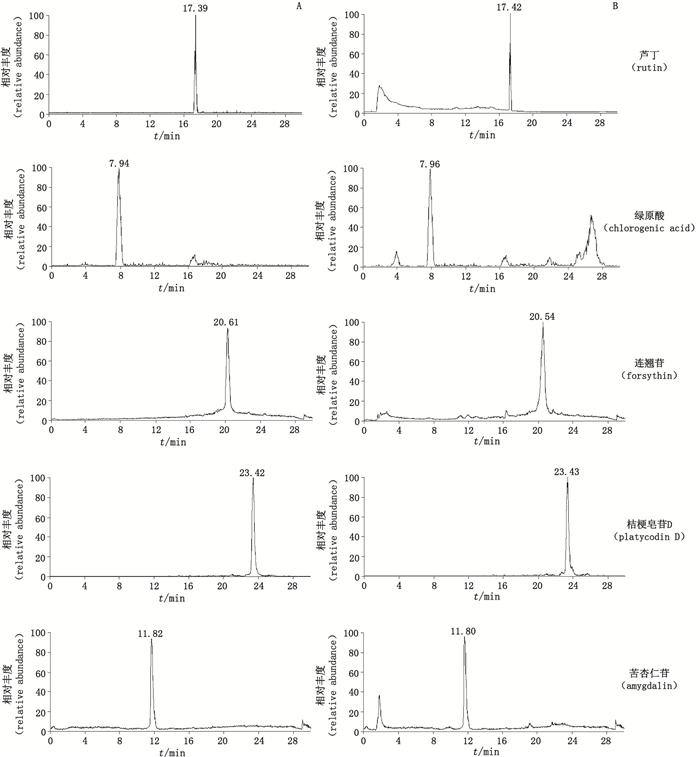
|
图 1 对照品(A)、桑菊感冒片样品(B)多重反应监测色谱图 Figure 1 Multiple-reaction monitoring chromatograms of reference substances(A)and Sangju Ganmao tablet sample(B) |
采用电喷雾离子源(ESI),多反应监测(MRM)方式进行离子扫描,采用正离子检测模式,干燥气和鞘气均为高纯氮气,干燥气温度270 ℃,干燥气流量25 L·min-1,鞘气流量10 L·min-1,毛细管电压4 500 V,喷嘴电压2 000 V,扫描时间为0.1 s,监测的离子对和MRM扫描参数见表 1。5个被测成分对照品和样品的全扫描二级质谱见图 2。
|
|
表 1 桑菊感冒片中5个成分的质谱数据 Table 1 HPLC-MS/MS data of the 5 components in Sangju Ganmao tablets |
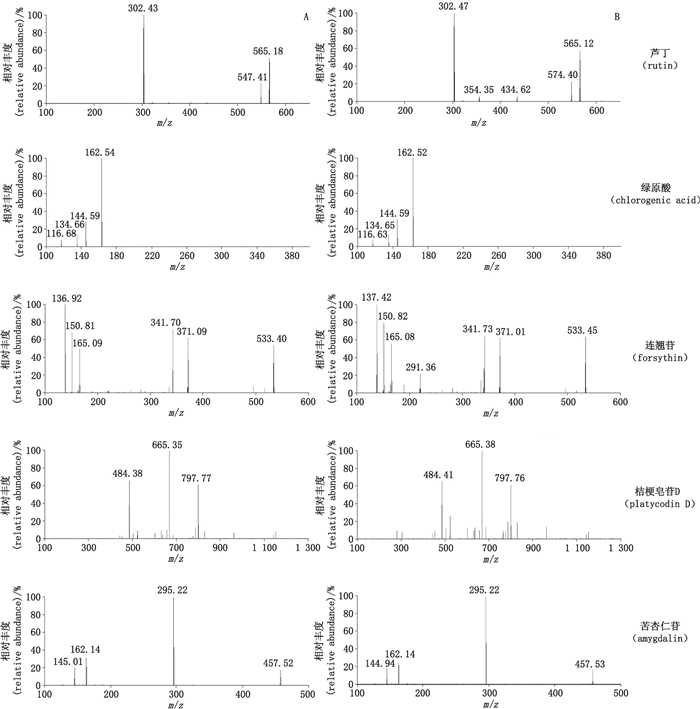
|
图 2 对照品(A)、桑菊感冒片样品(B)二级质谱图 Figure 2 Second mass spectra of reference substances(A)and Sangju Ganmao tablet sample(B) |
精密称取芦丁、绿原酸、连翘苷、桔梗皂苷D的对照品各10 mg,分别置4个100 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,即得;再精密称取苦杏仁苷对照品25 mg,置10 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,即得。
2.3.2 混合对照品储备溶液分别精密量取各对照品储备溶液均1 mL,置同一50 mL量瓶中,加60%甲醇水稀释至刻度,摇匀,即得。
2.3.3 混合对照品溶液精密称取混合对照品储备溶液1 mL,置50 mL量瓶中,加60%甲醇水稀释至刻度,摇匀,即得。
2.3.4 供试品溶液取桑菊感冒片20片,研细,精密称取细粉0.5 g,置具塞锥形瓶中,精密加入60%甲醇水50 mL,称量,超声(100 W,35 kHz)提取30 min,静置至室温,再称量,用60%甲醇水补足减失的量,摇匀,滤过;精密量取续滤液1 mL,置50 mL量瓶中,加60%甲醇水稀释至刻度,滤过,取续滤液作为供试品溶液。
2.4 方法学考察 2.4.1 线性关系考察与定量下限测定精密量取混合对照品储备溶液适量,用60%甲醇水稀释得系列浓度的混合对照品溶液(芦丁:0.010 82、0.043 28、0.216 4、0.432 8、1.082、2.164 μg·mL-1;绿原酸:0.011 25、0.045、0.225、0.45、1.125、2.25 μg·mL-1;连翘苷:0.010 18、0.040 72、0.203 6、0.407 2、1.018、2.036 μg·mL-1;桔梗皂苷D:0.010 27、0.041 08、0.205 4、0.410 8、1.027、2.054 μg·mL-1;苦杏仁苷:0.249 2、0.996 8、4.984、9.968、24.92、49.84 μg·mL-1),按“2.1”、“2.2”项下的条件进行测定,以质量浓度C(ng·mL-1)为横坐标,峰面积A为纵坐标,计算5个成分的线性回归方程。并将最低浓度用60%甲醇水再进一步稀释,以信噪比S/N=10时测得的各成分的量作为定量下限(LOQ)。线性关系和定量下限结果见表 2,表明5个成分在各自线性范围内呈良好的线性关系。
|
|
表 2 线性关系、定量下限检测结果 Table 2 The results of linear regression and LOQ of the investigated compounds |
取混合对照品溶液,按照“2.1”和“2.2”项下条件分别连续进样6次,记录峰面积。结果芦丁、绿原酸、连翘苷、桔梗皂苷D、苦杏仁苷峰面积的RSD分别为1.0%、1.3%、0.57%、1.0%、0.86%,表明精密度良好。
2.4.3 重复性试验取批号S154601的样品6份,研细,按照“2.3.4”项下方法制备供试品溶液,进样测定,计算各成分含量。结果芦丁、绿原酸、连翘苷、桔梗皂苷D、苦杏仁苷的含量分别为260.5、272.1、184.8、169.3、4 820.3 μg·g-1,RSD分别为0.82%、1.1%、1.1%、0.99%、1.6%,表明该方法重复性良好。
2.4.4 稳定性试验取同一批桑菊感冒片供试品溶液(样品批号S154601),分别于0、2、4、8、12 h进样分析,结果各成分峰面积的RSD均在3%以内,表明供试品溶液12 h内稳定性良好。
2.4.5 加样回收试验取已知含量的样品(批号S154601)细粉9份,每份0.25 g,分别加入低、中、高3种浓度的对照品储备溶液适量,按“2.3.4”项下方法分别制备供试溶液,进样分析,计算加样回收率,结果见表 3,表明本方法回收率良好。
|
|
表 3 桑菊感冒片中5个成分回收率 Table 3 Recoveries of the five components from Sangju Ganmao tablets |
精密称取3批不同批号的桑菊感冒片各3份,分别按照“2.3.4”项下的方法制备供试品溶液,按照“2.1”和“2.2”项下条件进样测定,带入线性回归方程计算5个成分含量,结果见表 4。
|
|
表 4 样品测定结果(μg·g-1,RSD < 1.8%,n=3) Table 4 Determination results |
试验过程中曾考察HPLC-UV法测定样品含量,但是中成药制剂成分比较复杂,杂质峰对主峰影响较大。且这几种物质在样品中含量较低,紫外检测器的检测灵敏度很难达到对这5个成分的同时检测。本试验建立了HPLC-MS/MS法同时测定桑菊感冒片中芦丁、绿原酸、连翘苷、桔梗皂苷D和苦杏仁苷的含量,使得灵敏度更高,专属性更强,结果更准确,可为该药品质量控制提供科学依据。
3.2 关于桔梗皂苷D的检测桔梗皂苷D是从中药桔梗中提取的三萜类化合物,是常用传统中药桔梗的主要活性成分之一,其有价格低廉,来源丰富等优点,且药理作用广泛,如抗炎,镇咳祛痰,降脂降糖,抗肿瘤作用等[19-21]。但是由于其分子结构中无共轭双键,因此无紫外吸收,现行标准[6]277及文献报道[22]主要用蒸发光散射检测器对其含量进行检测。但是该检测器存在灵敏度低,专属性差,使用不普及等缺点。本试验建立了HPLC-MS/MS法对桔梗皂苷D含量进行检测的方法,极大地提高了检验的灵敏度和专属性,为该物质的含量测定及定性鉴别提供了科学依据。
3.3 流动相的选择在试验中还考察了乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-10 mmol·L-1醋酸铵溶液等,结果表明流动相为乙腈(A)-0.1%甲酸水(B)时得到较好的峰形和分离度,而在本研究中采用的梯度洗脱程序(0~3 min,20%A;3~15 min,20%A→60%A;15~23 min,60%A;23~24 min,60%A→20%A;24~30 min,20%A)可以极大提高分离速度和效率。
3.4 提取方法的选择本试验考察了以100%乙醇、75%乙醇水、100%甲醇、60%甲醇水、20%甲醇水、水为提取溶剂的提取效果,结果表明60%甲醇水提取效果最好。还比较了超声和回流提取的效果,2种方法效果相近,所以选择较为简单的超声法作为提取方法。同时对超声时间进行了考察,结果表明超声30 min时效率最高,超过30 min后测得的各成分含量趋于平稳。
3.5 质谱参数选择在对质谱条件进行优化时,分别考察了干燥气的温度(270、320 ℃)、干燥气和鞘气的流量(30、25、15、10 L·min-1)、毛细管电压(3.5、4.5 kV)、喷嘴电压(1.5、2.0 kV)等参数对含量测定的影响,最终确定干燥气温度270 ℃,干燥气流量25 L·min-1,鞘气流量10 L·min-1,毛细管电压4 500 V,喷嘴电压2 000 V时为最优状态。本试验采用MRM模式对样品进行扫描,因此母离子和子离子的确定尤为重要,在确定母离子后,选择最佳的碎裂电压和碰撞能量,得到稳定的二级质谱图,为样品的定性鉴别提供数据支持。同时将信号相应最强最稳定的子离子作为定量离子,进行方法学考察,建立了一种专属性强,灵敏度高,准确度好的检验方法。
3.6 关于样品测定由于供检验的盲样有限,因此本试验只测定了同厂家3批不同批次的桑菊感冒片,从样品测定结果来看波动较小,对建立方法来说可能没有代表性,这是本文不足的地方,需在后续的试验研究中增加测定样品量,多考察不同企业、不同批次的样品,并对结果进行比对分析,弥补此处不足。
3.7 小结本试验采用HPLC-MS/MS法对桑菊感冒片中芦丁、绿原酸、连翘苷、桔梗皂苷D和苦杏仁苷5个成分进行含量测定,结果显示,所建立的方法准确、可靠,重复性好,灵敏度高,为桑菊感冒片的全面质量控制提供科学依据。
| [1] |
吴瑭. 温病条辨[M]. 北京: 中国中医药出版社, 2006, 90. WU T. Febrile Disease Differentiation[M]. Beijing: China Press of Traditional of Chinese Medicine, 2006, 90. |
| [2] |
姚静, 张超. 桑菊感冒合剂提取工艺的研究[J]. 中国医药指南, 2014, 12(25): 96. YAO J, ZHANG C. Study on extraction process of Sangjuganmao mixture[J]. Guide China Med, 2014, 12(25): 96. |
| [3] |
杨周贇. 桑菊饮化裁治疗春季感冒后咳嗽30例[J]. 北方药学, 2013, 10(7): 47. YANG ZY. 30 cases of coughing after colds in spring with Sanju changed drink[J]. J North Pharm, 2013, 10(7): 47. |
| [4] |
孙立艳. 桑菊感冒片生产工艺改进[D]. 天津: 天津大学, 2013 SUN LY. Improvement of Production Process of Sangjuganmao Tablets[D]. Tianjin: Tianjin University, 2013 |
| [5] |
韦春燕. 桑菊饮加减治疗妊娠期感冒26例[J]. 中国民族民间医药, 2010, 19(17): 173. WEI CY. Cold treatment of 26 cases of pregnancy Sangju decoction[J]. Chin J Ethnomed Ethnopharm, 2010, 19(17): 173. DOI:10.3969/j.issn.1007-8517.2010.17.131 |
| [6] |
中华人民共和国药典2015年版. 一部[S]. 2015: 1464, 297, 310, 170, 277, 201 ChP 2015. Vol Ⅰ[S]. 2015: 1464, 297, 310, 170, 277, 201 |
| [7] |
茅纯, 郑娟, 邹耀华. 高效液相色谱法同时测定桑菊感冒片中绿原酸、木犀草苷和3, 5-O-二咖啡酰基奎宁酸含量[J]. 中华中医药学刊, 2014, 31(1): 193. MAO C, ZHENG J, ZOU YH. Content determination of chlorogenic acid, luteolin glycosides and 3, 5-O-dicaffeoylquinic acid in Sangju Ganmao tablets with HPLC[J]. Chin Arch Tradit Chin Med, 2014, 31(1): 193. |
| [8] |
丁大勇, 高菲, 姚琳, 等. HPLC-ELSD法测定桑菊感冒片中桔梗皂苷D的含量[J]. 中国中医药信息杂志, 2012, 19(3): 54. DING DY, GAO F, YAO L, et al. Determination of platycodin D in tablets of Sangju for common cold by HPLC-ELSD[J]. Chin J Inf Tradit Chin Med, 2012, 19(3): 54. |
| [9] |
袁才琼, 邱海蕴, 康红英. 高效液相色谱法测定桑菊感冒片中绿原酸的含量[J]. 中国医院药学杂志, 2010, 30(4): 348. YUAN CQ, QIU HY, KANG HY. Determination of chlorogenic acid in Sangjuganmao tablets by HPLC[J]. Chin J Hosp Pharm, 2010, 30(4): 348. |
| [10] |
刘志武. 高效液相色谱法同时测定桑菊感冒片中连翘苷和甘草苷含量[J]. 医药导报, 2008, 27(7): 855. LIU ZW. Content determination of forsythin and liquiritin in Sangjuganmao tablets by HPLC[J]. Her Med, 2008, 27(7): 855. |
| [11] |
张雷, 何兵. HPLC测定桑菊感冒片中绿原酸的含量[J]. 现代医药卫生, 2007, 23(16): 2379. ZHANG L, HE B. Determination of the content of chlorogenic acid in Sangju Ganmao tablets by HPLC[J]. Mod Med Health, 2007, 23(16): 2379. DOI:10.3969/j.issn.1009-5519.2007.16.006 |
| [12] |
李洁, 吴政然. 高效液相色谱法测定桑菊感冒片中连翘苷的含量[J]. 实用中医内科杂志, 2006, 20(3): 250. LI J, WU ZR. Content determination of forsythin in Sangjuganmao tablets by HPLC[J]. J Pract Tradit Chin Intern Med, 2006, 20(3): 250. |
| [13] |
李敏. 中药材质量与控制[M]. 北京: 中国医药科技出版社, 2006, 242. LI M. Quality Control of Traditional Chinese Medicine[M]. Beijing: China Medical Science Press, 2006, 242. |
| [14] |
李敏. 中药材市场动态及应用前景[M]. 北京: 中国医药科技出版社, 2006, 196. LI M. Market Dynamics and Application Prospect of Traditional Chinese Medicine[M]. Beijing: China Medical Science Press, 2006, 196. |
| [15] |
赵振霞, 王敏, 王钰宁, 等. UPLC-MS/MS法测定心可舒胶囊中5种皂苷类成分的含量[J]. 药物分析杂志, 2016, 36(3): 494. ZHAO ZX, WANG M, WANG YN, et al. Simultaneous determination of five saponins in Xinkeshu capsules by UPLC-MS/MS[J]. Chin J Pharm Anal, 2016, 36(3): 494. |
| [16] |
史贺, 张巧月, 杨浩天, 等. HPLC-MS/MS法同时测定健胃消食片中8种化学成分的含量[J]. 药物分析杂志, 2015, 35(9): 1606. SHI H, ZHANG QY, YANG HT, et al. Simultaneous quantification of 8 main active constituents in Jianwei Xiaoshi tablets by liquid chromatography tandem mass spectrometry[J]. Chin J Pharm Anal, 2015, 35(9): 1606. |
| [17] |
任艳平, 常路, 曹亮, 等. HPLC-MS法同时测定舒血宁注射液中萜类内酯和黄酮醇苷的含量[J]. 药物分析杂志, 2013, 33(2): 220. REN YP, CHANG L, CAO L, et al. Simultaneous determination of terpene lactones and favonoid aglycones in Shuxuening injection by HPLC-MS[J]. Chin J Pharm Anal, 2013, 33(2): 220. |
| [18] |
蔡晓翠, 贺金华, 顾政一, 等. HPLC-MS/MS法同时测定新疆一枝蒿药材中5个成分的含量[J]. 药物分析杂志, 2013, 33(10): 1672. CAI XC, HE JH, GU ZY, et al. .Simultaneous determination of 5 constitunes in Aremisia rupestris L.by HPLC-MS/MS[J]. Chin J Pharm Anal, 2013, 33(10): 1672. |
| [19] |
张程, 邢德刚. 桔梗皂苷D对MG-63细胞的凋亡作用[J]. 广东药科大学学报, 2017, 33(1): 123. ZHANG C, XING DG. Effect of platycodin D on the apoptosis of MG-63 cells[J]. J Guangdong Pharm Univ, 2017, 33(1): 123. |
| [20] |
邹葭霜, 单进军, 谢彤, 等. 桔梗皂苷D的研究进展[J]. 中成药, 2014, 36(4): 823. ZOU XS, SHAN JJ, XIE T, et al. Advances in the study of platycodin D[J]. Chin Tradit Pat Med, 2014, 36(4): 823. |
| [21] |
QU YL, ZHOU L, WANG CL. Effects of platycodin D on IL-1β-induced inflammatory response in human osteoarthritis chondrocytes[J]. Int Immunopharmacol, 2016, 40: 474. DOI:10.1016/j.intimp.2016.09.025 |
| [22] |
方香香, 黄碧涛, 曾金祥, 等. 不同产地桔梗药材中总皂苷及桔梗皂苷D的含量比较[J]. 中国实验方剂学杂志, 2016, 22(1): 78. FANG XX, HUANG BT, ZENG JX, et al. Content difference of total saponins and platycodin-D in Platycodonis Radix from different origins[J]. Chin J Exp Tradit Med Form, 2016, 22(1): 78. |
 2018, Vol. 38
2018, Vol. 38 
