2. 南京工业大学药学院, 南京 210009
2. School of Pharmaceutical Sciences, Nanjing Tech University, Nanjing 210009, China
阿齐沙坦(azilsartan)(化合物1),化学名为2-乙氧基-1-[[2′-(4,5-二氢-5-氧代-1,2,4-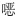
本文采用的合成工艺是以2-乙氧基-1-[(2’-氰基[1,1’-联苯基]-4-基)甲基]-1H-苯并咪唑-7-羧酸甲酯(化合物2)为起始原料经加成、酰化、环合、水解等反应生成化合物1(阿齐沙坦),反应过程如图 1。合成过程中的2-乙氧基-1-[[2’-(羟基脒基)[1,1’-联苯基]-4-基]甲基]-1H-苯并咪唑-7-羧酸甲酯(化合物3)、2-乙氧基-1-[[2’-[[(乙氧羰基)氧基]脒基][1,1’-联苯基]-4-基]甲基]-1H-苯并咪唑-7-羧酸甲酯(化合物4)和2-乙氧基-1-[[2’-(2,5-二氢-5-氧代-1,2,4-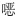
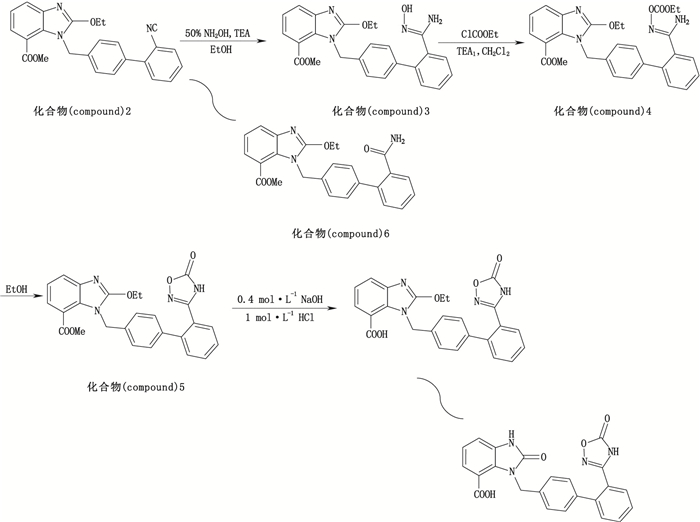
|
图 1 合成工艺路线 Figure 1 Synthetic route |
LC-2010AHT型高效液相色谱仪,含2010A型紫外检测器和岛津工作站(Shimadzu公司);Waters 2695、2996PDA液质联用仪。
冰乙酸(分析纯,南京化学试剂有限公司),乙腈(色谱纯,Burdick & Jackson),水(重蒸水)。
阿齐沙坦(化合物1),对照品批号20130408(含量99.5%),粗品批号20130312,样品批号20130315、20130226、20130401、20130402、20130403,由江苏省药物研究所有限公司合成;起始原料(化合物2)对照品,批号20130821(含量99.3%),由泰州志诚化工科技有限公司)提供;中间体(化合物3~5)对照品,批号均20131221(含量分别为99.1%、99.5%、98.9%),由江苏省药物研究所有限公司提供;副产物(化合物6,杂质A),批号20131015(含量98.5%),江苏省药物研究所有限公司提供;降解杂质B(化合物7),批号为20131018(含量99.0%),由江苏省药物研究所有限公司提供。
2 方法与结果 2.1 溶液配制取阿齐沙坦样品适量,置棕色量瓶中,加60%乙腈溶解并稀释制成每1 mL约含阿齐沙坦0.5 mg的溶液,作为供试品溶液;精密量取供试品溶液1 mL,置100 mL量瓶中,用60%乙腈稀释至刻度,摇匀,作为自身对照溶液;取杂质B对照品适量,用60%乙腈制成每1 mL中含0.005 mg的溶液,作为杂质B对照品溶液;取阿齐沙坦对照品及杂质A对照品适量,加60%乙腈溶解并稀释制成每1 mL中分别约含0.5 mg和0.005 mg的混合溶液,作为系统适用性试验溶液。
2.2 色谱条件 2.2.1 HPLC色谱条件采用Inertsil ODS-SP色谱柱(150 mm×4.6 mm,5 μm),流动相A为乙腈-水-冰乙酸(20:80:0.1),流动相B为乙腈-水-冰乙酸(80:20:0.1),梯度洗脱(0~48 min,18%B→78%B;48~50 min,78%B→18%B;50~58 min,18%B),流速1.0 mL·min-1,检测波长250 nm,柱温40 ℃,进样量20 μL。
2.2.2 色谱-质谱条件色谱条件同“2.2.1”项;电喷雾离子源,正离子检测,喷雾电压3.5 kV,锥孔电压30 kV,碰撞能量30 eV,离子源温度120 ℃,干燥温度350 ℃,雾化气流速400 L·h-1,质量数扫描范围100~500。
2.3 专属性试验将化合物1~7的对照品加60%乙腈配制成含化合物1约500 μg·mL-1,其他化合物各约5 μg·mL-1的混合溶液,进样测定;结果显示各物质均分离良好(分离度大于4.7)。理论板数以化合物1(阿齐沙坦)峰计大于20 000。为考察阿齐沙坦中可能存在的未知杂质,取阿齐沙坦的粗品适量,用60%乙腈制成500 μg·mL-1的溶液,进样测定,粗品中的有关物质与阿齐沙坦分离完全。色谱图见图 2。
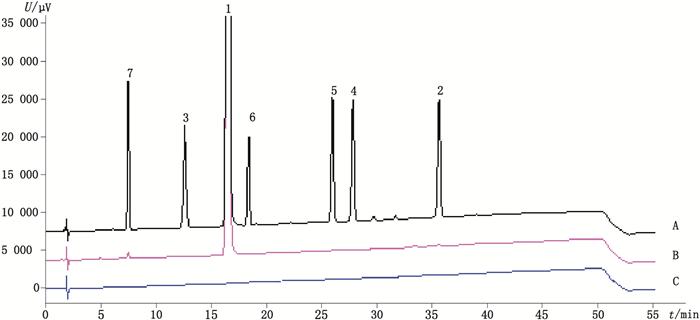
|
1.化合物1(compound 1)2.化合物2(compound 2)3.化合物3(compound 3)4.化合物4(compound 4)5.化合物5(compound 5)6.化合物6(compound 6)7.化合物7(compound 7) A.混合对照品(mixed reference substances)B.阿齐沙坦粗品(crude azilsartan)C.空白溶剂(blank) 图 2 专属性试验色谱图 Figure 2 Chromatograms for specificity test |
精密称取化合物1的样品约12.5 mg置25 mL量瓶中,加0.1 mol·L-1盐酸溶液1 mL(100 ℃水浴加热1 h,冷却,以0.1 mol·L-1氢氧化钠溶液中和),或加0.1 mol·L-1氢氧化钠溶液2 mL(100 ℃水浴加热3 h,冷却,以0.1 mol·L-1盐酸溶液中和),或加30%双氧水0.5 mL(100 ℃水浴加热5 h,冷却),或加水1 mL(在100 ℃水浴加热2 h)处理后,上述各溶液分别加60%乙腈定容至刻度,摇匀,即得强制降解供试溶液;另取1份化合物1的样品约12.5 mg置25 mL量瓶中,加60%乙腈溶解,稀释至刻度,摇匀,在自然光下放置8 h,作为光照降解供试溶液。取上述降解供试溶液,按“2.2”项下条件进样测定。结果表明,样品在酸、碱、氧化、高温以及光照条件下,均有不同程度的破坏,各降解产物峰与主峰分离完全;峰纯度考察结果表明,在本色谱条件下,样品经高温、酸、碱、氧化、光照破坏后,阿齐沙坦峰纯度因子均大于阈值,主峰纯度较好,破坏试验中产生的降解产物均与阿齐沙坦峰达到了良好分离。色谱图见图 3。
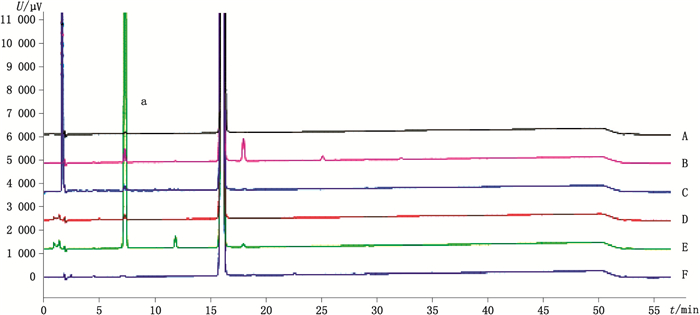
|
a.杂质B(impurity B) A.光照破坏(illumination destruction)B.高温破坏(heat destruction)C.氧化破坏(oxidation destruction)D.碱破坏(basic destruction)E.酸破坏(acid destruction)F.未破坏(undestruction) 图 3 破坏性试验色谱图 Figure 3 Chromatograms for destruction tests |
精密称取化合物1、6、7的对照品适量,加流动相分别制成质量浓度均为0.05、0.5、1、2.5和5 μg·mL-1的混合溶液,按“2.2”项下方法分别进样,记录色谱图,以质量浓度C为横坐标,峰面积A为纵坐标,进行线性回归,化合物1斜率与化合物6、7斜率的比值即为校正因子。结果,测得各杂质校正因子均在0.90~1.10,可采用不加校正因子的自身对照法对它们进行有关物质检查。
对化合物1、6、7的混合溶液逐级稀释进样,记录色谱图,以S/N=3、S/N=10计测定各杂质检测下限(LOD)、定量下限(LOQ)。结果见表 1。
|
|
表 1 线性试验结果 Table 1 Results of linearity test |
取自身对照溶液,按“2.2”项下方法连续进样测定6次,阿齐沙坦峰面积的RSD为0.83%。
2.6 稳定性试验精密量取“2.1”项下供试品溶液,分别于溶液制备后0、2、4、6和8 h进样测定,峰面积的RSD为0.71%,结果表明供试品溶液在8 h内稳定。
2.7 样品测定按“2.1”项下方法制备杂质B对照品溶液、系统适用性试验溶液、供试品溶液和自身对照溶液。精密量取系统适用性试验溶液20 μL注入液相色谱仪,记录色谱图,图中阿齐沙坦峰与杂质A峰的分离度应不小于2.5。取自身对照溶液20 μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%~25%,再精密量取供试品溶液与杂质B对照品溶液各20 μL,分别注入液相色谱仪,记录色谱图,测定供试品溶液所得色谱图中除主峰外的各杂质峰的峰面积。分别测定3批样品,化合物6(杂质A)均未检出,化合物7(杂质B)小于0.05%,其他单个杂质均未检出,总杂均小于0.05%。结果见表 2。
|
|
表 2 有关物质测定结果(%) Table 2 Determination of the related substances |
阿齐沙坦结构与缬沙坦类似,参照英国药典(BP)2012年版Updated中缬沙坦的有关物质检查条件,采用乙腈-水-冰乙酸系统进行条件摸索。冰乙酸的加入,使阿齐沙坦的保留大大提高,采用梯度洗脱使该方法达到良好的分离效果及合理的分析时间,有利于有关物质的全面洗脱。
由于各物质母体结构一样,阿齐沙坦(化合物1)、起始原料(化合物2)、杂质A(化合物6,副产物)、杂质B(化合物7,降解产物)及各中间体(化合物3~5)在250 nm的波长处均有较强的吸收,而且吸光强度相当,因此选择250 nm作为有关物质检测波长。
3.2 主要降解产物归属及降解机理分析本文所采用的HPLC色谱法专属性良好,可有效地将起始原料2,中间体3、4、5,副产物6以及化合物7与TM1分开。破坏性试验的降解产物峰也均能与主峰分开,根据各杂质对照品的保留时间定性分析,初步判断主要降解产物a为化合物7。
本研究进一步通过LC-MS对破坏性试验的产物进行鉴定。降解产物a的分子离子峰[M+H]+ m/z 429.1,该杂质的相对分子质量为428.4。结合阿齐沙坦强制降解试验条件以及专属性定位确定该化合物为化合物7,推测其降解机理如图 4:苯并咪唑环上的乙氧基水解,脱除乙基而产生,即杂质B[13-15]。
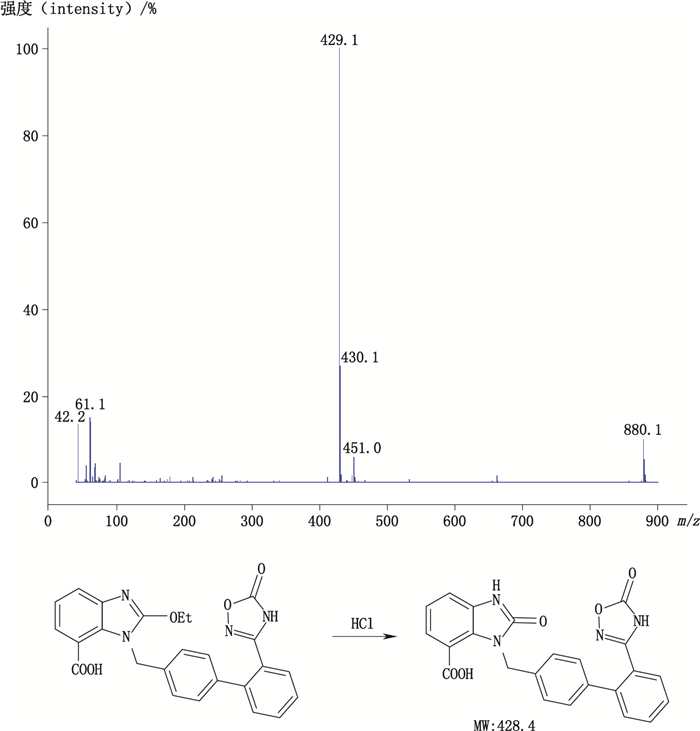
|
图 4 降解产物a质谱图及其可能的降解途径 Figure 4 MS spectrum of the degradation product a and degradation pathways |
本研究分别以0.05%和0.2%乙酸溶液配制流动相,分别使用Kromasil C18色谱柱(4.6 mm×250 mm,5 μm)和Waters Nova-Pak C18色谱柱(3.9 mm×150 mm,4 μm)以及改变柱温(35、40、45 ℃)、流速(0.8、1.0、1.2 mL·min-1)、流动相B初始比例(16%、18%、20%),考察在上述条件下各色谱峰的分离情况。结果显示系统适用性试验均符合要求,有关物质测定结果基本一致,本法适用于阿齐沙坦的有关物质的检查。
| [1] |
邹寿涛, 秦健. 阿齐沙坦的临床应用进展[J]. 药学与临床研究, 2015, 23(6): 573. ZOU ST, QIN J. Progress in clinical application of azilsartan[J]. Pharm Clin Res, 2015, 23(6): 573. |
| [2] |
赵春艳, 王京晶, 刘洋, 等. 心血管疾病新药阿齐沙坦酯的药理与临床评价[J]. 中国新药杂志, 2011, 20(19): 1831. ZHAO CY, WANG JJ, LIU Y, et al. Pharmacology and clinical evaluation of edarbi, a new drug for the treatment of cardiovascular disease[J]. Chin J New Drugs, 2011, 20(19): 1831. |
| [3] |
[H]GPH 3-1化学药物杂质研究技术指导原则[S]. 2005 [H]GPH 3-1 Guidelines of Chemical Drug Impurity Research Technique[S]. 2005 |
| [4] |
谢沐风. 如何建立高效液相色谱法测定有关物质的方法[J]. 中国医药工业杂志, 2007, 38(1): 45. XIE MF. How to establish an HPLC method for determination of related substances in drugs[J]. Chin J Pharm, 2007, 38(1): 45. |
| [5] |
吴强, 陈金嫚, 何广卫. LC-MS/MS鉴定阿齐沙坦降解产物[J]. 广州化工, 2014, 42(19): 105. WU Q, CHEN JM, HE GW. Identification of the degradation compounds of azilsartan by LC-MS[J]. Guangzhou Chem Ind, 2014, 42(19): 105. DOI:10.3969/j.issn.1001-9677.2014.19.039 |
| [6] |
韩世磊, 赵世明, 罗振福. 阿齐沙坦酯及相关杂质的合成路线图解[J]. 中国医药工业杂志, 2015, 46(1): 102. HAN SL, ZHAO SM, LUO ZF. Graphical synthetic routes of azilsartan medoxomil and related impurities[J]. Chin J Pharm, 2015, 46(1): 102. |
| [7] |
WHITE WB, WEBER MA, SICA D, et al. Effects of the angiotensin receptor blocker azilasartan medoxomil versus olmesartan and valsartan on ambulatory and clinic blood pressure in patients with stages 1 and 2 hypertension[J]. Hypertension, 2011, 57(3): 413. DOI:10.1161/HYPERTENSIONAHA.110.163402 |
| [8] |
KOHARA Y, IMAMIYA E, KUBO K, et al. A new class of angiotensin Ⅱ receptor antagonists with a novel acidic bioisostere[J]. Bioorg Med Chem Lett, 1995, 5(17): l903. |
| [9] |
RADL S, CERNY J, STACH J, et al. Improved process for azilsartan medoxomil:a new angiotensin receptor blocker[J]. Org Process Res Dev, 2013, 17(1): 77. DOI:10.1021/op3002867 |
| [10] |
AZAD AK, KSHIRSAGAR PB, SINGH SK, et al. Process for the Preparation of Azilsartan Medoxomil or Pharmaceutically Acceptable Salts Thereof: WO, 2013114305[P]. 2013-10-30
|
| [11] |
FDA. Pharmacology review[EB/OL]. [2017-07-20]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/200796Orig1s000PharmR.pdf
|
| [12] |
束蓓艳, 吴雪松, 岑均达. 阿齐沙坦的合成[J]. 中国医药工业杂志, 2010, 41(12): 881. SU BY, WU XS, CHEN JD. Synthesis of azilsartan[J]. Chin J Pharm, 2010, 41(12): 881. DOI:10.3969/j.issn.1001-8255.2010.12.001 |
| [13] |
隋立朋, 李日东, 宋波, 等. 通过微粉化工艺获得的阿齐沙坦两个降解杂质的定性以及对此降解过程控制的方法[J]. 中国药学(英文版), 2014, 23(5): 302. SUI LP, LI RD, SONG B, et al. Characterization of two degradation products of azilsartan formed during the micronization process and development of a method to control the degradation[J]. J Chin Pharm Sci, 2014, 23(5): 302. |
| [14] |
张敏, 霍立茹, 公晓伟, 等. HPLC法测定阿齐沙坦片含量[J]. 中国药房, 2014, 25(41): 3907. ZHANG M, HUO LR, GONG XW, et al. Content determination of azilsartan tablets by HPLC[J]. China Pharm, 2014, 25(41): 3907. DOI:10.6039/j.issn.1001-0408.2014.41.22 |
| [15] |
蔡鹏俊, 李悦. 沙坦类药物的质谱裂解规律及其应用[J]. 中国医药工业杂志, 2017, 48(1): 68. CAI PJ, LI Y. Mass fragmentation patterns of sartans and application[J]. Chin J Pharm, 2017, 48(1): 68. |
 2018, Vol. 38
2018, Vol. 38 
