2. 泰州葛林美克医药科技有限公司, 泰州 225300;
3. 浙江树人大学生物与环境工程学院, 杭州 310015
2. Taizhou GreenChem Pharma-Tech Co., Ltd., Taizhou 225300, China;
3. College of Biology and Environmental Engineering, Zhejiang Shuren University, Hangzhou 310015, China
醋氯芬酸(aceclofenac),别名乙酰氯芬酸,商品名美诺芬、贝速清,化学名为2-[2-[2-(2,6-二氯苯氨基)苯基]乙酰氧基]乙酸,是一种新型苯乙酸类非甾体抗炎镇痛药物,具有抗炎、镇痛和解热等药理作用。临床上广泛应用于治疗风湿性关节炎、类风湿性关节炎、骨关节炎、强直性脊柱炎等及各种疾病引起的疼痛和发热[1-3]。与大多数非甾体类抗炎药相比,醋氯芬酸具有达峰快,靶组织浓度高,镇痛作用强,治疗指数好,溃疡指数低,胃肠道不良反应少等优点[4],1998年被收入欧洲药典和英国药典[5]。笔者所在团队研发了一条适合工业化生产该药的新工艺(见图 1);参照欧洲药典[6]、《中华人民共和国药典》[7]及相关文献[8-16],建立了有关物质检测方法并对主要有关物质结构进行鉴定研究。

|
1.双氯芬酸钠(diclofenac sodium)2.醋氯芬酸(aceclofenac)3.醋氯芬酸乙酯(ethyl ester of aceclofenac)4.双氯芬酸乙酯(ethyl ester of diclofenac)5.醋氯芬酸叔丁酯(benzeneacetic acid) 图 1 醋氯芬酸中试工艺 Figure 1 Synthetic route of aceclofenac in pilot scale |
安捷伦公司Agilent 1200高效液相色谱仪(真空脱气机,ALC自动进样器、四元泵,VWD检测器);北京创新通恒科技有限公司LC 6000型半制备色谱仪;赛默飞世尔科技公司ThermoFisher ITQ 1100直接进样杆离子阱质谱仪;梅特勒-托利多公司Mettler Toledo XS205十万分之一天平;上海亚荣生化仪器厂SHB-Ⅲ旋转蒸发仪;上海精科仪器有限公司PHS-3C酸度计。
1.2 试药醋氯芬酸对照品(浙江尖峰药业有限公司,批号161110,纯度99.8%);醋氯芬酸粗品(浙江尖峰药业有限公司,批号20170422),各批醋氯芬酸原料样品(批号Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)及各杂质对照品[杂质1(原料药:双氯芬酸钠;含量:99.9%),杂质3(工艺杂质:醋氯芬酸乙酯;含量:99.0%),杂质4(工艺杂质:双氯芬酸乙酯;含量:96.8%),杂质5(合成中间体:醋氯芬酸叔丁酯;含量:99.8%)]为浙江工业大学药化实验室自制(经紫外光谱、红外光谱、质谱和核磁共振分析确证)。甲醇、乙腈、磷酸为色谱纯(美国天地试剂公司);其余试剂均为分析纯(阿拉丁试剂有限公司);试验用水为超纯水。
2 方法与结果 2.1 醋氯芬酸有关物质检测 2.1.1 色谱条件色谱柱:Shim-pack VP-ODS柱(250 mm×4.6 mm,5 μm);流动相:以1.12 mg·mL-1磷酸溶液(用1.0 mol·L-1氢氧化钠溶液调节pH至7.0)为流动相A,乙腈为流动相B,进行梯度洗脱(见表 1);流速:1.0 mL·min-1;柱温:25 ℃;紫外检测波长:276 nm;进样量:10 μL。
|
|
表 1 流动相洗脱梯度 Table 1 Elution gradient of mobile phase |
混合对照品溶液:精密称取醋氯芬酸、杂质1、杂质3、杂质4、杂质5的对照品各适量,加流动相A- 流动相B(65:35)溶解并稀释制成各约含4 μg·mL-1的混合溶液,摇匀,即得。供试品溶液:称取醋氯芬酸样品约10 mg,精密称定,置10 mL量瓶中,加流动相A- 流动相B(65:35)溶解并稀释至刻度,摇匀,即得。
2.1.3 系统适用性试验取空白溶液流动相A- 流动相B(65:35)、混合对照品溶液和供试品溶液,按“2.1.1”项色谱条件进样分析,理论板数按醋氯芬酸峰计算不低于5 000,各色谱峰与相邻色谱峰分离度均大于1.5,拖尾因子在0.9~1.1之间,空白溶液不干扰检测,色谱图见图 2。

|
1.杂质1(impurity 1)2.醋氯芬酸(aceclofenac)3.杂质3(impurity 3)4.杂质4(impurity 4)5.杂质5(impurity 5) A.空白溶液(blank solution)B.供试品溶液(analytical solution)C.混合对照品溶液(mixed reference substance solution) 图 2 醋氯芬酸高效液相色谱图 Figure 2 HPLC chromatograms of aceclofenac |
取批号为Ⅰ的样品约100 mg,精密称定,置10 mL量瓶中,加流动相A- 流动相B(65:35)溶解并稀释至刻度,摇匀,即得未经破坏溶液;精密量取上述溶液1.00 mL共7份,分别置10 mL量瓶中,进行如下处理:(A)未处理;(B)氧化破坏:加3%过氧化氢溶液1 mL,60 ℃水浴加热5 h;(C)高温破坏:120 ℃加热10 h;(D)光破坏:(4 500±500)lx光照24 h;(E)碱破坏:加1 mol·L-1氢氧化钠1 mL,60 ℃水浴加热5 h后,用1 mol·L-1盐酸溶液调pH至中性;(F)热破坏:60 ℃水浴加热5 h;(G)酸破坏:加1 mol·L-1盐酸溶液1 mL,60 ℃水浴加热5 h后,用1 mol·L-1氢氧化钠溶液调pH至中性。将上述7种溶液用流动相A- 流动相B(65:35)稀释至刻度,摇匀,按“2.1.1”项下色谱条件进样分析,色谱图见图 3。

|
2.醋氯芬酸(aceclofenac) A.未破坏(undestroyed)B.氧化破坏(destroyed by oxidation)C.高温破坏(destroyed by high temperature)D.光照破坏(destroyed by light)E.碱破坏(destroyed by alkali)F.热破坏(destroyed by heat)G.酸破坏(destroyed by acid) 图 3 专属性试验色谱图 Figure 3 Chromatograms for specificity test of aceclofenac |
结果表明,醋氯芬酸在高温、光照条件下较稳定,杂质个数、总量无明显变化,而在酸、碱、氧化条件下均有不同程度的降解。各破坏条件下所产生的降解产物均与醋氯芬酸能很好分离,峰纯度分析显示各破坏溶液色谱图中醋氯芬酸峰均为单一峰,表明本法专属性良好。
2.1.5 线性关系考察精密称取醋氯芬酸、杂质1、杂质3、杂质4、杂质5的对照品各适量,分别用流动相A- 流动相B(65:35)溶解并逐步稀释制成质量浓度均分别为1.6、3.2、4.0、4.8、5.6、9.6和17.6 μg·mL-1的系列浓度混合对照品溶液。按“2.1.1”项下色谱条件进样测定,由质量浓度(C)对峰面积(A)做线性回归,所得方程及其校正因子(计算校正因子需折算各杂质对照品含量)见表 2。由结果可见杂质3、杂质4校正因子在0.9~1.1范围内,可采用主成分自身对照法计算含量;其他杂质需加校正因子的主成分自身对照法计算含量。
|
|
表 2 线性数据汇总 Table 2 Summarization of linear data |
精密称取醋氯芬酸对照品和各杂质对照品均约10 mg,置100 mL量瓶中,用流动相A- 流动相B(65:35)制成质量浓度约为100 μg·mL-1的混合溶液;精密吸取混合溶液适量,用流动相A- 流动相B(65:35)逐级稀释,按“2.1.1”项下色谱条件进样测定,确定醋氯芬酸、杂质1、杂质3、杂质4和杂质5的定量下限(S/N≈10)分别为0.10、0.16、0.14、0.17和0.14 μg·mL-1,检测下限(S/N≈3)分别为0.03、0.05、0.04、0.05和0.04 μg·mL-1。本法设定的供试品溶液浓度,可满足有关物质检测的要求。
2.1.7 精密度试验按“2.1.2”项下方法配制每1 mL中含醋氯芬酸1 mg及各杂质4 μg的混合对照品溶液,按“2.1.1”项下色谱条件连续进样测定6次,记录色谱图,测得醋氯芬酸、杂质1、杂质3、杂质4和杂质5峰面积的RSD(n=6)分别为0.36%、0.62%、0.26%、0.21%和0.33%,RSD均小于2%。
2.1.8 稳定性试验按“2.1.2”项下方法制成混合对照品溶液及供试品溶液,分别于0、2、4、6、8、12、18、24 h按“2.1.1”项下色谱条件进样分析,以考察混合对照品溶液及供试品溶液的稳定性。结果显示,测得混合对照品溶液中醋氯芬酸、杂质1、杂质3、杂质4和杂质5在24 h内峰面积的RSD分别为0.22%、0.61%、0.79%、0.48%和1.8%,均小于2%;供试品溶液在24 h内主峰峰面积的RSD为0.65%,小于2%,表明待测溶液24 h内稳定。
2.1.9 准确度与重复性试验精密称取杂质1对照品约10 mg,其他各杂质对照品约5 mg,置同一100 mL量瓶中,加流动相A- 流动相B(65:35)溶解并稀释至刻度,摇匀,即得杂质对照品储备液。精密称取醋氯芬酸对照品(批号161110)约50 mg,共9份,分别置25 mL量瓶中,平均分成3组,每组分别加入杂质对照品储备液0.8、1.0、1.2 mL(相当于醋氯芬酸限度的80%、100%、120%),用流动相A- 流动相B(65:35)溶解并稀释至刻度,摇匀,即得3个不同杂质浓度的供试溶液。按“2.1.1”项下色谱条件进样分析,以工作曲线折算实际测量值,进而计算各样品回收率(即为准确度)、相对标准偏差(RSD,即为重复性)。经计算,杂质1、杂质3、杂质4和杂质5的3个水平的回收率平均值在92%~105%之间,RSD均小于2%。结果表明该方法准确度高,重复性好(见表 3)。
|
|
表 3 有关物质含量测定试验结果 Table 3 Results of content determination of related substances |
取5批样品进行检测,结果见表 4和图 4。根据多批样品的检测结果,将杂质1、杂质5用加校正因子的主成分自身对照法进行定量,其余杂质采用不加校正因子的主成分自身对照法进行定量。供试品溶液色谱图中如有杂质峰,杂质1校正后的峰面积计算不得大于对照溶液主峰面积的0.2倍(0.2%),其他单一杂质校正后的峰面积计算不得大于对照溶液主峰面积的0.1倍(0.1%),各杂质校正后的峰面积之和不得大于对照溶液主峰面积的0.5倍(0.5%)。
|
|
表 4 样品检测结果(%) Table 4 The test results of samples |
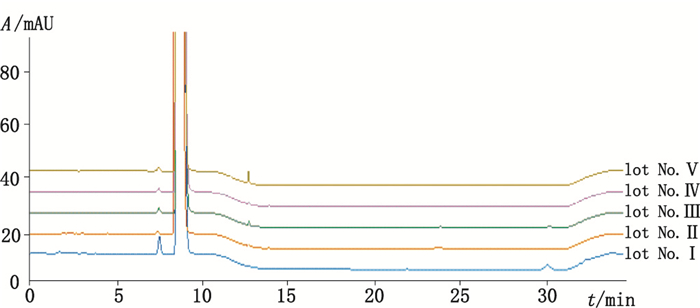
|
图 4 样品色谱图 Figure 4 Chromatograms of samples |
醋氯芬酸粗品中主成分含量高,杂质含量极低,直接制备相当困难,因此根据主成分与杂质之间的性质差异,先采用50 cm×5.0 cm硅胶柱层析进行粗分离。具体分离步骤:将醋氯芬酸粗品约3 g(经液相色谱检测约含杂质总量10.0%),加适量二氯甲烷溶解,再加入约2倍量的粗硅胶混匀,旋干成粉末状待用。采用干法上样,均匀分散在层析硅胶柱的顶部硅胶层表面,以石油醚-乙酸乙酯(8:1,7:1,6:1,5:1,4:1,3:1)依次进行梯度洗脱,每个比例约300 mL。当出现第1个样点时进行洗脱液的接取,在洗脱期间需不断点板,观察洗脱液中的样品成分,并适时增加乙酸乙酯的比例,直至出现主成分的样点后停止接取洗脱液,将收集到的所有洗脱液合并,用旋转蒸发仪蒸干浓缩后得到杂质粗品。对30 g醋氯芬酸粗品,按照上述方法进行重复操作10次,得到杂质粗品共约800 mg。
2.2.2 制备HPLC仪分离提纯色谱条件:采用SunFire C18色谱柱(19 mm×250 mm,10 μm),流动相A为0.05%磷酸水溶液,流动相B为甲醇,梯度洗脱(0~20 min,70%B;20~30 min,70%B→90%B;30~45 min,90%B),流速17.0 mL·min-1,检测波长276 nm,柱温25 ℃,进样量5 mL。
将800 mg杂质粗品用适量甲醇溶解制成2.0×104 μg·mL-1的溶液,滤过,进样分析,多次收集同一保留时间出峰的流出液(图 5),60 ℃旋转蒸发至干得到3个主要杂质,经HPLC分析纯度分别为99.0%、96.8%、98.7%(按面积归一化法计算)。
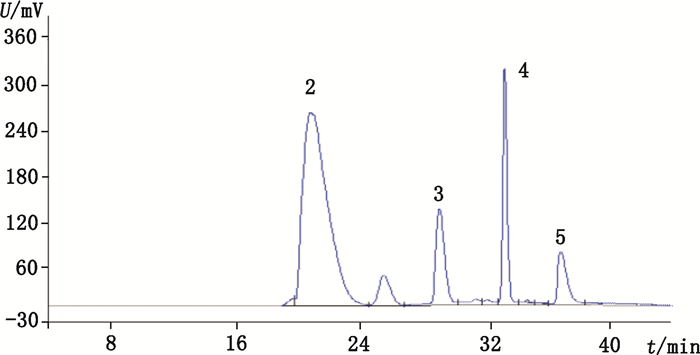
|
2.醋氯芬酸(aceclofenac)3.醋氯芬酸乙酯(ethyl ester of aceclofenac)4.双氯芬酸乙酯(ethyl ester of diclofenac)5.醋氯芬酸叔丁酯(benzeneacetic acid) 图 5 主要杂质的半制备液相色谱图 Figure 5 The semi-preparative HPLC chromatogram of the main impurity |
制备得到的3个杂质峰(图 5中的峰3~5)与醋氯芬酸样品的HPLC数据对比结果相同,再分别进行ESI-MS、1H-NMR、13C-NMR测定,确定化学结构。
2.2.3.1 杂质3峰3的杂质(杂质3)的质谱图见图 6(ESI-MS m/z 385.9 [M+H]+)。1H-NMR(500 MHz,CDCl3)信号(图 7-A)归属与文献[16]对比:δ 7.36(2H,d,J=8.1 Hz,H-11,13),δ 7.29(1H,dd,J=7.7、1.5 Hz,H-6),δ 7.16(1H,td,J=7.9、1.5 Hz,H-2),δ 7.04~6.96(2H,m,H-1,12),δ 6.75(1H,s,H-N),δ 6.58(1H,dd,J=8.0、0.8 Hz,H-3),δ 4.69(2H,s,H-15),δ 4.21(2H,q,J=7.1 Hz,H-17),δ 3.96(2H,s,H-7),δ 1.23(3H,t,J=7.1 Hz,H-18)。13C-NMR(125 MHz,CDCl3)信号(图 7-B)归属与文献[16]对比:δ 171.4(C-8),167.4(C-16),142.8~118.4(ArC,1~6,9~14),61.5(C-17),61.3(C-15),38.1(C-7),14.0(C-18)。确定杂质3为醋氯芬酸乙酯(ethyl ester of aceclofenac),化学名为乙基[[[2-[(2,6-二氯苯基)氨基]苯基]乙酰基]氧基]乙酸{ethyl [[[2-[(2,6-dichlorophenyl)amino]phenyl]acetyl]oxy]acetate},结构式见图 8。
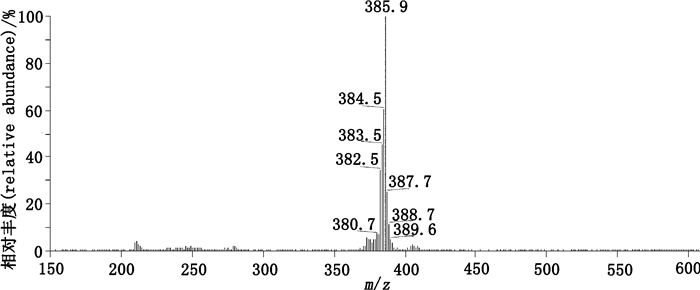
|
图 6 杂质3的质谱图 Figure 6 The MS spectrum of impurity 3 |

|
图 7 杂质3的1H-NMR图谱(A)及13C-NMR图谱(B) Figure 7 1H-NMR spectrum(A)and 13C-NMR spectrum(B)of impurity 3 |

|
图 8 杂质3的结构 Figure 8 The structure of impurity 3 |
峰4的杂质(杂质4)的质谱图见图 9(ESI-MS m/z 323.9 [M+H]+)。1H-NMR(500 MHz,CDCl3)信号(图 10-A)归属与文献[16]对比:δ 7.36(2H,d,J=8.1 Hz,H-11,13),δ 7.27(1H,dd,J=7.7、1.5 Hz,H-6),δ 7.15(1H,td,J=7.9、1.5 Hz,H-2),δ 7.04~6.93(3H,m,H-1,12,H-N),δ 6.58(1H,dd,J=8.0、0.8 Hz,H-3),δ 4.23(2H,q,J=7.1 Hz,H-15),δ 3.83(2H,s,H-7),δ 1.31(3H,t,J=7.1 Hz,H-16)。13C-NMR(125 MHz,CDCl3)信号(图 10-B)归属与文献[16]对比:δ 172.3(C-8),142.8~118.3(ArC,1~6,9~14),61.3(C-15),38.8(C-7),14.2(C-16)。确定杂质4为双氯芬酸乙酯(ethyl ester of diclofenac),化学名为乙基[2-[(2,6-二氯苯基)氨基]苯基]乙酸{ethyl [2-[(2,6-dichlorophenyl)amino]phenyl]acetate},结构式见图 11。
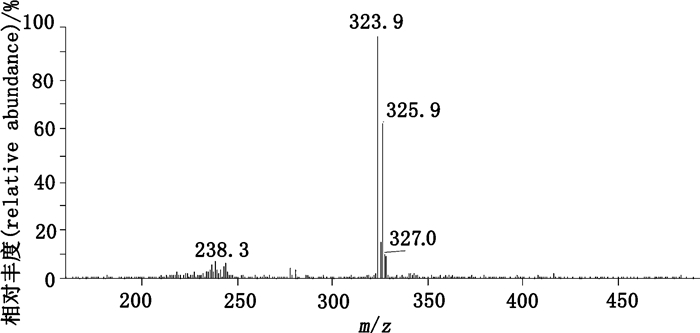
|
图 9 杂质4的质谱图 Figure 9 The MS spectrum of impurity 4 |
|
图 10 杂质4的1H-NMR图谱A及13C-NMR图谱(B) Figure 10 1H-NMR spectrum(A)and 13C-NMR spectrum(B)of impurity 4 |
|
图 11 杂质4的结构 Figure 11 The structure of impurity 4 |
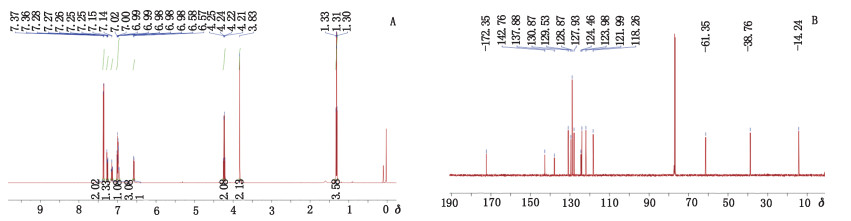
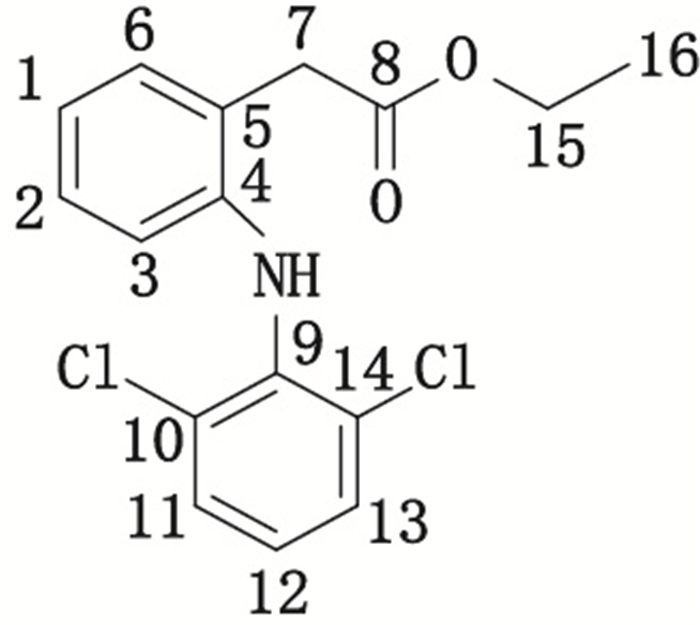
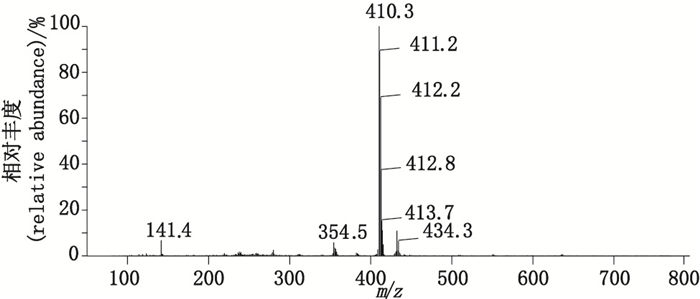
峰5的杂质(杂质5)的质谱图见图 12(ESI-MS m/z 410.3 [M+H]+)。1H-NMR(500 MHz,MeOD)信号(图 13-A)归属与文献[16]对比:δ 7.42(2H,d,J=8.1 Hz,H-11,13),δ 7.27(1H,dd,J=7.5,1.3 Hz,H-6),δ 7.19~7.06(2H,m,H-1,12),δ 6.95(1H,td,J=1.1 Hz,H-2),δ 6.44(1H,dd,J=8.0、0.8 Hz,H-3),δ 4.86(1H,s,H-N),δ 4.59(2H,s,H-15),δ 3.92(2H,s,H-7),δ 1.42(9H,s,H-18,19,20)。13C-NMR(125 MHz,CDCl3)信号(图 13-B)归属与文献[16]对比:δ 173.7(C-8),169.1(C-16),144.8~119.5(ArC,1~6,9~14),84.1(C-17),63.4(C-15),39.1(C-7),28.7(C-18,19,20)。确定杂质5为醋氯芬酸叔丁酯(benzeneacetic acid),化学名为叔丁基[[[2-[(2,6-二氯苯基)氨基]苯基]乙酰基]氧基]乙酸{tert-butyl[[[2-[(2,6-dichlorophenyl)amino]phenyl]acetyl]oxy]acetate},结构式见图 14。
|
图 12 杂质5的质谱图 Figure 12 The MS spectrum of impurity 5 |

|
图 13 杂质5的1H-NMR图谱(A)及13C-NMR图谱(B) Figure 13 1H-NMR spectrum(A)and 13C-NMR spectrum(B)of impurity 5 |

|
图 14 杂质5的结构 Figure 14 The structure of impurity 5 |
采用二极管阵列检测器对醋氯芬酸及各杂质进行全波长扫描,在本文色谱条件下,由混合对照品溶液DAD图谱结果可知,醋氯芬酸、杂质3、杂质4、杂质5的紫外光谱图相似,均在276 nm处有最大吸收,且范围较宽,杂质1和其他杂质在此波长有明显吸收,因此选择检测波长为276 nm。
3.2 梯度洗脱程序的选择《中华人民共和国药典》(简称《中国药典》)[7]中采用的梯度洗脱条件时间为60 min,耗时较长。为了提高分析效率和延长色谱柱寿命,在《中国药典》的基础上,试验了一系列的梯度程序,在和《中国药典》相同杂质都出峰的前提下将时间缩短到了35 min。选择的梯度洗脱程序为0~7 min,65%A→60%A;7~10 min,60%A→28%A;10~28 min,28%A;28~30 min,28%A→65%A;30~35 min,65%A(见图 15)。

|
1.杂质1(impurity 1)2.醋氯芬酸(aceclofenac)3.杂质3(impurity 3)4.杂质4(impurity 4)5.杂质5(impurity 5) 图 15 中国药典方法(Ⅰ)和本试验方法(Ⅱ)的样品色谱图 Figure 15 Chromatograms of sample by ChP 2015 method(Ⅰ)and the test method(Ⅱ) |
根据以上色谱条件,分别考察了不同品牌色谱柱[Kromasil 100-5-C18(4.6 mm×250 mm,5 μm)、Ultimate ODS-3(4.6 mm×250 mm,5 μm)、Agilent Extend-C18(4.6 mm×250 mm,5 μm)和Hypersil ODS2(4.6 mm×250 mm,5 μm)]、流速(0.8、1.2 mL·min-1)、柱温(20、30 ℃)、检测波长(271、281 nm)以及流动相的磷酸浓度(1.02、1.22 mg·mL-1磷酸水溶液)和及其pH(6.9、7.1),结果表明在本文选定的色谱条件下,各组分均能得到较好的分离,证明该方法耐用性较好。
4 结论本文对中试放大生产的醋氯芬酸原料药中有关物质的测定进行了研究,建立的分析方法简便、快速、灵敏,重复性好;同时对主要杂质能有效鉴别。该方法可作为醋氯芬酸原料药生产的质控方法。
| [1] |
易长英, 邓国锋, 胡进生. 醋氯芬酸治疗类风湿性关节炎和骨关节炎的临床观察[J]. 中国现代医学杂志, 2005, 15(15): 2363. YI CY, DENG GF, HU JS. Clinical observation of aceclofenac in treatment of rheumatoid arthritis(RA)and osteoarthritis(OA)[J]. China J Mod Med, 2005, 15(15): 2363. DOI:10.3969/j.issn.1005-8982.2005.15.041 |
| [2] |
袁霞, 柴克霞, 秦雅婧, 等. 醋氯芬酸对骨关节炎软骨细胞增殖和基质代谢的影响[J]. 中国生化药物杂志, 2014, 34(4): 128. YUAN X, CAI KX, QIN YJ, et al. The influence of aceclofenac to cartilage cell proliferation and substrate metabolism in osteoarthritis[J]. Chin J Biochem Pharm, 2014, 34(4): 128. |
| [3] |
刘敏, 闫占社, 罗娜. 非甾体抗炎药醋氯芬酸的临床研究进展[J]. 西北药学杂志, 2013, 28(1): 108. LIU M, YAN ZS, LUO N. An overview of the clinical research progress on aceclofenac, non-steroidal anti-inflammatory drug[J]. Northwest Pharm J, 2013, 28(1): 108. |
| [4] |
LANAS A, GARCA-RODRGUEZ LA, ARROYO MT. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxy-genase-2 inhibitors, traditional non-aspirin non-steroidal antiinflammatory drugs, aspirin and combinmions[J]. Gut, 2006, 55(12): 1731. DOI:10.1136/gut.2005.080754 |
| [5] |
李雪梅, 张利宣, 刘国强. 醋氯芬酸新制剂的研究进展[J]. 河北医药, 2009, 31(16): 2122. LI XM, ZHANG LX, LIU GQ. Research progress of new preparation of aceclofenac[J]. Hebei Med J, 2009, 31(16): 2122. DOI:10.3969/j.issn.1002-7386.2009.16.055 |
| [6] |
EP 7. 0[S]. 2013: 1306
|
| [7] |
中华人民共和国药典2015年版. 二部[S]. 2015: 1516 ChP 2015. Vol Ⅱ[S]. 2015: 1516 |
| [8] |
陆梅, 江茹, 吴小峰, 等. HPLC法测定醋氯芬酸中有关物质[J]. 药学研究, 2016, 35(2): 83. LU M, JIANG R, WU XF, et al. Determination of related substances in aceclofenac by HPLC[J]. J Pharm Res, 2016, 35(2): 83. |
| [9] |
王槐武, 黄励, 梅之南. 高效液相色谱法测定醋氯芬酸缓释片的含量[J]. 中国现代应用药学, 2001, 8(1): 53. WANG HW, HUANG L, MEI ZN. Determination of aceclofenac in extended-released tablets by HPLC[J]. Chin J Mod Appl Pharm, 2001, 8(1): 53. |
| [10] |
石宁, 秦英, 黄泓, 等. HPLC法测定醋氯芬酸片有关物质影响因素[J]. 西北药学杂志, 2003, 18(6): 247. SHI N, QIN Y, HUANG H, et al. Determination of related substances in aceclofenac tablets by HPLC[J]. Northwest Pharm J, 2003, 18(6): 247. |
| [11] |
施存元, 黄金龙. HPLC法测定醋氯芬酸缓释片有关物质[J]. 中国药学杂志, 2009, 44(16): 1276. SHI CY, HUANG JL. Determination of related substances in aceclofenac sustained-release tablets by HPLC[J]. Chin Pharm J, 2009, 44(16): 1276. DOI:10.3321/j.issn:1001-2494.2009.16.021 |
| [12] |
BBINGE JR, KUMAR RV, SINHA VR. A simple and sensitive stability-indicating RP-HPLC assay method for the determination of aceclofenac[J]. J Chromatogr Sci, 2008, 46(5): 440. DOI:10.1093/chromsci/46.5.440 |
| [13] |
程侯连. HPLC法测定贝速清片中醋氯芬酸的含量[J]. 科技情报开发与经济, 2011, 21(20): 167. CHENG HL. The determination of the content of aceclofenac in Beisuqing pills by using HPLC[J]. Sci Tech Inf Dev Econ, 2011, 21(20): 167. DOI:10.3969/j.issn.1005-6033.2011.20.070 |
| [14] |
SHAIKH KA, DEVKHILE AB. Simultaneous determination of aceclofenac, paracetamol, and chlorzoxazone by RP-HPLC in pharmaceutical dosage form[J]. J Chromatogr Sci, 2008, 46(7): 649. DOI:10.1093/chromsci/46.7.649 |
| [15] |
CHANDRA P, RATHORE AS, LOHIDASAN S, et al. Application of HPLC for the simultaneous determination of aceclofenac, paracetamol and tramadol hydrochloride in pharmaceutical dosage form[J]. Sci Pharm, 2012, 80(2): 337. DOI:10.3797/(ISSN)0036-8709 |
| [16] |
BANDGAR BP, SARANGDHAR RJ, AHAMED FA, et al. Synthesis, characterization, and biological evaluation of novel diclofenac prodrugs[J]. J Med Chem, 2011, 54(5): 1202. DOI:10.1021/jm101095e |
 2018, Vol. 38
2018, Vol. 38 
