2. 解放军军乐团卫生科, 北京 100089
2. China Clinic of the Military Band of the PLA, Beijing 100089, China
生氰糖苷(cyanogenic glycosides)简称氰苷,是植物的次生代谢产物,系由氰醇衍生物与糖缩合形成,主要包括苦杏仁苷、亚麻氰苷、百脉根苷、垂盆草苷等[1]。其中苦杏仁苷是最常见的氰苷之一,也是中药苦杏仁中的有效成分[2]。
氰苷在体内经β-葡萄糖苷酶酶解生成氢氰酸(HCN,pKa=9.7)发挥作用,微量的HCN可以缓解神经中枢,具有镇咳止喘的作用,大量的HCN则会导致细胞色素氧化酶失活,抑制细胞呼吸,最终导致呼吸麻痹死亡。人体内氰化物急性中毒剂量为0.5~3.5 mg·kg-1[3]。然而,不仅人体内存在β-葡萄糖苷酶,植物本身也存在该酶,但与氰苷分布于不同的细胞器中。仅当植物组织被破坏时,氰苷可以与内源性酶接触,从而酶解生成游离态氰化物[4],因此,氰苷类中成药在加工过程中专门设置了“杀酶保苷”的步骤[5]。若灭活不彻底,可致使中成药含有游离态氰化物,从而导致急性中毒风险。
由于氰化物属于剧毒物质,水、食品等基质中均已制定了其限量标准,2017年2月欧盟发布G/SPS/N/EU/197号通报,规定食用的杏仁制品中HCN限量为20 mg·kg-1,世界卫生组织(WHO)规定的饮用水中氰化物最高容许量是70 μg·L-1[6],美国环境保护局(USA EPA)对这一指标的限定值是200 μg·L-1[7],而我国的生活饮用水的限定值仅为50 μg·L-1[8]。目前,国内外尚未见中成药中关于游离态氰化物含量测定及限量制订的报道。本文针对氰苷类中成药,通过解决复杂基质干扰的问题,发展了表面增强拉曼光谱和顶空-气相色谱/氮磷检测2种技术,能够高效、灵敏、准确地检测中成药中游离态的氰化物,达到互为验证的效果,从而为氰苷类中成药的工艺优化及安全使用提供了技术支撑。
1 仪器、材料与试药 1.1 仪器及材料i-Raman型便携式拉曼光谱仪(B & W TEK公司);Cary 300型紫外可见分光光度计(Varian公司国);HP 7890A型气相色谱仪,配置NPD检测器(Agilent公司),MH 01-00B多功能自动进样器(GERSTEL公司),XP 205十万分之一电子天平(MettlerToledo公司),PL 203千分之一电子天平(MettlerToledo公司),MSC-100恒温振荡金属浴(Thermo公司),16M高速离心机(Spectrafuge公司),800B台式离心机(上海安亭科学仪器厂),KQ-250E超声波清洗仪(昆山市超声仪器有限公司)。
1.2 试剂氰化钠(NaCN)申领于军事医学研究院毒物药物研究所毒剂库;甲醇、乙腈(色谱纯)购自于Merck公司;实验用水为超纯水(18.2 MΩ·cm),由Mill-Q A10超纯水机(Millipore公司)制备;D- 苦杏仁苷购自TCI公司;其余试剂均为分析纯,购自于国药集团北京化学试剂公司。T品牌通宣理肺丸(批号4015108、4015417、4015321)、T品牌通宣理肺水蜜丸(批号3035187、3035188)、T品牌通宣理肺片(批号14121170、14120648、15121723)、T品牌通宣理肺口服液(批号3260210、4260074、4260065)、D品牌通宣理肺丸(批号4190039、4190043、4190046)均为市售,均处于有效期范围,于室温保存备用。
2 方法和结果 2.1 溶液制备 2.1.1 对照品储备液精确称取NaCN约10 mg,用0.01 mol·L-1氢氧化钠溶液定容至100 mL,制得质量浓度为100 mg·L-1的溶液,即得。于4 ℃冰箱保存。
2.1.2 内标溶液吸取7 μL乙腈于10 mL量瓶中,用超纯水稀释至刻度,摇匀,然后吸取200 μL于50 mL量瓶中,用超纯水定容,即得质量浓度为2.18 mg·L-1的溶液,即得。
2.1.3 供试品溶液将中成药固体样品置于研钵研磨粉粹,称取粉末1 g,加超纯水5 mL,超声(250 W,40 kHz)提取30 min,4 000 r·min-1离心10 min,移出提取液,同法提取2次,合并提取液,置于10 mL量瓶中,以超纯水定容,即得;对于中成药液体样品,无需处理,直接测定。
2.1.4 硫酸溶液(12 mol·L-1)量取50 mL超纯水于200 mL量瓶中,量取133 mL浓硫酸缓慢注入,待溶液恢复至室温后,以超纯水定容,即得。
2.1.5 D- 苦杏仁苷溶液(1 mg·L-1)称取D- 苦杏仁苷约10 mg于10 mL量瓶中,以超纯水溶解,定容,逐级稀释100倍至1 mg·L-1,即得。
2.2 SERS方法 2.2.1 在线裂解-吹扫捕集装置SERS在线裂解-吹扫捕集装置(图 1)由3只15 mL离心管组成[9],通过导管将3只离心管相连,导管与盖口处用真空泥密封。本装置分为3个部分,分别是挥发装置、吸收装置和尾气吸收装置。挥发装置中添加1 mL待测样品和4 mL硫酸溶液(12 mol·L-1),吸收装置和尾气吸收装置中均加入5 mL氢氧化钠溶液(0.1 mol·L-1)。

|
图 1 在线裂解-吹扫捕集装置示意图 Figure 1 Scheme of online lysis-purging and trapping device |
使用有孔壳层隔绝金纳米粒子(pinSHINs)[9-12]作为SERS增强基底,取该粒子1 mL,5 000 r·min-1离心5 min,除去上清液,加入200 μL待测溶液混合均匀后移入96孔酶标板中,进行SERS检测。激光功率90 mW,积分时间10 s。在拉曼位移2 135 cm-1处可观察到明显的氰根(CN-)特征峰。
2.2.3 SERS方法学建立 2.2.3.1 线性关系考察取对照品储备液适量,用0.01 mol·L-1氢氧化钠溶液稀释成质量浓度分别为2、1、0.5、0.2、0.1 mg·L-1的系列对照品溶液,经“2.2.1”项下方法处理,按“2.2.2”项下条件进行SERS测定,以峰强度Y为纵坐标,NaCN质量浓度X(μg·L-1)为横坐标,绘制标准曲线,得到回归方程:
| $ Y = 16X + 3{\rm{ }}849\;\;r = 0.9970 $ |
NaCN质量浓度在0.1~2 mg·L-1的范围内线性关系良好。
2.2.3.2 精密度试验取低、中、高3个浓度(0.1、0.5、1 mg·L-1)的对照品溶液,经“2.2.1”项下方法处理,按“2.2.2”项下条件连续测量6次,通过峰强度计算RSD。结果3个浓度对照品溶液峰强度的RSD分别为2.2%、1.2%、0.91%,表明方法精密度良好,所得数据可靠。
2.2.3.3 重复性试验取T品牌的通宣理肺丸,按“2.1.3”项下方法,平行制备6份供试品溶液,同法测定;结果CN-的含量为4.56 μg·g-1,RSD为1.6%,表明该方法重复性良好。
2.2.3.4 加样回收率试验取已测知准确含量的T品牌通宣理肺丸9份,每份约0.5 g,再分别精密加入相当于含量80%、100%、120%的对照品溶液,按“2.1.3”项下方法制成供试溶液,同法测定,计算平均加样回收率,结果见表 1,表明该法准确度良好,测定结果可靠。
|
|
表 1 SERS方法加样回收率试验结果(n=3) Table 1 Results of recovery tests by SERS |
平衡温度60 ℃,振摇5 min,振摇速率500 r·min-1,进样针温度为85 ℃,充样速度400 μL·s-1,进样速度100 μL·s-1,进样后氮气冲洗进样针2 min。
2.3.1.2 GC条件采用Agilent HP-PLOT Q色谱柱(15 m×0.32 mm×20 μm),载气为氮气,流速2.5 mL·min-1,进样口温度为220 ℃,进样体积1 000 μL,不分流进样;色谱柱初始温度30 ℃,保持1.5 min后,以35 ℃·min-1程序升温至190 ℃,保持1 min;检测器温度为320 ℃[13]。在10 mL顶空瓶中加入供试品溶液150 μL,内标溶液50 μL,50%磷酸溶液200 μL后,密封,混匀。在上述色谱条件下,HCN与乙腈(内标)分离良好,色谱图见图 2。
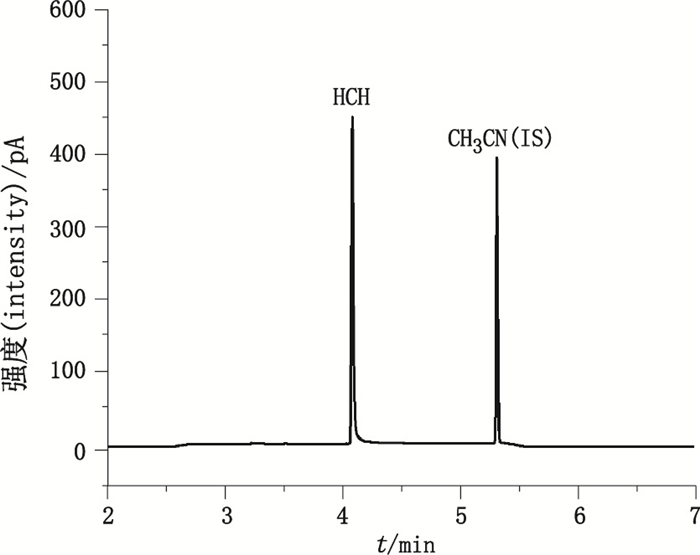
|
图 2 GC测量HCN色谱图 Figure 2 GC chromatogram of HCN |
取对照品储备液适量,用0.01 mol·L-1氢氧化钠溶液稀释成质量浓度分别为50、40、25、10、5、1、0.5、0.1、0.05、0.025 mg·L-1的系列对照品溶液;按“2.3.1”项色谱条件进样测定,以HCN与乙腈内标峰面积比值Y为纵坐标,质量浓度X(mg·L-1)为横坐标绘制标准曲线,得到回归方程:
| $ Y = 2.308X - 0.030\;\;r = 0.9979 $ |
NaCN质量浓度在0.05~50 mg·L-1的范围内线性关系良好。
2.3.2.2 精密度试验取低、中、高3个浓度(0.1、10、40 mg·L-1)的对照品溶液,按“2.3.1”项色谱条件连续进样6次,通过HCN与内标的峰面积比值计算RSD。结果3个浓度溶液的HCN与内标峰面积比值的RSD分别为1.2%、2.8%和1.6%,表明仪器精密度良好,所得数据可靠。
2.3.2.3 重复性试验取T品牌的通宣理肺丸,按“2.1.3”项下方法,平行制备6份供试品溶液,分别按“2.3.1”项色谱条件测定;结果HCN的含量为4.99 μg·g-1,RSD为2.1%,表明该方法重复性良好。
2.3.2.4 稳定性试验取T品牌的通宣理肺丸,按“2.1.3”项下方法制成供试品溶液,于0、2、4、8、24 h分别按“2.3.1”项色谱条件进行测定,计算HCN与内标的峰面积比值,结果RSD为4.5%,表明供试品溶液在24 h内稳定。
2.3.2.5 回收率试验取已知含量的T品牌通宣理肺丸9份,每份约1 g,分别精密加入低、中、高3个浓度的对照品溶液适量,制成供试溶液,按“2.3.1”项色谱条件分别测定,结果见表 2,表明该法准确度良好,测定结果可靠。
|
|
表 2 GC方法回收率结果(n=3) Table 2 Results of recovery tests by GC |
分别取低、中、高3个浓度(0.15、0.5、2.5 mg·L-1)的对照品溶液150 μL,加入顶空瓶中,分别添加内标溶液100 μL以及超纯水150 μL,混匀,即为对照样品溶液;同法,以150 μL的1 mg·L-1 D- 苦杏仁苷溶液替换超纯水获得样品溶液;模拟在线裂解-吹扫捕集前处理过程,分别添加4倍体积硫酸溶液(12 mol·L-1)后,密封,按“2.3.1”项下GC条件检测。结果见表 3。
|
|
表 3 苦杏仁苷在样品前处理过程中的稳定性(n=3) Table 3 The stability of amygdalin under sample pretreatment |
取低、中、高3个浓度(0.20、0.5、2.0 mg·L-1)的对照品溶液150 μL,加入顶空瓶中,分别添加内标溶液100 μL及超纯水150 μL,混匀,即为对照样品溶液;同法,以150 μL的1 mg·L-1 D- 苦杏仁苷溶液替换超纯水获得样品溶液;于样品溶液与对照样品溶液中分别添加50%磷酸溶液200 μL,密封,混匀,按“2.3.1”项下GC条件检测。结果见表 3。
2.4.3 在线裂解条件下苦杏仁苷降解产物鉴别比对运用HPLC-UV-MS联用系统[14]对于在线裂解条件下(详见“2.2.1”项)苦杏仁苷降解产物进行鉴定。色谱条件:采用Agilent ZORBAX SB-C18色谱柱(2.1 mm×100 mm,1.8 μm),以乙腈-10 mmol·L-1甲酸胺水溶液为流动相,梯度洗脱(0~5 min,10%乙腈;5~10 min,10%乙腈→30%乙腈;10~20 min,30%乙腈→80%乙腈;平衡6 min),流速0.2 mL·min-1,紫外检测波长210 nm,柱温25 ℃,进样量2 μL;质谱条件:ESI离子源,正离子扫描模式,雾化器压力172 kPa,干燥气流量10 L·min-1,源温350 ℃,干燥气温度350 ℃。
结果表明(图 3),D- 苦杏仁苷在体系中的降解产物主要包括L- 苦杏仁苷、野樱苷类、扁桃氰类以及苯甲醛等,随着反应时间的增加,D- 苦杏仁苷在裂解-吹扫捕集体系中除转化为L- 苦杏仁苷外,可能经历从野黑樱苷到扁桃氰,最后进一步生成苯甲醛等一系列降解过程。20 min裂解时程内,苦杏仁苷发生了降解,但大部分(91%)仍为羟基腈的形态。这进一步说明了裂解条件虽使用了强酸,但在短时程下,苦杏仁苷的降解并未对游离氰化物的测定造成干扰。
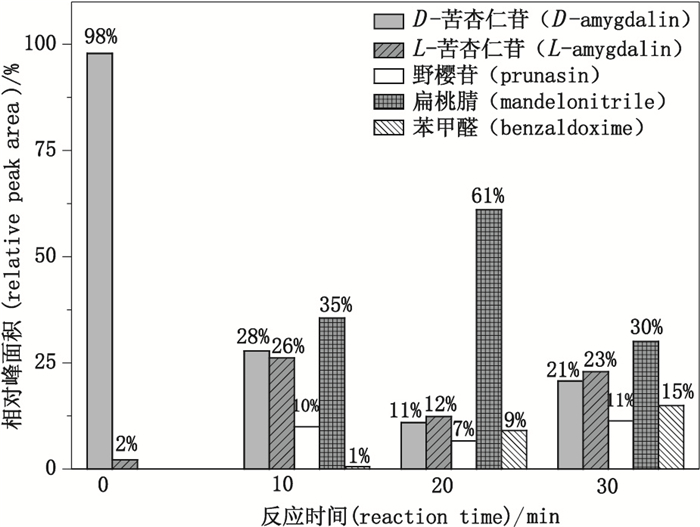
|
图 3 在线裂解-吹扫捕集条件下D- 苦杏仁苷降解产物比例变化图(峰面积归一化法) Figure 3 Variation on degradation product composition ratio of D-amygdalin by lysis-purging and trapping treatment(area normalization method) |
取不同剂型的通宣理肺方和不同厂家的通宣理肺丸,按照“2.1.3”项下方法制备各自的供试品溶液,分别用SERS和GC 2种方法进行测定;以C×V/m中成药×100%(C为HCN质量浓度,mg·L-1;V为体积,L;m为取样量,g)计算氰化物的含量(以HCN计),结果见表 4。
|
|
表 4 不同厂家通宣理肺丸(片)剂及口服液中游离氰化物的含量(n=3) Table 4 The content of free cyanide in Tongxuan Lifei from different manufacturers and formulations(pills, tablets, oral liquid) |
以pinSHINs作为基底检测水体系中的氰化物有良好的SERS响应[16],但中成药等复杂基质却对其SERS检测存在严重干扰,难以直接检测(图 4-a)。因此,本工作针对复杂基质氰化物的在线裂解-吹扫捕集前处理装置,首先用浓硫酸酸化样品,将基质中的氰化物转化为挥发性HCN气体,通过惰性气体N2将HCN气体吹扫到吸收装置中,用较高浓度的氢氧化钠溶液进行吸收[15],继而可对吸收液直接进行SERS检测(图 4-b)。该装置有效地解决了中药样品中的基质干扰问题。通过条件优化(图 4-c~g),选择20 min为在线裂解-吹扫捕集过程的吹扫时间。
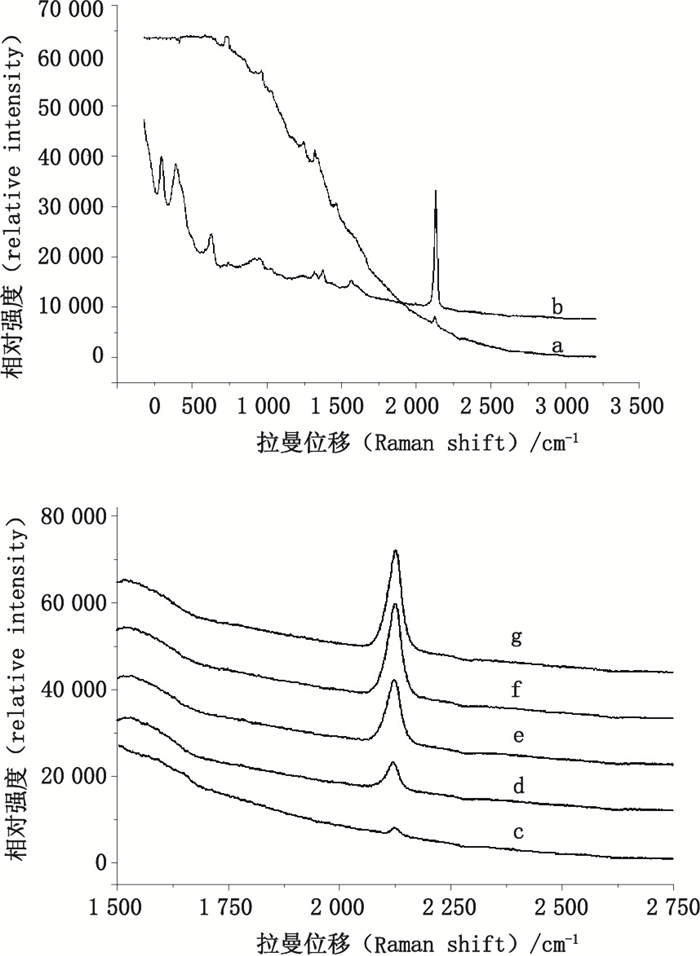
|
a.处理前(before treatment) b.处理后(after treatment) c~g.分别处理0、5、10、20、30 min(treatment for 0, 5, 10, 20, 30 min, respectively) 图 4 在线裂解-吹扫捕集装置处理前后检测氰苷类中成药提取液中氰化物 Figure 4 SERS spectra of extract of cyanide in Chinese patent medicine of cyanogenic glycosides befroe and after lysis-purging and trapping treatment |
氰苷类物质易发生降解,如在稀酸下可能水解成苷元α-羟基腈,继而分解为醛(酮)和HCN;而在浓酸作用下苷元中的氰基易氧化成羧酸并产生铵离子。因此,需要确认2种前处理过程是否会导致氰苷分解为游离氰化物,从而影响测定结果。本研究则通过添加苦杏仁苷比对测定以及在裂解条件下降解产物归属与测定,回答了这一问题。
在SERS裂解溶液中(表 3),高、中、低浓度下添加苦杏仁苷均未对游离氰化物测定结果产生干扰;另由表 1给出的SERS加样回收方法学结果可知,大蜜丸中氰苷在SERS裂解条件下,并不影响游离氰化物测定的准确性。在GC顶空溶液中,苦杏仁苷在顶空条件下对游离氰化物测定结果亦无干扰(表 3);同时由表 2给出的GC方法学中加样回收结果表明,GC顶空条件下大蜜丸中氰苷亦未影响游离氰化物测定的准确性。
本研究还采用了HPLC-UV-MS法,考察经SERS在线裂解-吹扫捕集体系制备的苦杏仁苷在不同反应时间的降解产物及稳定性。结果表明(图 3),裂解条件虽使用了强酸,但在测定时间内,苦杏仁苷的降解并未对游离氰化物的测定造成干扰。
3.3 样品测定结果分析应用SERS和顶空-GC/NPD技术,分别测定了不同厂家不同剂型的通宣理肺提取液及口服液(表 4)。结果表明,在剂型为片剂的提取液与口服液中均未检测到游离态氰化物,而在丸剂提取液中则存在游离态氰化物,且大蜜丸的含量较高。同时我们前期研究表明,相应片剂、口服液中苦杏仁苷含量远高于丸剂[17]。其原因可能在于丸剂制法工艺较为简单,在加工过程中未能使中药材中的酶完全灭活,从而可能导致在口服或提取药物时,中成药中的氰苷在自身酶的作用下,快速释放包括HCN在内的游离态氰化物,并导致自身氰苷含量的降低。以D品牌的通宣理肺丸为例,按照GC的结果计算,其丸剂中HCN含量相当于14.1 mg·kg-1。尽管该结果低于欧盟最新发布的食品中HCN限量标准20 mg·kg-1(G/SPS/N/EU/197号通报),但考虑到该药建议最大服用剂量为每次12 g,则每次摄入HCN 0.18 mg,且中成药一般服用周期较长,其长期低剂量毒性效应不容忽视。
4 结论本文通过SERS和顶空-GC/NPD 2种方法实现了中成药中游离态氰化物的快速准确检测,2种方法检测结果基本相符。SERS方法具有高特异性,高灵敏度,简单快速等特点,尤其是部分SERS检测设备便于携带,在现场检测中具有明显优势;而顶空-GC/NPD方法操作简单,定量准确,专属性强,结果稳定可靠。本研究建立的2种检测方法通过适当的裂解酸化处理,实现了对氰苷类中成药提取液中的游离态氰化物的检测,为复杂基质中氰化物的测定提供了科学依据。同时为相关中成药产品的质量控制和工艺优化提供依据。
| [1] |
VETTER J. Plant cyanogenic glycosides[J]. Toxicon, 2000, 38(1): 11. DOI:10.1016/S0041-0101(99)00128-2 |
| [2] |
中华人民共和国药典2015年版. 一部[S]. 2015: 201 ChP 2015. Vol Ⅰ[S]. 2015: 201 |
| [3] |
Joint FAO, World Health Organization, WHO Expert Committee on Food Additives. Safety Evaluation of Certain Food Additives and Contaminants: Prepared by the Seventy Fourth Meeting of the Joint FAO[R/OL]. 2012: 299[2015-11-19]. http://apps.who.int/iris/bitstream/10665/44813/1/9789241660655_eng.pdf?ua=1
|
| [4] |
GLEADOW RM, MøLLER BL. Cyanogenic glycosides:synthesis, physiology, and phenotypic plasticity[J]. Annu Rev Plant Biol, 2014, 65: 155. DOI:10.1146/annurev-arplant-050213-040027 |
| [5] |
陈俊怡, 贾天柱. 对苦杏仁燀炒炮制意义的商榷[J]. 亚太传统医药, 2012, 8(6): 48. CHEN JY, JIA TZ. Discuss the significance of processing bitter almond with frying-cooking[J]. Asia Pac Tradit Med, 2012, 8(6): 48. |
| [6] |
World Health Organization. Guidelines for Drinking-water Quality World Health Organization. Distribution and Sales Geneva[EB/OL]. 2004: 27[2016-07-06]. http://apps.who.int/iris/bitstream/handle/10665/42852/9241546387.pdf?sequence=1&isAllowed=y&ua=1
|
| [7] |
USEPA M. Methods for Chemical Analysis of Water and Wastes[EB/OL]. Environmental Monitoring and Support Laboratory Cincinnati, OH, USA: 1983[2016-07-06]. https://www.wbdg.org/FFC/EPA/EPACRIT/epa600_4_79_020.pdf
|
| [8] |
GB 5749-2006中华人民共和国国家标准生活饮用水卫生标准: 城镇供水[S]. 2006 GB 5749-2006 The State Standard of the People's Republic of China: the Standard for Drinking Water Quality[S]. 2006 |
| [9] |
FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature, 1973, 241(105): 20. |
| [10] |
HAISS W, THANH NT, AVEYARD J, et al. Determination of size and concentration of gold nanoparticles from UV-vis spectra[J]. Anal Chem, 2007, 79(11): 4215. DOI:10.1021/ac0702084 |
| [11] |
高敬, 吴剑峰, 高海月, 等. 基于有孔壳层隔绝纳米粒子增强拉曼光谱的芥子气现场检测新方法[J]. 分析化学, 2014, 42(10): 1465. GAO J, WU JF, GAO HY, et al. On-site detection of sulfur maustard based on pinholeshell-isolated nanoparticle-enhanced Raman spectroscopy[J]. Chin J Anal Chem, 2014, 42(10): 1465. DOI:10.11895/j.issn.0253-3820.140415 |
| [12] |
朱颖洁, 郭磊, 刘易, 等. 基于壳层隔绝纳米粒子和在线裂解-吹扫捕集的血液氰化物表面增强拉曼光谱快速检测方法[J]. 分析化学, 2017, 45(5): 627. ZHU YJ, GUO L, LIU Y, et al. Rapid surface-enhanced Raman spectroscopic detection of blood cyanide based on pinhole shell-isolated nanoparticle and online lysis-purging and trapping approach[J]. Chin J Anal Chem, 2017, 45(5): 627. |
| [13] |
CALAFAT AM, STANFILL SB. Rapid quantitation of cyanide in whole blood by automated headspace gas chromatography[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2002, 772(1): 131. DOI:10.1016/S1570-0232(02)00067-3 |
| [14] |
FILIPE O, MOTA N, SANTOS S, et al. Identification and characterization of photodegradation products of metoprolol in the presence of natural fulvic acid by HPLC-UV-MSn[J]. J Hazard Mater, 2017, 323(Pt A): 250. |
| [15] |
GAO J, GUO L, WU JF, et al. Simple and sensitive detection of cyanide using pinhole shell-isolated nanoparticle-enhanced Raman spectroscopy[J]. J Raman Spectrosc, 2014, 45(8): 619. DOI:10.1002/jrs.v45.8 |
| [16] |
LUNDQUIST P, ROSLING H, SÖRBO B. Determination of cyanide in whole blood, erythrocytes, and plasma[J]. Clin Chem, 1985, 31(4): 591. |
| [17] |
刘易, 龚莹, 郭磊, 等. 中成药中氰苷及其差向异构体的成分分析[J]. 药物分析杂志, 2016, 36(6): 1011. LIU Y, GONG Y, GUO L, et al. Determination of cyanogenic glycoside and its epimerization in Chinese patent medicine[J]. Chin J Pharm Anal, 2016, 36(6): 1011. |
 2018, Vol. 38
2018, Vol. 38 
