2. 青岛大学附属医院药学部, 青岛 266003
2. Department of Pharmacy, The Affiliated Hospital of Qingdao University, Qingdao 266003, China
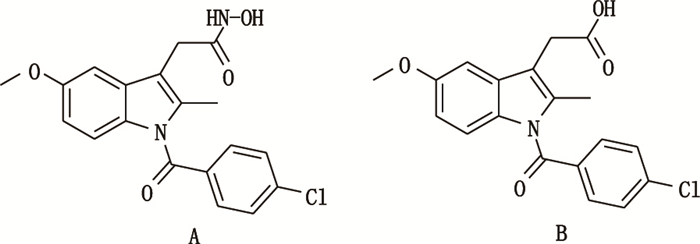
组蛋白去乙酰化酶(histone deacetylase,HDAC)在肿瘤发生和发展的多个环节中扮演着非常重要的角色,如肿瘤抑癌基因沉默,细胞分化,血管生成,细胞迁移,细胞周期异常,信号传导及细胞附着等[1-3]。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACIs)可以靶向组蛋白去乙酰化酶调控组蛋白的乙酰化,进而调控关键的抑制肿瘤蛋白和原癌基因,是极具潜力的抗肿瘤药物[4-7]。奥沙美辛(图 1-A)为羟肟酸基团引入到吲哚美辛中合成得到的新型吲哚类化合物,对HDAC 2和HDAC 3均有较强的抑制作用[8],与新型组蛋白去乙酰化酶抑制剂伏立诺他(vorinostat,SAHA)相当[9-11],有望开发为抗肿瘤新药。
|
图 1 奥沙美辛(A)及吲哚美辛(B,内标)的结构式 Figure 1 Chemical structures of oxametacin (A) and indomethacin(B, internal standard) |
目前尚无关于奥沙美辛的体内分析方法和药动学研究报道。为了考察奥沙美辛在体内的药代动力学情况,本文以与奥沙美辛具有类似结构和质谱特征的吲哚美辛(图 1-B)作为内标,建立了LC-MS/MS法测定其在大鼠血浆中的浓度,并研究奥沙美辛在大鼠体内的药动学行为。
1 仪器与材料 1.1 仪器API 4000+三重四极杆串联质谱系统,Analyst 1.6.3质谱数据处理软件(AB公司);Agilent 1290Ⅱ高效液相色谱仪(配备G7120泵,G7167B进样器,G7116B柱温箱,Agilent公司);Centrifuge 5418型离心机(Eppendorf公司);DT5-6B低速离心机(北京时代北利离心机有限公司);BF-2000氮气吹干仪(北京八方世纪有限公司);Model 420A酸度计(Orion公司);超纯水机(Millipore公司)。
1.2 药品与试剂奥沙美辛由青岛大学药学院药物化学教研室提供(批号20160309,纯度98%);吲哚美辛,内标,批号为100258-200403,购于中国食品药品检定研究院;色谱纯乙腈、甲醇和甲酸购于Tedia公司,色谱纯甲基叔丁基醚购于ACS公司,其余试剂均为分析纯,购于烟台远东精细化工有限公司。
1.3 大鼠Wistar大鼠,雄性,体质量260~280 g,由青岛派特福德白鼠养殖专业合作社提供,实验动物许可证号为SCXK(鲁)20080002。本实验经青岛大学附属医院伦理委员会批准开展。
2 方法与结果 2.1 色谱条件色谱柱:Agilent ZORBAX SB-C18(2.1 mm×100 mm,3.5 µm);流动相:甲醇-水-甲酸(70:30:0.1);流速:0.3 mL·min-1;柱温:40 ℃;进样量:10 µL。
2.2 质谱条件选用电喷雾(ESI)离子源,在负离子电离模式下,采用多反应监测(MRM)的质谱扫描方式,测定奥沙美辛和内标的检测离子分别为m/z371.0→338.0和m/z 356.0→311.8,去簇电压(DP)分别53和43 V,碰撞能量(CE)分别为24和12 V;碰撞气(CAD)6×104 Pa,气帘气(CUR)2×105 Pa,雾化气(Gas 1)4.48×105 Pa,辅助气(Gas 2) 4.48×105 Pa,喷雾电压(IS) 4 500 V,雾化温度(TEM)550 ℃。
2.3 标准曲线用血浆样品与质控样品配制奥沙美辛母液(1 mg·mL-1)由甲醇配制,于-20 ℃储存;将母液用甲醇稀释得到质量浓度分别约为10 000.0、5 000.0、2 000.0、500.0、200.0、50.0、20.0 ng·mL-1的系列溶液。取上述系列溶液0.1 mL于玻璃试管中,45 ℃氮气吹干溶剂,加入空白血浆1.0 mL,涡旋混合30 s,得到相当于血浆中奥沙美辛质量浓度为1 000.0、500.0、200.0、50.0、20.0、5.0、2.0 ng·mL-1的标准曲线用血浆样品。如上述方法另行配制相当于血浆中奥沙美辛质量浓度为500.0、50.0和5.0 ng·mL-1的血浆样品作为质控样品。
2.4 血浆样品预处理取血浆样品100 μL于EP管中,加入内标溶液(500 ng·mL-1,溶于50%甲醇)50 μL,涡旋混合30 s,然后加入甲基叔丁基醚(含0.5%的甲酸)3 mL,涡旋混合2 min,2 000×g离心5 min,取上清液移入另一尖底玻璃离心试管,45 ℃氮气吹干,残渣用0.1 mL甲醇-水(50:50,v/v)溶解,涡旋混合1 min,2 000×g离心10 min,取上清液即得供试溶液。
2.5 方法学验证按照生物样品测定的要求对上述方法的专属性、线性、精密度、提取回收率、稳定性等进行考察。
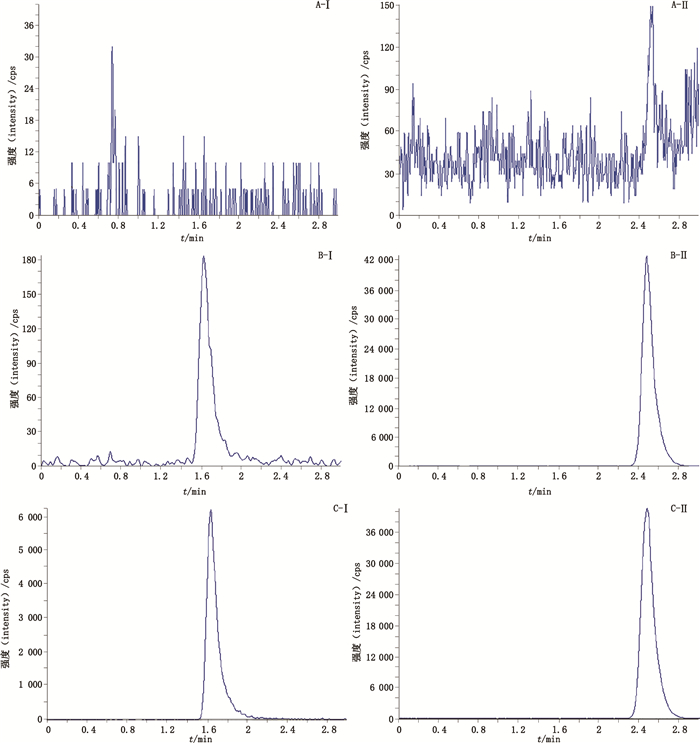
2.5.1 专属性取空白血浆100 μL,按“2.4”项下方法进行预处理,按“2.1”和“2.2”项下条件进样测定。空白血浆样品、最低定量限处空白血浆样品+奥沙美辛和内标及大鼠灌胃奥沙美辛(10 mg·kg-1)0.5 h后的色谱图见图 2。由图可见,奥沙美辛和内标的保留时间分别为1.7 min和2.5 min,在此保留时间下空白血浆无色谱峰,即空白血浆中的杂质不干扰奥沙美辛的测定。
|
图 2 空白血浆样品(A)、最低定量限处空白血浆样品+奥沙美辛和内标(B)及大鼠灌胃奥沙美辛(10 mg·kg-1)0.5 h后(C)奥沙美辛(Ⅰ)和吲哚美辛(Ⅱ)的色谱图 Figure 2 MRM chromatograms of oxametacin(Ⅰ) and indomethacin(Ⅱ) in blank plasma sample(A), blank plasma sample spiked with oxametacin and internal standard at the lower limit of quantification(B), and plasma sample from a rat at 0.5 h after intragastric administration of oxametacin at a dose of 10 mg·kg-1(C) |
按“2.3”项下方法制得奥沙美辛质量浓度分别为2.0、5.0、20.0、50.0、200.0、500.0、1 000.0 ng·mL-1的标准曲线用血浆样品,按“2.4”项下方法进行预处理,按“2.2”和“2.3”项下条件进样测定,以奥沙美辛质量浓度(X)为横坐标,奥沙美辛峰面积与内标峰面积的比值(Y)为纵坐标,进行线性回归。
奥沙美辛质量浓度为2.0~1 000 ng·mL-1范围内线性关系良好,权重1/X2,典型的回归方程:
| $ \mathit{Y}{\rm{ = 3}}{\rm{.01 \times 1}}{{\rm{0}}^{{\rm{ - 3}}}}\mathit{X}{\rm{ + 1}}{\rm{.10 \times 1}}{{\rm{0}}^{{\rm{ - 3}}}}\;\;\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{1}} $ |
方法的检测下限(S/N=3)为0.5 ng·mL-1,定量下限为2.0 ng·mL-1。
2.5.3 残留效应残留效应是在分析标准曲线用最高浓度的血浆样品后,再分析空白血浆样品,残留的分析物不能影响检测的精密度和准确度。结果表明,待测物残留的峰面积小于最低定量限的20%,内标的残留峰面积小于内标峰面积的5%,符合生物样品定量分析方法验证指导原则要求[12]。
2.5.4 准确度与精密度试验按“2.3”项下方法制备低、中、高质量浓度(5.0、50.0和500.0 ng·mL-1)的奥沙美辛质控样品,按“2.4”项下方法进行预处理,再按“2.1”和“2.2”项下条件进样测定,连续测定5次计算日内精密度以及准确度,再连续测定5 d计算日间精密度。结果见表 1。
|
|
表 1 准确度和精密度试验结果(n=5) Table 1 Results of accuracy and precision tests |
结果日内和日间精密度试验的RSD分别小于9.8%和11.2%,准确度试验的RE小于8.4%,符合测定生物样品对精密度的要求。
2.5.5 提取回收率和基质效应按“2.3”项下方法制备低、中、高质量浓度(5.0、50.0和500.0 ng·mL-1)奥沙美辛的质控样品,按“2.4”项下条件进行预处理,再按“2.1”和“2.2”项下条件进样测定,该组峰面积结果为A;将空白血浆按“2.4”项下方法进行预处理(但不加内标),氮气吹干后分别加入低、中、高质量浓度(5.0、50.0和500.0 ng·mL-1)奥沙美辛溶液和内标,再按“2.1”和“2.2”项下条件进样测定,该组峰面积结果为B;将质量浓度分别为5.0、50.0和500.0 ng·mL-1的奥沙美辛溶液按“2.1”和“2.2”项下条件进样测定,峰面积结果为C。A/B×100%为提取回收率,B/C×100%为基质效应。每个浓度重复测定5次,计算平均提取回收率和基质效应。
奥沙美辛在血浆中质量浓度为5.0、50.0和500.0 ng·mL-1时的提取回收率±SD(n=5)分别为(86.4±5.7)%、(88.2±3.9)%和(89.5±4.7)%,内标的提取回收率±SD(n=5)为(90.1±3.3)%;奥沙美辛的基质效应(±SD,n=5)分别为(92.5±6.8)%、(95.8±2.8)%和(98.7±4.1)%,内标的基质效应(±SD,n=5)为(94.4±5.0)%。结果表明,奥沙美辛和内标的提取回收率均较高且稳定,基质效应很小,符合要求。
2.5.6 稳定性试验取奥沙美辛质量浓度为5.0、50.0和500.0 ng·mL-1的低、中、高浓度质控样品,室温放置12 h,按“2.4”项下方法预处理,进样测定峰面积,考察室温放置稳定性;在-20 ℃冰箱放置30 d,按“2.4”项下方法预处理,进样测定峰面积,考察低温长期放置的稳定性;将质控样品-20 ℃冷冻-室温融化,按“2.4”项下方法预处理,进样测定峰面积,重复3次,考察冻融稳定性;将“2.3”项下预处理后的供试溶液室温放置24 h后注入高效液相色谱仪,测定峰面积,考察预处理后供试溶液的稳定性。以上每个浓度重复测定5次,计算平均值和RSD。
结果,上述低、中、高浓度质控样品室温放置12 h时的RSD均小于9.4%,-20 ℃放置30 d的RSD均小于5.3%,-20 ℃冷冻-室温融化循环3次的RSD均小于10.3%,预处理后的供试溶液室温放置24 h的RSD均小于3.9%。稳定性试验结果表明样品在储存、预处理及待检测过程均能保持稳定。
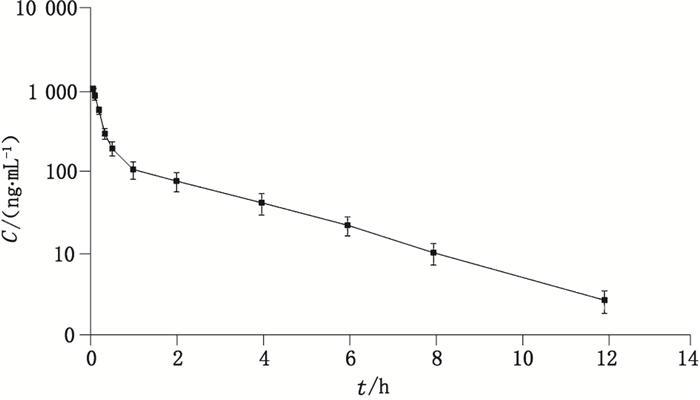
2.6 奥沙美辛药动学研究雄性Wistar大鼠24只,按体重随机分为4组,每组6只。饲养于标准鼠笼中,保持室温(25±1) ℃,相对湿度为60%,自由进食标准数量及饮水,并于实验前12 h禁食,但自由饮水,动物在实验期间自由饮水并于给药后2 h自由进食标准鼠粮。3组大鼠灌胃给药奥沙美辛,剂量分别为5、10和20 mg·kg-1(奥沙美辛混悬于0.5% CMC-Na溶液),给药后0.5、0.75、1、1.5、2、3、4、6、8、12和24 h取血约250 µL于肝素抗凝的试管中,2 000×g分离血浆,置于-20 ℃待测。另一组大鼠静脉注射奥沙美辛,剂量为1 mg·kg-1(奥沙美辛溶解于0.5%吐温80中),给药后0.05、0.1、0.2、0.33、0.5、1、2、4、6、8和12 h取血约250 µL于肝素抗凝的试管中,2 000×g分离血浆,置于-20 ℃待测。按“2.4”项下方法进样预处理,再按“2.1”和“2.2”项下条件进样测定。采用DAS 2.0分析软件(中国药理学会),利用非隔室模型计算给药后的药物代谢动力学参数。药时曲线结果见图 3和图 4,药动学参数见表 2。

|
图 3 大鼠灌胃奥沙美辛5 mg·kg-1(a)、10 mg·kg-1(b)和20 mg·kg-1(c)后的药-时曲线(n=6) Figure 3 Plasma concentration-time curves of oxametacin after intragastric administration of oxametacin suspension to rats at a doses of 5 mg·kg-1(a), 10 mg·kg-1(b) and 20 mg·kg-1(c), respectively |
|
图 4 大鼠静注奥沙美辛1 mg·kg-1后的药-时曲线(n=6) Figure 4 Plasma concentration-time curve of oxametacin after intravenous administration of oxametacin to rats at a dose of 1 mg·kg-1 |
|
|
表 2 大鼠灌胃和静注奥沙美辛的药动学参数(n=6) Table 2 Pharmacokinetic parameters of oxametacin after intragastric and intravenous administration of oxametacin to rats |
由以上结果可以看出,奥沙美辛在大鼠体内吸收较快,但是吸收很差,灌胃3个剂量下,峰浓度与AUC均与剂量呈正比,无明显的剂量依赖性。
3 讨论由于奥沙美辛在大鼠血浆中的浓度较低,为了避免稀释样本,没有采用甲醇或乙腈蛋白沉淀的方法,而是直接比较了高氯酸沉淀蛋白法和液液萃取法。结果表明,高氯酸沉淀蛋白造成待测药物的降解,液液萃取法的提取率较高。比较乙酸乙酯、乙醚和甲基叔丁基醚的提取回收率,甲基叔丁基醚的提取回收率最高而且加入少量酸会提高提取回收率,最终确定3 mL的甲基叔丁基醚(含0.5%的甲酸)可以得到高且稳定的提取回收率。
动物体内药动学实验的结果可以为后期研究的给药途径、剂量、间隔提供参考。虽然口服是首选的途径,但是大鼠灌胃不同奥沙美辛后血中药物浓度均较低,绝对生物利用度不足10%,这提示在动物体内活性研究时宜采用非肠道的给药方式。虽然奥沙美辛在大鼠体内的半衰期也较短,只有约2 h,但是比5-氟尿嘧啶(5-FU)和依托泊苷等抗肿瘤药物长[14-15],所以奥沙美辛也是可以继续开发的,必要时也可以进一步考虑采用制剂手段提高该药物的吸收或者延长药物的消除。
综上,本研究建立一种快速、灵敏、准确的方法测定血浆中奥沙美辛的浓度,可以满足药代动力学研究的需要。
| [1] |
ROPREO S, FRAGA MF, BALLESTAR E, et al. A truncating mutation of HDAC2 in human cancers confers resistance to histone deacetylase inhibition[J]. Nat Genet, 2006, 38(5): 566. DOI:10.1038/ng1773 |
| [2] |
CRESS WD, SETO E. Histone deacetylases, transcriptional control, and cancer[J]. J Cell Physiol, 2000, 184(1): 1. DOI:10.1002/(ISSN)1097-4652 |
| [3] |
LI Z, ZHU WG. Targeting histone deacetylases for cancer therapy:from molecular mechanisms to clinical implications[J]. Int J Biol Sci, 2014, 10(7): 757. DOI:10.7150/ijbs.9067 |
| [4] |
XU WS, PARMIGIANI RB, MARKS PA. Histone deacetylase inhibitors:molecular mechanisms of action[J]. Oncogene, 2007, 26(37): 5541. DOI:10.1038/sj.onc.1210620 |
| [5] |
MARKS PA. The clinical development of histone deacetylase inhibitors as targeted anticancer drugs[J]. Expert Opin Investig Drugs, 2010, 19(9): 1049. DOI:10.1517/13543784.2010.510514 |
| [6] |
KHAN O, LA THANGUE NB. HDAC inhibitors in cancer biology:emerging mechanisms and clinical applications[J]. Immunol Cell Biol, 2012, 90(1): 85. DOI:10.1038/icb.2011.100 |
| [7] |
WAGNER JM, HACKANSON B, LUBBERT M, et al. Histone deacetylase (HDAC) inhibitors in recent clinical trials for cancer therapy[J]. Clin Epigenetics, 2010, 1(3/4): 117. |
| [8] |
JING FB, ZHANG L, LUAN YP, et al. Molecular simulation and activity studies of oxametacin as an HDAC inhibitor[J]. Lett Drug Des Discov, 2017, 14(6): 1277. |
| [9] |
KELLY WK, MARKS PA. Drug insight:histone deacetylase inhibitors development of the new targeted anticancer agent suberoylanilide hydroxamic acid[J]. Nat Clin Pract Oncol, 2005, 2(3): 150. DOI:10.1038/ncponc0106 |
| [10] |
LING Y, GUO J, YANG Q, et al. Development of novel beta-carboline-based hydroxamate derivatives as HDAC inhibitors with antiproliferative and antimetastatic activities in human cancer cells[J]. Eur J Med Chem, 2018, 14(4): 398. |
| [11] |
WOZNIAK MB, VILLUENDAS R, BISCHOFF JR, et al. Vorinostat interferes with the signaling transduction pathway of T-cell receptor and synergizes with phosphoinositide-3 kinase inhibitors in cutaneous T-cell lymphoma[J]. Haematologica, 2010, 95(4): 613. DOI:10.3324/haematol.2009.013870 |
| [12] |
中华人民共和国药典2015年版. 四部[S]. 2015: 363 ChP 2015. Vol Ⅳ[S]. 2015: 363 |
| [13] |
钟大放, 李高, 刘昌孝. 生物样品定量分析方法指导原则(草案)[J]. 药物评价研究, 2011, 34(6): 409. ZHONG DF, LI G, LIU CX. Guidance on bioanalysis:method validation and analysis of study samples(draft)[J]. Drug Eval Res, 2011, 34(6): 409. |
| [14] |
张菁菁, 李琳, 左代英, 等. 微透析结合HPLC-UV法研究5-氟尿嘧啶在大鼠血中的药动学[J]. 沈阳药科大学学报, 2014, 31(9): 721. ZHANG JJ, LI L, ZUO DY, et al. Pharmacokinetic analysis of 5-fluorouracil in rats using microdialysis coupled with high-performance liquid chromatography and ultraviolet detector[J]. J Shenyang Pharm Univ, 2014, 31(9): 721. |
| [15] |
李津明, 车环宇, 李鑫, 等. 隐形依托泊苷脂质体在大鼠体内的药动学及组织分布[J]. 中国新药杂志, 2009, 18(23): 2269. LI JM, CHE HY, LI X, et al. Pharmacokinetics and tissue distribution of stealth etoposide liposomes in rats[J]. Chin J New Drugs, 2009, 18(23): 2269. DOI:10.3321/j.issn:1003-3734.2009.23.019 |
 2018, Vol. 38
2018, Vol. 38 
