黄芩为唇形科黄芩属植物黄芩Scutellaria baicalensis Georgi的干燥根,是我国的传统常用中药,始载于《神农本草经》,列为中品[1]。其性味苦寒,具有清热燥湿、泻火解毒、止血、安胎的功效,主要用于湿热痞满、泻痢、黄疸、肺热咳嗽、痈肿疮毒、胎动不安等病症的治疗[2]。黄芩药材临床用量较大,为了满足需求,国内已大量栽培,主要分布于黑龙江、吉林、辽宁、河北、山东、山西、陕西、甘肃等地[3],其地上茎叶未被有效利用而废弃,造成大量资源浪费及环境污染。
黄芩茎叶在我国北方各省及云南部分地区作为一种茶叶饮用,被称为黄芩茶、黄金茶等,其民间应用已有千年的历史,具有清热燥湿,泻火解毒,消炎、促消化等功效[4-5]。现代研究证实,黄芩茎叶中主要含有黄酮类、有机酸类、二萜类、挥发油类、多糖类、无机元素以及氨基酸类资源性化学成分[6-8]。黄芩茎叶总黄酮类成分具有降血压,降血脂,改善记忆,抗肿瘤等多种药理活性,极具药用价值[9]。氨基酸是组成蛋白质的基本单位,近年来,越来越多的研究证实,人体内的某些氨基酸不仅为蛋白质合成的底物原料和人体生长发育必不可少的营养物质,也是神经递质、卟啉类化合物、聚胺类化合物合成的前提[10]。目前,黄芩茎叶中氨基酸的种类与含量鲜有报道,各类氨基酸与黄芩茎叶功效的关系尚不明确。因此,本文采用UPLC-TQ-MS技术分析不同产地黄芩茎叶中18种氨基酸类资源性化学成分,以期为黄芩茎叶功效物质基础及黄芩茎叶资源价值发现与开发利用提供科学依据,实现黄芩资源的经济增长与生态、环境效益相统一[11-12]。
1 仪器与材料 1.1 仪器Waters ACQUITY UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器;Waters公司,Milford,USA),Xevo TQ检测器(Waters公司);MassLynxTM质谱工作站软件(Waters公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Sartorius BT125D电子分析天平(塞多利斯公司);Milli-Q超纯水制备仪(Milli-pore公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);Anke GL-16GII型离心机(上海安亭科学仪器厂)。
1.2 材料对照品苯丙氨酸(Phe,批号20090316)、谷氨酸(Glu,批号20090310)、异亮氨酸(Ile,批号20080219)、亮氨酸(Leu,批号20080216)、瓜氨酸(Cit,批号20080218)、缬氨酸(Val,批号20090318)、丙氨酸(Ala,批号20090316)、苏氨酸(Thr,批号20080616)、丝氨酸(Ser,批号20080219)、精氨酸(Arg,批号20090318)、赖氨酸(Lys,批号20090316)、羟脯氨酸(Hpro,批号20090315)均购自中国惠兴生化试剂有限公司,脯氨酸(Pro,批号1349920V)、谷氨酰胺(Gln,批号BCBC6452V)、天冬酰胺(Asn,批号021M5416V)、鸟氨酸盐酸盐(Orn,批号031M1459V)、γ-氨基丁酸(GABA,批号BCBA3661V)均购自Sigma公司,甲硫氨酸(Met,批号F20080927)购自国药集团化学试剂有限公司,供含量测定用,纯度均大于98%。乙腈(TEDIA公司)及甲酸(ACS公司)均为色谱纯;甲酸铵、乙酸铵(南化公司)均为分析纯;超纯水由Milli-Q纯水机制备。
35批黄芩茎叶样品,其详细信息见表 1。植物基原经南京中医药大学段金廒教授鉴定为唇形科黄芩属植物黄芩Scutellaria baicalensis Georgi的地上茎叶。所得样品分别于热风(50 ℃)条件下进行烘干,干燥至恒定质量后粉碎成粗粉,过40目筛,常温密封干燥保存备用。
|
|
表 1 35批不同产地样品信息 Table 1 35 batches of samples from different habitats |
精密称取干燥至恒重的各氨基酸对照品适量,加10%甲醇制成质量浓度分别为GABA 1.005 mg·mL-1,Phe 1.025 mg·mL-1,Leu 1.005 mg·mL-1,Ile 1.055 mg·mL-1,Met 1.030 mg·mL-1,Val 1.015 mg·mL-1,Pro 1.060 mg·mL-1,Ala 1.045 mg·mL-1,Hpro 1.055 mg·mL-1,Thr 1.020 mg·mL-1,Glu 1.040 mg·mL-1,Lys 1.050 mg·mL-1,Gln 1.035 mg·mL-1,Ser 1.055 mg·mL-1,Asn 1.065 mg·mL-1,Cit 1.075 mg·mL-1,Arg 1.045 mg·mL-1,Orn 1.020 mg·mL-1的混合对照品储备液(在4 ℃条件下贮藏)。取不同体积的上述储备液稀释后,制成系列浓度的混合对照品溶液,进行线性关系考察。
2.1.2 供试品溶液取各样品粉末约1 g,精密称定,置于100 mL具塞锥形瓶中,精密加入水50 mL,称量,静置1 h后,超声(250 W,40 kHz)提取30 min,称量,加水补足减失的量,摇匀,13 000 r·min-1,离心10 min,取上清液,经0.22 μm的滤膜滤过,即得。
2.2 色谱-质谱条件 2.2.1 色谱分析条件色谱柱:ACQUITY UPLC BEHAmide色谱柱(100 mm×2.1 mm,1.7 μm);流动相:A相为5 mmol·L-1甲酸铵、5 mmol·L-1乙酸铵、0.2%甲酸水溶液,B相为1 mmol·L-1甲酸铵、1 mmol·L-1乙酸铵、0.2%甲酸乙腈溶液,梯度洗脱(0~3 min,10%A;3~9 min,10%A→18%A;9~15 min,18%A→20%A;15~16 min,20%A→46%A;16~18 mn,46%A);流速:0.4 mL·min-1;柱温35 ℃;进样量:2 μL。
2.2.2 质谱检测条件离子化模式:ESI+/ESI-;检测方式:多反应检测(MRM);毛细管电压:3.0 kV;离子源温度:120 ℃;脱溶剂气流量和温度:1 000 L·h-1和550 ℃;碰撞、锥孔气流量:0.15 mL·min-1、20 L·h-1;取样锥孔电压:4 V;碰撞能量:18 eV。各化合物具体质谱检测条件见表 2。
|
|
表 2 质谱检测参数 Table 2 Precusor/product ion pairs and parameters for SIM/MRM |
在上述色谱和质谱条件下所测各成分MRM色谱图见图 1。
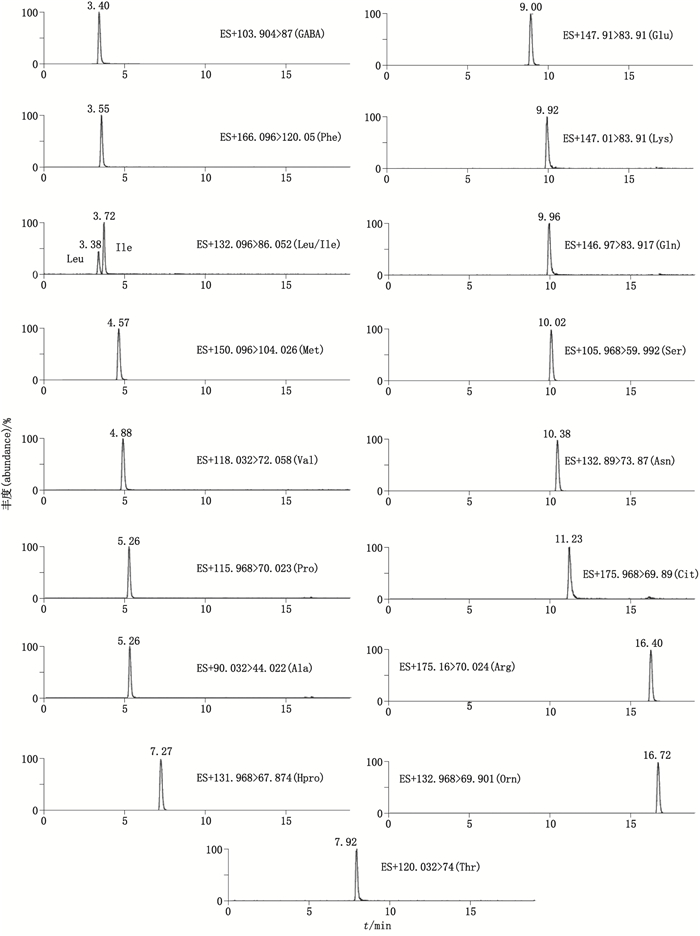
|
图 1 氨基酸类UPLC-MS/MS(MRM)色谱图 Figure 1 UPLC-MS/MS(MRM)chromatograms of 18 amino acids |
分别精密吸取“2.1.1”项下制备的系列混合对照品溶液,按照“2.2”项下条件进样测定,以对照品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,进行线性回归,结果见表 3。精密吸取混合对照品溶液适量,10%甲醇逐级稀释,进样测定;以S/N=3计算检测下限(LOD),以S/N=10计算定量下限(LOQ),结果见表 3。
|
|
表 3 线性关系考察及检测下限及定量下限测定的结果 Table 3 The investigation of the linear relationship and determination of LOD and LOQ |
取混合对照品溶液(GABA 20.1 μg·mL-1,Phe 20.5 μg·mL-1,Leu 20.1 μg·mL-1,Ile 21.1 μg·mL-1,Met 10.9 μg·mL-1,Val 20.3 μg·mL-1,Pro 21.2 μg·mL-1,Ala 20.9 μg·mL-1,Hpro 21.1 μg·mL-1,Thr 20.4 μg·mL-1,Glu 20.8 μg·mL-1,Lys 21.0 μg·mL-1,Gln 20.7 μg·mL-1,Ser 21.1 μg·mL-1,Asn 20.4 μg·mL-1,Cit 21.5 μg·mL-1,Arg 20.9 μg·mL-1,Orn 20.4 μg·mL-1),于上述实验条件下分别在1 d内连续进样6次和连续3日重复进样6次,以所分析的各成分峰面积的RSD评价日内和日间精密度,结果见表 4。18种氨基酸的日内精密度RSD在0.77%~5.3%之间,日间精密度RSD在0.56%~5.4%之间,表明本方法精密度良好。
|
|
表 4 精密度、重复性、稳定性和回收率试验结果(n=6) Table 4 Precision, repeatability, stability and recovery |
称取S1号样品6份,分别按照“2.1.2”项下方法制备供试品溶液,在上述实验条件下进样分析,以样品中各成分含量的RSD来评价其重复性。结果见表 4。18种氨基酸含量的RSD在0.63%~4.1%之间,表明本方法重复性良好。
2.6 稳定性试验取S1号样品的供试品溶液,分别于0、4、8、12、24和48 h进样测定,以各成分含量的RSD考察其稳定性,结果见表 4。18种氨基酸的RSD在0.69%~3.1%之间,表明供试品溶液在48 h内稳定性良好。
2.7 加样回收率试验取已知含量的S1号样品约0.5 g,平行6份,分别加入与0.5 g样品中各待测成分的量相当的对照品,按“2.1.2”项下方法制备供试溶液,按“2.2”项下条件进样测定,计算其回收率,结果见表 4。18种氨基酸的回收率在95.5%~102.3%之间,RSD在0.74%~3.3%之间,表明本方法回收率良好。
2.8 样品测定按“2.1.2”项下方法制备各批样品的供试品溶液,按“2.2”项所述条件进样,测定峰面积,采用Waters TargetLynx数据分析软件计算。结果见表 5。
|
|
表 5 35批黄芩茎叶中18种氨基酸分析测定结果(μg·g-1,n=3) Table 5 Determination results of 18 kinds of amino acids in Scutellaria baicalensis stem-leaf |
由表 5分析可知,黄芩茎叶含有丰富的氨基酸类成分,不同产地氨基酸种类几无差异,18种氨基酸均能检测到。在18种氨基酸中,Gln的含量最高,平均含量达1 823.96 μg·g-1,其次为Lys(903.55 μg·g-1)、Pro(747.00 μg·g-1)、Glu(650.87 μg·g-1)、Arg(451.81 μg·g-1)、Thr(414.77.00 μg·g-1),Cit(10.17 μg·g-1)、Met(3.93 μg·g-1)、Hpro(2.91 μg·g-1)平均含量较低。甘肃兰州样品总氨基酸含量最高,达14.75 mg·g-1,山西运城样品总氨基酸含量最低,仅1.46 mg·g-1。
为了阐明不同产地与黄芩茎叶各氨基酸成分的关联关系,采用SPSS 19.0统计软件对表 5数据进行主成分分析,结果见表 6、7,前2个主成分的特征值均大于1,说明前2个因子在反映产地与黄芩茎叶各氨基酸类成分的相互关系中起主导作用,2个主成分的累计贡献率达66.73%,能够客观地反映产地不同与氨基酸成分的内在联系,主成分1与GABA、Phe、Leu、Ile、Met、Val、Pro、Ala、Hpro、Thr、Ser、Asn有较好的相关性,主成分2与Phe、Lys、Gln、Arg有较好的相关性,能够较为全面地反映所有化合物的信息,故选取前2个主成分进行分析,各样品的主成分得分图见图 2,并根据得分进行分组,将相近者归为一组[13]。样品大致可以分成5组,组1由采于河北承德的样品组成,组2由采于陕西商洛的样品组成,组3由采于北京的样品组成,组4是由采于山西运城的样品组成,组5由采于山西大同的样品组成。该分组结果表明,相同产地的样品能够较好地聚集在一起。这5个产地为我国黄芩的主产区,已有悠久的栽培历史,因而品质较为稳定,山东济南、甘肃兰州、江苏南京和大兴安岭地区样品分散的原因可能是样本数量较少,且由于这些区域不是黄芩的主产区,因而质量较不稳定。结合表 5可知,组1各样品的GABA、Leu、Ile、Met、Val、Pro、Ala、Hpro、Thr、Ser、Cit和Orn平均含量高于其余4组;组2各样品的Phe、Lys、Gln、Asn和总氨基酸平均含量高于其余4组;组3各样品的Glu平均含量高于其余4组;组5各样品的Arg平均含量高于其余4组。所以,各样品中的氨基酸类成分含量差异可能与产地生态环境诸多生态因子密切相关。
|
|
表 6 主成分的特征值及贡献率 Table 6 The eigenvalues and total variance contribution of the principal components |
|
|
表 7 主成分的成分矩阵 Table 7 Component loading matrix of PCA |
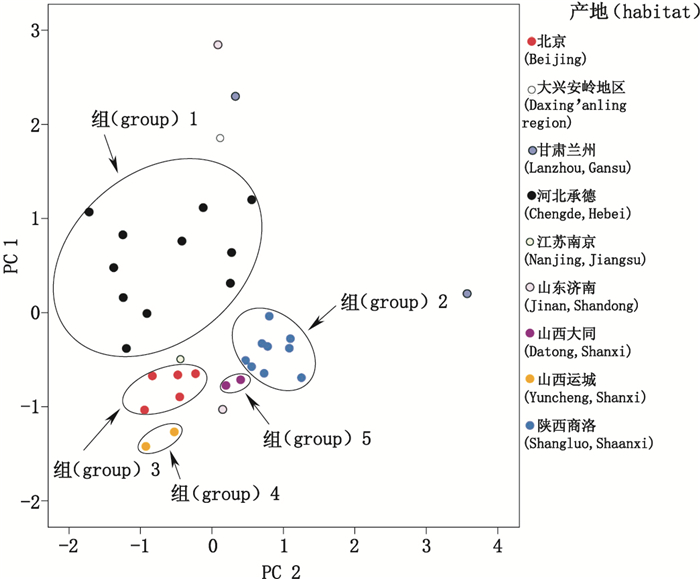
|
图 2 样品主成分得分图 Figure 2 The scatter plots obtained by PCA of the samples |
研究结果显示,不同产地黄芩茎叶中氨基酸成分的种类基本相同,不同产地黄芩茎叶样品中氨基酸的含量差异较大,不同产地不同气候水文条件可能是导致这一现象的主要原因。北京、河北承德、陕西商洛、山西大同和山西运城的黄芩茎叶的氨基酸种类与含量相对稳定,有利于黄芩茎叶资源的开发利用。如需要多种氨基酸含量较高时,可以选择河北承德的黄芩茎叶资源;如需要氨基酸总量较高时,可以选择陕西商洛的黄芩茎叶资源。
黄芩茎叶的氨基酸种类资源性成分丰富且含量较高,Gln适用于食品添加剂,也是人体肌肉中最丰富的游离氨基酸[14];Lys和Pro是人体必需氨基酸,能够促进人体发育,增强免疫功能;临床上Glu可用于治疗肝性昏迷,改善儿童智力发育[15];Arg在临床上常用于治疗病毒性肝炎谷丙转氨酶异常[16]。所以,目前被大量丢弃的黄芩茎叶资源可以用于提取分离氨基酸类成分,以满足临床与生活需求。
本实验建立了UPLC-TQ-MS技术同时测定不同产地18种氨基酸类成分的方法,比较了不同产地之间18种氨基酸类成分含量的差异,并通过主成分分析(PCA)进行综合评价,为黄芩茎叶功效物质基础以及黄芩茎叶资源的进一步开发利用提供科学依据。
| [1] |
王丹, 张秋燕, 杨兴鑫, 等. 基于HPLC指纹图谱的黄芩道地药材与非道地药材的鉴别研究[J]. 中国中药杂志, 2013, 38(12): 1951. WANG D, ZHANG QY, YANG XX, et al. Study on HPLC-fingerprint-based identification of Dao-di herb and non Dao-di herb of Scutellariae Baicalensis Radix[J]. China J Chin Mater Med, 2013, 38(12): 1951. |
| [2] |
梁英, 韩鲁佳. 黄芩中黄酮类化合物药理学作用研究进展[J]. 中国农业大学学报, 2003, 8(6): 9. LIANG Y, HAN LJ. Advances in research of pharmacological activities of flavoniod compounds in Scutellaria baicalensis Georgi[J]. J China Agric Univ, 2003, 8(6): 9. |
| [3] |
于晶, 陈君, 肖新月, 等. 不同来源黄芩产量及质量性状的比较研究[J]. 中国中药杂志, 2005, 30(7): 491. YU J, CHEN J, XIAO XY, et al. Study on yield and quality of Scutellaria baicalensis from different habitats[J]. China J Chin Mater Med, 2005, 30(7): 491. |
| [4] |
何春年, 彭勇, 肖伟, 等. 黄芩茶的应用历史与研究现状[J]. 中国现代中药, 2011, 13(6): 3. HE CN, PENG Y, XIAO W, et al. Application history and current research situation of skullcap tea[J]. Mod Chin Med, 2011, 13(6): 3. |
| [5] |
朱艳霞, 骆翔, 赵东平, 等. 黄芩、黄芩茶及其水溶液中矿质元素含量分析[J]. 光谱学与光谱分析, 2011, 31(11): 3112. ZHU YX, LUO X, ZHAO DP, et al. Analysis of the content of mineral elements in Scutellaria baicalensis, skullcap tea and its solution.[J]. Spectrosc Spect Anal, 2011, 31(11): 3112. DOI:10.3964/j.issn.1000-0593(2011)11-3112-03 |
| [6] |
王宏伟, 尹志峰, 李洪波, 等. 黄芩茎叶中的化学成分[J]. 中国实验方剂学杂志, 2016, 22(22): 41. WANG HW, YIN ZF, LI HB, et al. Chemical constituents from stems and leaves of Scutellaria baicalensis[J]. Chin J Exp Tradit Med Form, 2016, 22(22): 41. |
| [7] |
郗玉玲, 商亚珍. 黄芩茎叶的研究进展[J]. 承德医学院学报, 2007, 24(3): 293. XI YL, SHANG YZ. Research progress of stems and leaves of Scutellaria baicalensis[J]. J Chengde Med Coll, 2007, 24(3): 293. |
| [8] |
何春年, 彭勇, 肖伟, 等. 黄芩地上部分与根部的化学成分比较研究[J]. 中国现代中药, 2011, 13(12): 32. HE CN, PENG Y, XIAO W, et al. Comparative study chemical composition in aerial parts and roots of Scutellaria baicalensis[J]. Mod Chin Med, 2011, 13(12): 32. DOI:10.3969/j.issn.1673-4890.2011.12.008 |
| [9] |
黄贤荣, 梁爱君, 黄忠, 等. 黄芩茎叶药理作用研究进展[J]. 解放军药学学报, 2012, 28(3): 264. HUANG XR, LIANG AJ, HUANG Z, et al. Advances in pharmacological research of Scutellaria baicalensis stem-leaf[J]. Pharm J Chin PLA, 2012, 28(3): 264. |
| [10] |
KASPAR H, DETTMER K, GRONWALD W, et al. Advances in amino acid analysis[J]. Anal Bioanal Chem, 2009, 393(2): 445. DOI:10.1007/s00216-008-2421-1 |
| [11] |
段金廒, 宿树兰, 郭盛, 等. 中药资源产业化过程废弃物的产生及其利用策略与资源化模式[J]. 中草药, 2013, 44(20): 2787. DUAN JA, SU SL, GUO S, et al. Production of castoff from process in Chinese materia medica resource industrialization as well as resource utilization strategies and modes[J]. Chin Tradit Herb Drugs, 2013, 44(20): 2787. |
| [12] |
段金廒, 张伯礼, 宿树兰, 等. 基于循环经济理论的中药资源循环利用策略与模式探讨[J]. 中草药, 2015, 46(12): 1715. DUAN JA, ZHANG BL, SU SL, et al. Strategy and mode of resources circulating utilization for Chinese materia medica based on circular economy theory[J]. Chin Tradit Herb Drugs, 2015, 46(12): 1715. DOI:10.7501/j.issn.0253-2670.2015.12.001 |
| [13] |
杨洁, 段金廒, 李国龙, 等. 不同产地南五味子中木脂素分析研究[J]. 中国中药杂志, 2014, 39(23): 4647. YANG J, DUAN JA, LI GL, et al. Determination of lignans in Schisandrae Sphenantherae Fructus from different regions[J]. China J Chin Mater Med, 2014, 39(23): 4647. |
| [14] |
于泓, 牟世芬. 氨基酸分析方法的研究进展[J]. 分析化学, 2005, 22(3): 398. YU H, MOU SF. Method development for amino acid analysis[J]. Chin J Anal Chem, 2005, 22(3): 398. |
| [15] |
邢健, 李巧玲, 耿涛华, 等. 氨基酸分析方法的研究进展[J]. 中国食品添加剂, 2012(5): 187. XING J, LI QL, GENG TH, et al. Research development for amino acid analysis and determination[J]. China Food Addit, 2012(5): 187. |
| [16] |
王芳, 乔璐, 张庆庆, 等. 桑叶蛋白氨基酸组成分析及营养价值评价[J]. 食品科学, 2015, 36(1): 225. WANG F, QIAO L, ZHANG QQ, et al. Amino acid composition and nutritional evaluation of mulberry leaves[J]. Food Sci, 2015, 36(1): 225. DOI:10.7506/spkx1002-6630-201501043 |
 2018, Vol. 38
2018, Vol. 38 
