2. 柳州市妇幼保健院, 柳州 545001;
3. 广西食品药品检验所, 南宁 530021;
4. 广西药品不良反应监测中心, 南宁 530029
2. Women and Children's Health Care Hospital of Liuzhou, Liuzhou 545001, China;
3. Guangxi Institute for Food and Drug Control, Nanning 530021, China;
4. Center for ADR Monitoring of Guangxi, Nanning 530029, China
中药成分复杂,单一成分含量指标难以全面反映中药的内在质量。多成分含量指标质量评价模式是中药现代化发展的要求,但由于对照品难以分离获得所致市场供应量有限,多指标测定所需费用较高等原因,限制了多组分分析在质量控制中的实际应用。一测多评(quantitative analysis of multi-components by single-marker,QAMS)法是多指标质量控制的模式之一,通过建立一个成分标准曲线,同时实现多个同类成分含量测定,克服了对照品紧缺和检测成本高的困难,成为一种适合中药及其复方制剂特点的多指标质量评价新模式,并已应用于中药及其制剂的质量控制[1-6]。白背叶为大戟科野桐属植物白背叶Mallotus apelta(Lour.)Muell. Arg.的干燥叶,为华南地区常用草药[7],具有柔肝活血、健脾化湿、收敛固脱、消炎止血等功效,主要用于慢性肝炎、肝脾肿大、子宫脱垂、脱肛、白带、妊娠水肿、耳炎、疖肿、跌打损伤、外伤出血等疾病[8]。白背叶中富含黄酮类成分,在前期研究中,作者对白背叶的化学成分进行了研究,分离鉴定了葫芦巴苷Ⅱ、夏佛托苷、异夏佛托苷3个黄酮碳苷类成分,并建立HPLC法测定白背叶中这3个黄酮碳苷类成分的含量[9]。据相关文献报道,葫芦巴苷Ⅱ、夏佛托苷、异夏佛托苷具有较强的抗菌、保肝等作用[10]。白背叶药材中所含3个黄酮碳苷类成分化学结构母核均为芹菜素,具有一致的紫外吸收光谱,适合建立QAMS含量测定方法。因此,本研究将通过外标法(ESM)建立白背叶药材中葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷的HPLC含量测定方法,再以葫芦巴苷Ⅱ为内标,探讨白背叶药材中3个黄酮碳苷成分QAMS同步测定的可行性。
1 仪器与试药 1.1 仪器UltiMate 3000型高效液相色谱仪(Thermo Scientific),Chromeleon 7色谱工作站;Agilent 1260型高效液相色谱仪(Agilent Technologies),Agilent Chem Station工作站;Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),依利特Hypersil BDS-C18色谱柱(250 mm×4.6 mm,5 μm),Phenomenex Synergi Polar-RP C18色谱柱(250 mm×4.6 mm,4 μm);METTLER TOLEDO AG-204电子分析天平(METTLER TOLEDO);Millipore Simplicity-UV超纯水器(美国密里博)。
1.2 试药葫芦巴苷Ⅱ、夏佛托苷、异夏佛托苷的对照品为自行从白背叶药材中分离、精制而得,经MS、H1和C13-NMR确定结构,HPLC峰面积归一化法测得其纯度均大于98%。水为超纯水,甲醇、乙腈为色谱纯(Fisher公司),其余试剂均为分析纯。白背叶药材经广西食品药品检验所韦家福副主任药师鉴定为大戟科植物白背叶Mallotus apelta(Lour.)Muell. Arg.的干燥叶,标本存放于广西食品药品检验所中药标本室。
2 方法与结果 2.1 溶液的制备 2.1.1 混合对照品溶液精密称取105 ℃干燥至恒重的葫芦巴苷Ⅱ、夏佛托苷、异夏佛托苷对照品适量,加70%甲醇水配制成每1 mL含葫芦巴苷Ⅱ0.528 mg,异夏佛托苷0.452 mg和夏佛托苷0.476 mg的混合溶液,即得。
2.1.2 供试品溶液取白背叶药材细粉约1.0 g,精密称定,精密加入70%甲醇水20 mL,称量,加热回流提取1.5 h,放冷,用70%甲醇水补足减失的量,滤过,取续滤液经0.45 μm微孔滤膜滤过,即得。
2.2 色谱条件仪器:Thermo Scientific UltiMate 3000型高效液相色谱仪;色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:甲醇(A)-0.1%乙酸水溶液(B),梯度洗脱(0~10 min,20%A;10~50 min,20%A→80%A;50~51 min,80%A→20%A);流速:1.0 mL·min-1,检测波长:336 nm;柱温:25 ℃;进样量:10 μL。
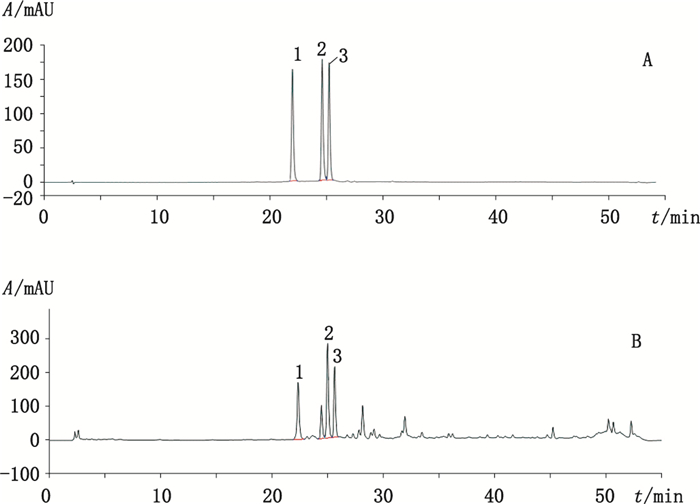
分别吸取混合对照品溶液、供试品溶液各10 μL,按上述色谱条件进样测定,结果见图 1。由图 1可知,3个黄酮碳苷类成分与其他成分之间分离良好。
|
1.葫芦巴苷Ⅱ(vicenin Ⅱ) 2.异夏佛托苷(isoschaftoside) 3.夏佛托苷(schaftoside) 图 1 混合对照品(A)和白背叶药材(B)HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A)and leaves of Mallotus apelta(B) |
精密吸取“2.1.1”项下混合对照品溶液(每1 mL中含葫芦巴苷Ⅱ 0.528 mg,异夏佛托苷0.452 mg,夏佛托苷0.476 mg)0.5、1、2、3、5和10 mL,分别置10 mL量瓶中,用70%甲醇水定容至刻度,摇匀,分别进样10 μL进行测定,以进样量(X)为横坐标,峰面积(Y)为纵坐标,绘制曲线,计算回归方程,葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷的线性回归方程分别为:
| $ \begin{array}{l} \mathit{Y}{\rm{ = 10}}{\rm{.39}}\mathit{X}{\rm{ + 0}}{\rm{.281 9}}\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{6 }}\\ \mathit{Y}{\rm{ = 11}}{\rm{.13}}\mathit{X}{\rm{ + 0}}{\rm{.164 2}}\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{7 }}\\ \mathit{Y}{\rm{ = 10}}{\rm{.32}}\mathit{X}{\rm{ + 0}}{\rm{.019 8}}\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{5 }} \end{array} $ |
线性范围分别为0.264~5.28、0.226~4.52、0.238~4.76 μg,表明各成分进样量在各自范围内与峰面积呈良好的线性关系。
2.3.2 精密度试验取白背叶药材(批号011198)粉末约1.0 g,精密称定,按“2.1.2”项下方法制备供试品溶液,连续进样测定6次,记录峰面积;结果葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷峰面积的RSD(n=6)分别为0.52%、0.65%、0.74%。再取同一份白背叶供试品溶液,分别于溶液制备后第1、2、3、4、5、6 d同法进样,记录峰面积;结果葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷峰面积的RSD(n=6)分别为0.69%、0.48%、0.76%。表明仪器在日内和日间精密度良好。
2.3.3 稳定性试验取同一份白背叶供试品溶液(批号011198),分别于溶液制备后0、2、4、12、24 h进样,测定,记录各成分峰面积的RSD;结果葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷峰面积的RSD(n=5)分别为0.99%、1.1%、0.82%,表明供试品溶液在24 h内稳定。
2.3.4 重复性试验取同一批白背叶药材粉末(批号011198)6份,每份约1.0 g,精密称定,按“2.1.2”项下方法制备供试品溶液,分别进样10 μL,记录峰面积,并计算含量。葫芦巴苷Ⅱ的平均含量为3.31 mg·g-1,RSD为1.9%;异夏佛托苷的平均含量为4.09 mg·g-1,RSD为2.1%;夏佛托苷的平均含量为3.21 mg·g-1,RSD为2.0%;表明该方法的重复性良好。
2.3.5 加样回收率试验精密称取对照品葫芦巴苷Ⅱ16.8 mg,异夏佛托苷19.89 mg,夏佛托苷15.9 mg,置同一200 mL量瓶中,加适量甲醇超声使溶解并稀释至刻度,摇匀,即得混合对照品储备液;另取已测定含量(每1 g中含葫芦巴苷Ⅱ3.31 mg,异夏佛托苷4.09 mg,夏佛托苷3.21 mg)的白背叶药材粉末(批号011198)6份,每份约0.5 g,精密称定,分别精密加入上述混合对照品储备液20 mL,按“2.1.2”项下方法制备供试溶液,按“2.2”项下色谱条件进样,测定峰面积,计算葫芦巴苷Ⅱ、异夏佛托苷、夏佛托苷的平均回收率(n=6)分别为98.6%、101.3%和99.5%,RSD分别为2.9%、2.2%、1.8%。
3 相对校正因子(RCF)和相对保留时间的测定 3.1 待测组分相对校因正子计算精密吸取“2.1.1”项下混合对照品溶液(每1 mL中含葫芦巴苷Ⅱ0.528 mg,异夏佛托苷0.452 mg,夏佛托苷0.476 mg)0.5、1、2、3、5和10 mL,分别置10 mL量瓶中,用甲醇定容至刻度,摇匀,按“2.2”项下色谱条件进样分析,以葫芦巴苷Ⅱ(S)为内参物,计算待测成分异夏佛托苷和夏佛托苷的相对校正因子,结果见表 1。相对校正因子的计算公式为[11]:
| $ {\mathit{f}_{{\rm{g/i}}}} = \frac{{{\mathit{f}_{\rm{s}}}}}{{{\mathit{f}_{\rm{i}}}}} \times \frac{{{\mathit{C}_{\rm{i}}} \times {\mathit{A}_{\rm{s}}}}}{{{\mathit{C}_{\rm{s}}} \times {\mathit{A}_{\rm{i}}}}} $ |
|
|
表 1 异夏佛托苷和夏佛托苷的相对校正因子 Table 1 The relative correction factors of isoschaftoside and schaftoside |
式中As为内参物峰面积,Cs为内参物的浓度,Ai为待测组分i的峰面积,Ci为待测组分i的浓度。
根据所测定的相对校正因子,可计算出待测组分i的浓度,其计算公式为[7]:
| $ {\mathit{C}_{\rm{i}}} = {\mathit{f}_{{\rm{s/i}}}} \times \frac{{{\mathit{C}_{\rm{s}}} \times {\mathit{A}_{\rm{i}}}}}{{{\mathit{A}_{\rm{s}}}}} $ |
式中Ci为待测组分i的浓度,fs/i为待测组分i的相对校正因子,As为内参物的峰面积,Cs为内参物的浓度,Ai为待测组分i的峰面积。
3.2 相对校正因子的重现性考察取混合对照品溶液,分别考察UltiMate 3000、Agilent 1260高效液相色谱仪和Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm)、依利特Hypersil BDS-C18色谱柱(250 mm×4.6 mm,5 μm)、Phenomenex Synergi Polar-RP C18色谱柱(250 mm×4.6 mm,4 μm)对相对校正因子的影响,结果见表 2。结果表明,不同高效液相色谱仪及色谱柱对相对校正因子无显著影响。
|
|
表 2 待测组成分在不同仪器及色谱柱测定的相对校正因子 Table 2 Relative correction factors obtained by different instruments and chromatographic columns |
相对保留时间(relative retention time)是QAMS法中待测色谱峰的定位方法之一[7]。本研究考察了在不同品牌仪器和色谱柱中待测组分相对保留时间的重现性,测得异夏佛托苷和夏佛托苷相对保留时间的RSD分别为1.9%和2.4%。结果表明相对保留时间的波动相对较小,可以用于定位待测组分色谱峰,测定结果见表 3。
|
|
表 3 待测组分在不同仪器及色谱柱测定的相对保留时间值 Table 3 Relative retention time obtained by different instruments and chromatographic columns |
取6批不同批号的白背叶药材粉末,按“2.1.2”项下方法制备供试品溶液;分别精密吸取供试品溶液10 μL,按“2.2”项下色谱条件进样,测定峰面积。采用ESM和QAMS法计算白背叶药材中异夏佛托苷和夏佛托苷的含量,结果见表 4。表明2种含量测定方法无显著性差异,相对误差(相对误差=(QAMS计算值-ESM实测值)/ESM实测值×100%)在可接受范围。
|
|
表 4 QAMS法与ESM测得白背叶中2种成分的含量(n=3) Table 4 Determination of two flavonoid glycosides in Mallotus apelta by QAMS and ESM |
据相关文献报道,葫芦巴苷Ⅱ、夏佛托苷、异夏佛托苷具有较强的抗菌、保肝等作用,在白背叶药材中含量也较高,适用于作为白背叶质量控制的评价指标。目前,葫芦巴苷Ⅱ比其他黄酮碳苷成分较易于分离获得,其在HPLC分析中相对较为稳定,故选择葫芦巴苷Ⅱ作为内标参照物,建立QAMS含量测定方法。
5.2 仪器与色谱柱对测定结果的影响通过考察2种高效液相色谱系统和3种不同品牌色谱柱对待测成分相对校正因子和相对保留时间的影响,结果显示待测成分的相对校正因子具有良好的重现性,其色谱峰相对保留时间的波动相对较小,可以用于定位待测组分色谱峰。
5.3 QAMS法与ESM测定结果的比较本研究将QAMS应用于白背叶药材中黄酮碳苷成分质量评价,采用ESM和QAMS法得到的含量值之间无显著性差异。从含量测定结果来看,6批不同来源白背叶中3个黄酮碳苷类成分的含量具有一定的差异,可能受产地和采收期影响所致,但并不影响QAMS测定结果,说明QAMS用于白背叶药材质量评价是可行的。
5.4 小结QAMS法应用于多成分含量测定,具有简便、准确、节约成本等特点,适合中药材及其制剂中多成分特别是同类型成分的质量评价。
| [1] |
范成杰. 一测多评法在中药质量评价和控制中的应用概况[J]. 中药与临床, 2013, 4(2): 18. FAN CJ. Application situation of multi-components quantitation by one marker new method for quality evaluation and control of Chinese herbal medicine[J]. Pharm Clin Chin Mater Med, 2013, 4(2): 18. |
| [2] |
杨海玲, 吴丽丹, 覃德杰, 等. 一测多评法同时测定广西姜黄饮片中3种姜黄素类成分含量[J]. 药物分析杂志, 2016, 36(9): 1571. YANG HL, WU LD, QIN DJ, et al. Simultaneous determination of ingredients in three kinds of curcum in Rhizoma Curcumae Longae from Guangxi province by QAMS[J]. Chin J Pharm Anal, 2016, 36(9): 1571. |
| [3] |
王晓燕, 霍甜甜, 李振国. 一测多评法同时测定杞菊地黄口服液中4种有效成分的含量[J]. 药物分析杂志, 2017, 37(2): 290. WANG XY, HUO TT, LI ZG. Simultaneous determination of 4 active components in Qiju Dihuang oral liquid by QAMS method[J]. Chin J Pharm Anal, 2017, 37(2): 290. |
| [4] |
钱正明, 孙敏甜, 艾中, 等. 一测多评法测定冬虫夏草中3种核苷的含量[J]. 中国药学杂志, 2015, 50(15): 1297. QIAN ZM, SUN MT, AI Z, et al. Simultaneous determination of three nucleosides in Cordyceps sinensis by QAMS[J]. Chin Pharm J, 2015, 50(15): 1297. |
| [5] |
王智民, 钱忠直, 张启伟. 一测多评法建立的技术指南[J]. 中国中药杂志, 2011, 36(6): 657. WANG ZM, QIAN ZZ, ZHANG QW. The guidelines for establishment of QAMS[J]. China J Chin Mater Med, 2011, 36(6): 657. |
| [6] |
万青, 涂楚月, 熊慧, 等. 一测多评法测定藏药金腰草中4种黄酮类化学成分的含量[J]. 药物分析杂志, 2016, 36(6): 1053. WAN Q, TU CY, XIONG H, et al. Determination of four flavones in Chrysosplenium nudicaule Bunge by QAMS method[J]. Chin J Pharm Anal, 2016, 36(6): 1053. |
| [7] |
中国科学院中国植物志编辑委员会. 中国植物志. 第44卷. 第二分册[M]. 2005: 36 Chinese Academy of Sciences, China Flora Editorial Board. Flora of China. Vol 44. Book Two[M]. 2005: 36 |
| [8] |
国家中医药管理局《中华本草》编委会. 中华本草. 第四卷[M]. 1999: 827 The State administration of Traditional Chinese Medicine "Chinese Materia Medica"Editorial Board. Chinese Materia Medica. Vol 4[M]. 1999: 827 |
| [9] |
谢巍, 杨立佼, 周伟娥, 等. HPLC法测定白背叶中3个黄酮碳苷类成分的含量[J]. 药物分析杂志, 2015, 35(7): 1205. XIE W, YANG LJ, ZHOU WE, et al. HPLC method for simultaneous determination of three flavonoids in Mallotus apelta[J]. Chin J Pharm Anal, 2015, 35(7): 1205. |
| [10] |
龚金炎, 吴晓琴, 张英. 碳苷黄酮及其药理活性研究进展[J]. 天然产物研究与开发, 2010, 22(3): 525. GONG JY, WU XQ, ZHANG Y. Advanced research of flavonoid C-glycosides and their pharmacological effects[J]. Nat Prod Res Dev, 2010, 22(3): 525. |
| [11] |
王智民, 高慧敏, 付雪涛, 等. 一测多评法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
 2018, Vol. 38
2018, Vol. 38 
