2. 中国药科大学江苏省药效研究与评价服务中心, 南京 210009;
3. 药物质量与安全预警教育部重点实验室(中国药科大学), 南京 210009;
4. 广东药科大学药学院新药筛选与药效学评价中心, 广州 510006
2. Jiangsu Center for Pharmacodynamics Research and Evaluation, China Pharmaceutical University, Nanjing 210009, China;
3. Key Laboratory of Drug Quality Control and Pharmacovigilance(China Pharmaceutical University), Ministry of Education, Nanjing 210009, China;
4. Center for Drug Screening and Pharmacodynamics Evaluation, School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China
内源性类固醇激素是指自身合成的激素,按药理作用可分为肾上腺皮质激素和性激素。临床上将类固醇激素水平作为较多疾病的诊断指标,包括先天性类固醇代谢紊乱(如先天性肾上腺增生、先天性发育障碍和先天性盐稳态失调等)和获得性类固醇代谢紊乱(如原发性醛固酮增多症、库欣综合征、艾迪生病、高雄激素血症及精神状态疾病)等[1]。
类固醇激素又称甾体激素,以环戊烷多氢菲为母核,按化学结构分为雄甾烷、雌甾烷和孕甾烷。甾烷母核由A、B、C、D 4个环以不同方式稠合在一起,其中雄甾烷和孕甾烷的A环大多数含有4-烯-3-酮结构,如睾酮、皮质醇、孕酮。雌甾烷的结构特点为A环芳构化,C-3位上有酚羟基,C-17位上有羟基和酮基,天然雌激素有雌酮、雌二醇和雌三醇3种(图 1)。由于官能团结构的不同,各种激素的化学性质差异较大,且大多数激素体内含量极微,因此寻找一种可靠、特异的分析方法成为临床疾病诊断的首要任务[2-3]。
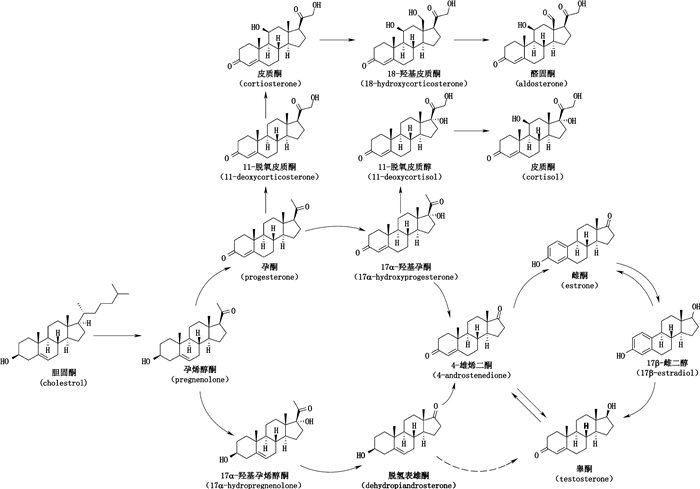
|
图 1 类固醇激素的合成通路图 Figure 1 The synthesis pathway of steroid hormones |
目前类固醇激素的检测方法主要有化学免疫法、LC-MS/MS、气相色谱-质谱联用技术。20世纪前,化学免疫法因操作简单快速,在临床广泛应用。但传统的化学免疫法存在很多缺陷:一是灵敏度低,当样本浓度很低时,需要较大的样本量富集、纯化;二是适用性差,待测物的抗体易与结构相似的内源性物质或代谢产物产生交叉反应,造成假阳性结果;三是分析效率低,通常1次只能测定1种物质,无法同时进行多种激素的定性和定量分析。因此,化学免疫法已逐渐被色谱法替代。气相色谱-质谱联用技术灵敏度高,但往往需要烦琐的衍生化步骤和较长的分析时间(一般≥30 min),并且目前缺乏一种适用于所有类固醇激素的衍生化试剂[4-5]。LC-MS/MS技术则避免了气相色谱法烦琐的衍生化步骤,且专属性强,能够很好地排除基质中类似结构物质的干扰,是目前最可靠的检测方法。同时,LC-MS/MS的灵敏度高,能够满足临床实验室大多数类固醇激素的检测要求[3]。飞行时间质谱(time of flight mass spectrometer,TOF-MS)能对未知类固醇激素代谢产物的结构进行鉴定,为临床疾病诊断和治疗带来新发现[6-9]。
本文综述了近年来应用液质联用技术测定类固醇激素的方法,并进行了比较分析(表 1),重点强调了LC-MS/MS在临床实验室类固醇激素的测定方法及研究进展,为临床类固醇激素的测定提供指导,使LC-MS/MS更广泛、方便地应用于临床疾病的诊断和监测。
|
|
表 1 LC-MS/MS测定的类固醇激素及其方法 Table 1 Steroid hormones and the analysis methods by LC-MS/MS |
临床生物样品(如血清、唾液和尿液等)前处理的最基本要求是去除样品中的蛋白质,避免其堵塞进样器和色谱柱。类固醇激素生物样品常规的前处理方法有蛋白质沉淀(PP)、液液萃取(LLE)和固相萃取(SPE),而多种前处理方法相结合具有回收率高及省时省力等优点,已逐渐受到关注[21-23]。
PP主要针对血清、血浆、唾液等样品进行前处理,不适合尿液和粪便。PP法简单易行,成本低,如血清样品中皮质醇的测定[24]。但该方法会降低检测灵敏度,且基质效应较严重,临床上常与SPE结合。
LLE应用相似相溶原理,通过向待测样本中加入有机试剂,将待测物从基质中萃取出来。文献报道的提取剂有正己烷、乙酸乙酯、甲基叔丁基醚、二氯甲烷、二乙醚及其一定比例的混合物[23, 25]。LLE法简单、快速、高效,但操作上难以实现自动化,从而限制了临床上的应用。改进后的盐析辅助液液萃取技术(salting-out assisted liquid-liquid extraction,SALLE)通过向水相中加入易挥发性的盐类物质(如醋酸铵),降低均相混合溶液中两相之间的互溶能力,能使有机溶剂更好地从水溶液中分离出来[26-28]。该技术曾应用于鱼组织类固醇激素的分析,先通过微波辅助SPE,待萃取完成后,向收集管中加入醋酸铵,静置,待萃取物完全分层为乙腈相和水相,转移含类固醇激素的有机相,将其挥干、复溶,进行LC-MS/MS分析。SALLE的优点是缩短了两相平衡的时间,减少了毒性有机溶剂的使用,含萃取物的上层有机相最后可直接进行LC-MS/MS分析,简化了样品预处理过程,可用于临床标本类固醇激素的提取[27]。
SPE利用待测物在液相和固相的分配差异来实现萃取过程,类似于柱色谱分离过程,既能有效减少基质效应,又能实现纯化浓缩,近年来发展迅速,是临床类固醇激素分析的主要前处理方法。临床上类固醇激素分析常用的SPE柱有HLB[29-30]、C18[31]、Strata-X[32]等。相比于PP和LLE,SPE较为烦琐,在传统的SPE基础上进行改进的固相支持液液萃取(SLE)技术以硅藻土为固相吸附面,具有较大的比表面积和较低的表面活性,能很好地去除磷脂等杂质,集简单、快速、有效于一体[25]。目前,SLE方法已被广泛应用于临床类固醇激素如醛固酮[11]、雌二醇和雌酮[33]、皮质醇[12]的分析[34]。
类固醇激素及其代谢物是一类庞大而复杂的家族,不同激素间的化学性质和极性千差万别[22, 25]。因此,将几类样品前处理技术联用,如PP与在线SPE结合[19-20],既能提高待测物的纯化和富集效果,又能提高检测的灵敏度和重现性,非常适合临床复杂样本的分析[14]。
1.2 色谱条件色谱柱是液相色谱分离的核心,常规的C8或C18键合硅胶反相色谱柱可满足大多数类固醇激素的分离要求[10, 24]。但对一些分子量相近的类固醇激素,常规色谱柱的分离度达不到要求,为满足临床测定工作的需求,越来越多的色谱固定相被相继开发。如Ionita等[35]使用Zorbax-SB Phenyl色谱柱对泼尼松龙和可的松(相对分子质量均为360.44)进行了良好分离。其次,固定相填料的粒径也会显著影响色谱分辨率。亚2微米填料色谱柱通常填充1.3~2.0 μm的颗粒填料,分析工作者认为这种填料有利于增加类固醇激素色谱峰形分辨率和提高灵敏度[16]。小粒径的柱填料需要更高的柱压系统,因此基本上在超高压液相色谱系统中使用。
改变流动相组成来提高色谱柱的选择性是临床实验室分析工作中常用的手段,其流动相的pH和添加剂的种类会对灵敏度及色谱分离产生较大影响。醋酸铵、甲酸是类固醇激素测定中常用的流动相添加剂,甲酸一般能较好地促进正离子模式下类固醇激素的电离作用[13-14, 16, 20, 24]。但对于雌二醇、孕烯醇酮等非极性的化合物,可能需要一些特殊的添加剂,如氟化铵、碳酸氢铵、醋酸铵和氯化铵[36]。这些添加剂能够很好地与待测物羟基上的H结合,从而形成[M-H]- …H+.…A-二聚体混合物。如在流动相或工作液中添加氟化铵,待测物会先跟氟离子形成前体离子[M+F]-加合物,通过电喷雾质谱负离子模式(ESI-MS)碰撞诱导电离(collision-induced dissociation,CID)后,前体离子失去HF产生[M-H]-,最后还可以通过连续分解产生丰度更高的产物离子。Dumont等[37]通过在流动相中添加氟化铵,使二乙诺酮的检测下限由原来的250 ng·mL-1降至25 ng·mL-1。该分析方法简单快速,可应用于实验研究和临床监测。
1.3 质谱条件串联质谱在临床生化检测中占据主导地位,常用于类固醇激素分析的离子源包括电喷雾(electrospray ionization,ESI)离子源、大气压化学电离(atmospheric-pressure chemical ionization,APCI)离子源等。ESI适用于中等极性至极性较大的待测物,在类固醇激素的检测中应用最为广泛。有文献报道APCI测定雌激素和脱氢表雄酮的基质效应更小,离子化效率更高[10, 20]。而大气压光化学电离(atmospheric pressure photoionization,APPI)技术是指非极性物质通过光化学作用完成质子转移和电荷交换,可作为APCI和ESI的补充。本质上ESI、APCI和APPI都是通过选择性电离减少基质效应和已知干扰[38]。APPI可用于血清和血浆中皮质醇、可的松测定,该方法有较好灵敏度和专属性[22, 39]。
对于类固醇类物质的检测,同位素氘化物是理想的内标,一般选择多于二氘代的同位素内标物,从而避免自身[M+2]峰对二氘代内标造成干扰,引起待测物浓度偏低[40-41]。
1.4 基于LC-MS/MS改进的新技术高分辨质谱如TOF和Orbitrap基本能达到×10-7级的质量精度和10 000 FWHM(Full Width Half Maximum)以上的超高分辨率[42-43]。高分辨质谱既可获得待测物的分子离子信息,又可获得经碰撞后的碎片离子信息,再通过比对相关质谱数据库,可实现对整个类固醇激素代谢通路的定性筛查,但定量灵敏度不如三重四极杆定量质谱,再者价格昂贵,目前在临床实验室的应用并不多。如果将高分辨质谱与三重四极杆串联质谱结合,将会有效改善高分辨质谱定量灵敏度上的缺陷。因此,未来高分辨质谱的应用将值得关注。
2 LC-MS/MS应用于类固醇激素的研究内源性类固醇激素主要包括肾上腺皮质激素和性激素。临床数据表明,具有4-烯-3-酮结构的类固醇激素(如雄烯二酮、孕酮以及睾酮)较易质子化,灵敏度高,一般采用正离子模式检测[44]。但少数不具有此结构的多羟基类激素无论是ESI、APCI或APPI,均无法获得较高的灵敏度,因此也需要衍生化步骤来提高灵敏度,如雌激素、醛固酮[21, 45, 47]。下文从皮质类固醇和性激素两方面分别阐述LC-MS/MS在临床上的应用特点。
2.1 肾上腺皮质激素的测定皮质醇作为人体主要的糖皮质激素,约90%与体内循环中的球蛋白结合,约6%与白蛋白结合,剩下的4%呈游离状态并发挥生理活性[44]。对于皮质醇的测定,商业化的免疫学方法表现出较差的重现性,且易受结构类似的强的松龙等药物干扰,而LC-MS/MS专属性强,灵敏度高,因此迅速进入常规临床实验室[24]。Monaghan等[48]比较了化学发光免疫分析和LC-MS/MS 2种方法测定经11β-羟化酶抑制剂甲吡酮治疗的库欣综合征患者血清中皮质醇的含量。经一致性检验,发现2种方法测定的同一组别(甲吡酮治疗组)结果相差248.7 nmol·L-1,超出临床测定误差范围。这些数据表明化学发光免疫法的交叉反应性很可能会误导甲吡酮的临床用量。
Ceccato等[49]建立了标准化的LC-MS/MS分析方法测定尿液中游离皮质醇(urinary free cortisol,UFF)的浓度,并评估了该方法诊断库欣综合征的方法灵敏度及特异性。样品采用SPE提取,定量限可达5~625 nmol·L-1,批内、批间RSD均小于6%。该方法以24 h尿液中UFF浓度>170 nmol为诊断标准,报道了库欣综合征患者在不同发病阶段的皮质醇水平参考范围。该方法灵敏、准确,为临床医生的疾病诊断提供了有力的工具。Marcos等[15]应用LC-MS/MS技术建立了同时测定尿液中67种内源性皮质类固醇类激素(包括糖皮质激素、盐皮质类激素和孕激素)的方法,尿液样本先用β-葡萄糖醛酸酶水解,再加入少量饱和盐溶液,最后经乙酸乙酯液液萃取。样品回收率均大于80%,批内精密度RSD小于20%,其中含4-烯-3-酮结构的皮质激素类物质定量下限低于1 ng·mL-1,其他代谢物的定量下限也低于15 ng·mL-1。该方法快速高通量,可广泛用于患者体内类固醇激素水平的测定。
2.2 性激素的测定 2.2.1 雄激素雄激素类物质的前处理方法一般包括SPE[19-20, 50],LLE[17]及多种前处理方式相结合。Buttler等[18]通过LC-MS/MS检测血清和脑脊液中的DHEAS,并与临床上常用的8种免疫分析法(radioimmunoassay,RIA)进行了比较,结果见表 2。总体上两者的测定结果呈现良好的相关性,但在低浓度范围,RIA表现出较大的变异系数,这可能误导临床诊断。由此可得,LC-MS/MS技术专属性强,重现性好,能够为临床诊断提供更可靠的数据结果。
|
|
表 2 7种商业化免疫分析方法和同位素稀释高效液相-串联质谱法测定DHEAS的方法学比较 Table 2 Comparison of seven commercial immunoassay methods and isotope dilution high performance liquid chromatography-tandem mass spectrometry for the determination of DHEAS |
雄激素不仅在男性机体中发挥着重要作用,也会影响女性的内分泌系统。有学者发现,雄烯二酮是诊断多囊卵巢综合征的重要标志物[46]。Gao等[10]运用LC-MS/MS建立了同时检测唾液中雌二醇、皮质醇、可的松、睾酮、孕酮、皮质酮及DHEA的分析方法,样品经在线SPE净化后检测,样本量仅需100 μL,分析时间仅5.2 min。结果表明,除了DHEA的定量下限是10 pg·mL-1外,其他激素的定量下限均低于或等于5 pg·mL-1,该方法明显优于目前临床上常规的免疫分析法。
2.2.2 雌激素正常男性、小孩、绝经期妇女以及经芳香化酶抑制剂治疗的妇女的血清雌激素含量很低,绝经后妇女的雌二醇水平持续低于100 pmol·L-1,故免疫分析法难以准确测定[51-52]。LC-MS/MS技术灵敏度高,特异性强,已广泛应用于糖皮质激素和雄激素的检测。但雌激素的基本结构为A环芳构化,C-3子化效率低,分析工作者常在常规前处理过程中加入位连接酚羟基,这样的结构特点导致该类物质离衍生化步骤。雌激素的(酚)羟基是发生衍生化反应的主要位点,常用的衍生化试剂包括酰氯类和吡啶类[13, 52]。Zhao等[14]用丹磺酰氯对雌酮、雌二醇、雌三醇进行衍生化,使用AB Sciex 5500 Qtrap质谱仪在正离子模式下检测,定量下限均低于2 pg·mL-1,准确地考察了芳香化酶抑制剂依西美坦对患者体内12种内源性雌激素及其代谢物的影响。但丹磺酰氯衍生物产生的子离子均由丹磺酰氯结构产生,一般为m/z 171和m/z 156,由于是丹酰片段部分裂解产生的碎片离子,而不是雌激素结构电离产生的特异子离子,因此定量检测的特异性将引起质疑[14, 33]。
吡啶类酰化试剂克服了丹磺酰氯这方面的不足。Wang等[13]加入吡啶-3-磺酰氯与雌二醇及其代谢物反应,生成的N-甲基吡啶-3-磺酰类衍生物(N-methyl pyridinium-3-sulfonyl,NMPS)能产生特异的碎片离子,谱图上无其他杂峰干扰。该衍生化方法首次发现4-甲氧基雌二醇很可能是乳腺癌的潜在生物标志物。
衍生化的缺点是难以自动化。近年来有学者通过改变前处理方式以避免难以自动化的衍生化步骤,同样实现了雌激素灵敏度的增加。如Owen等[33]将SLE和在线SPE结合分析血浆中的雌二醇和雌酮,采用氟化铵和甲醇为流动相,总分析时间为4.5 min,该方法可自动化,且高效、灵敏,雌二醇和雌酮的定量下限分别达到了10、6 pmol·L-1。与衍生化的前处理方法相比,该方法更适合临床实验室雌激素的测定。
3 总结与展望内源性类固醇激素作为肾上腺和性腺分泌的一种微量高效能的生物活性物质,在临床治疗药物监测、儿科学、内分泌学等领域都发挥着关键作用。因此,对其进行准确的定量检测一直是研究热点。近年来,随着液相色谱及质谱仪器硬件技术的提高和计算机的发展,LC-MS/MS不再局限于实验室科学研究,方法的建立也因此变得更加简单、快速。与已成熟的免疫分析法相比,LC-MS/MS在临床实验室的应用还处于初期阶段。但LC-MS/MS具备的高专属性,低进样量,能同时测定复杂基质中的多种类固醇激素的优点,十分符合临床生物样本的检测要求,因此它的应用前景比化学免疫法及气相色谱法更为广泛。
LC-MS/MS样品在分析之前,需要进行样品前处理使其更好地进行色谱分离和检测。常用的前处理方法包括PP、LLE、在线和离线SPE,为了满足类固醇激素同分异构体的测定和灵敏度要求,往往还需要衍生化技术。这些都会增加操作的复杂性,因此在今后的工作中,多种前处理技术相结合,离子源及质量分析器的选择以及液质仪器硬件的发展,是LC-MS/MS技术实现自动化和更加高通量的关键,也是LC-MS/MS方法开发的重点和难点。
综上,高灵敏度和高特异性的LC-MS/MS方法会越来越多地应用于临床类固醇激素的分析,使内分泌及代谢性疾病的早期诊断和监测成为可能。
| [1] |
NESHER M, SHPOLANSKY U, ROSEN H, et al. The digitalis-like steroid hormones:new mechanisms of action and biological significance[J]. Life Sci, 2007, 80(23): 2093. DOI:10.1016/j.lfs.2007.03.013 |
| [2] |
Peitzsch M, Dekkers T, Haase M, et al. An LC-MS/MS method for steroid profiling during adrenal venous sampling for investigation of primary aldosteronism[J]. J Steroid Biochem Mol Biol, 2015, 145: 75. DOI:10.1016/j.jsbmb.2014.10.006 |
| [3] |
Marcos J, Pozo OJ. Current LC-MS methods and procedures applied to the identification of new steroid metabolites[J]. J Steroid Biochem Mol Biol, 2016, 162: 41. DOI:10.1016/j.jsbmb.2015.12.012 |
| [4] |
Horning MG, Knox KL, Dalgliesh CE, et al. Gas-liquid chromatographic study and estimation of several urinary aromatic acids[J]. Anal Biochem, 1966, 17(2): 244. DOI:10.1016/0003-2697(66)90202-8 |
| [5] |
French D. Advances in bioanalytical techniques to measure steroid hormones in serum[J]. Bioanalysis, 2016, 8(11): 1203. DOI:10.4155/bio-2015-0025 |
| [6] |
Shackleton C. Clinical steroid mass spectrometry:a 45-year history culminating in HPLC-MS/MS becoming an essential tool for patient diagnosis[J]. J Steroid Biochem Mol Biol, 2010, 121(3-5): 481. DOI:10.1016/j.jsbmb.2010.02.017 |
| [7] |
Young SM, Gryder LK, Zava D, et al. Presence and concentration of 17 hormones in human placenta processed for encapsulation and consumption[J]. Placenta, 2016, 43: 86. DOI:10.1016/j.placenta.2016.05.005 |
| [8] |
Xu W, Li H, Guan Q, et al. A rapid and simple liquid chromatography-tandem mass spectrometry method for the measurement of testosterone, androstenedione, and dehydroepiandrosterone in human serum[J]. J Clin Lab Anal, 2016, 31(5): e22102. |
| [9] |
Koal T, Schmiederer D, Pham-Tuan H, et al. Standardized LC-MS/MS based steroid hormone profile-analysis[J]. J Steroid Biochem Mol Biol, 2012, 129(3-5): 129. DOI:10.1016/j.jsbmb.2011.12.001 |
| [10] |
Gao W, Stalder T, Kirschbaum C. Quantitative analysis of estradiol and six other steroid hormones in human saliva using a high throughput liquid chromatography-tandem mass spectrometry assay[J]. Talanta, 2015, 143: 353. DOI:10.1016/j.talanta.2015.05.004 |
| [11] |
van der Gugten JG, Holmes DT. Quantitation of aldosterone in serum or plasma using liquid chromatography-tandem mass spectrometry(LC-MS/MS)[J]. Methods Mol Biol, 2016, 1378: 37. DOI:10.1007/978-1-4939-3182-8 |
| [12] |
Hawley JM, Owen LJ, MacKenzie F, et al. Candidate reference measurement procedure for the quantification of total serum cortisol with LC-MS/MS[J]. Clin Chem, 2016, 62(1): 262. DOI:10.1373/clinchem.2015.243576 |
| [13] |
Wang Q, Rangiah K, Mesaros C, et al. Ultrasensitive quantification of serum estrogens in postmenopausal women and older men by liquid chromatography-tandem mass spectrometry[J]. Steroids, 2015, 96: 140. DOI:10.1016/j.steroids.2015.01.014 |
| [14] |
Zhao Y, Boyd JM, Sawyer MB, et al. Liquid chromatography tandem mass spectrometry determination of free and conjugated estrogens in breast cancer patients before and after exemestane treatment[J]. Anal Chim Acta, 2014, 806: 172. DOI:10.1016/j.aca.2013.11.014 |
| [15] |
Marcos J, Renau N, Casals G, et al. Investigation of endogenous corticosteroids profiles in human urine based on liquid chromatography tandem mass spectrometry[J]. Anal Chim Acta, 2014, 812: 92. DOI:10.1016/j.aca.2013.12.030 |
| [16] |
Owen LJ, Wu FC, Buttler RM, et al. A direct assay for the routine measurement of testosterone, androstenedione, dihydrotestosterone and dehydroepiandrosterone by liquid chromatography tandem mass spectrometry[J]. Ann Clin Biochem, 2016, 53(Pt 5): 580. |
| [17] |
Kushnir MM, Blamires T, Rockwood AL, et al. Liquid chromatography-tandem mass spectrometry assay for androstenedione, dehydroepiandrosterone, and testosterone with pediatric and adult reference intervals[J]. Clin Chem, 2010, 56(7): 1138. DOI:10.1373/clinchem.2010.143222 |
| [18] |
Buttler RM, Kruit A, Blankenstein MA, et al. Measurement of dehydroepiandrosterone sulphate(DHEAS):a comparison of isotope-dilution liquid chromatography tandem mass spectrometry(ID-LC-MS/MS) and seven currently available immunoassays[J]. Clin Chim Acta, 2013, 424: 22. DOI:10.1016/j.cca.2013.04.028 |
| [19] |
Travers S, Martinerie L, Bouvattier C, et al. Multiplexed steroid profiling of gluco- and mineralocorticoids pathways using a liquid chromatography tandem mass spectrometry method[J]. J Steroid Biochem Mol Biol, 2017, 165(Pt B): 202. |
| [20] |
Mezzullo M, Fazzini A, Gambineri A, et al. Parallel diurnal fluctuation of testosterone, androstenedione, dehydroepiandrosterone and 17OH progesterone as assessed in serum and saliva:validation of a novel liquid chromatography-tandem mass spectrometry method for salivary steroid profiling[J]. Clin Chem Lab Med, 2017, 55(9): 1315. |
| [21] |
Carvalho VM. The coming of age of liquid chromatography coupled to tandem mass spectrometry in the endocrinology laboratory[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 883-884: 50. DOI:10.1016/j.jchromb.2011.08.027 |
| [22] |
Kushnir MM, Rockwood AL, Roberts WL, et al. Liquid chromatography tandem mass spectrometry for analysis of steroids in clinical laboratories[J]. Clin Biochem, 2011, 44(1): 77. DOI:10.1016/j.clinbiochem.2010.07.008 |
| [23] |
Keevil BG. Novel liquid chromatography tandem mass spectrometry(LC-MS/MS) methods for measuring steroids[J]. Best Pract Res Clin Endocrinol Metab, 2013, 27(5): 663. DOI:10.1016/j.beem.2013.05.015 |
| [24] |
Owen LJ, Adaway JE, Davies S, et al. Development of a rapid assay for the analysis of serum cortisol and its implementation into a routine service laboratory[J]. Ann Clin Biochem, 2013, 50(Pt 4): 345. |
| [25] |
Adaway JE, Keevil BG, Owen LJ. Liquid chromatography tandem mass spectrometry in the clinical laboratory[J]. Ann Clin Biochem, 2015, 52(Pt 1): 18. |
| [26] |
Valente IM, Rodrigues JA. Recent advances in salt-assisted LLE for analyzing biological samples[J]. Bioanalysis, 2015, 7(17): 2187. DOI:10.4155/bio.15.142 |
| [27] |
Wang H, Zhou X, Zhang Y, et al. Dynamic microwave-assisted extraction coupled with salting-out liquid-liquid extraction for determination of steroid hormones in fish tissues[J]. J Agric Food Chem, 2012, 60(41): 10343. DOI:10.1021/jf303124c |
| [28] |
Wu H, Zhang J, Norem K, et al. Simultaneous determination of a hydrophobic drug candidate and its metabolite in human plasma with salting-out assisted liquid/liquid extraction using a mass spectrometry friendly salt[J]. J Pharm Biomed Anal, 2008, 48(4): 1243. DOI:10.1016/j.jpba.2008.09.002 |
| [29] |
Grover DP, Zhang ZL, Readman JW, et al. A comparison of three analytical techniques for the measurement of steroidal estrogens in environmental water samples[J]. Talanta, 2009, 78(3): 1204. DOI:10.1016/j.talanta.2008.12.049 |
| [30] |
Hibberd A, Maskaoui K, Zhang Z, et al. An improved method for the simultaneous analysis of phenolic and steroidal estrogens in water and sediment[J]. Talanta, 2009, 77(4): 1315. DOI:10.1016/j.talanta.2008.09.006 |
| [31] |
Velicu M, Suri R. Presence of steroid hormones and antibiotics in surface water of agricultural, suburban and mixed-use areas[J]. Environ Monit Assess, 2009, 154(1-4): 349. DOI:10.1007/s10661-008-0402-7 |
| [32] |
Stanford BD, Weinberg HS. Isotope dilution for quantitation of steroid estrogens and nonylphenols by gas chromatography with tandem mass spectrometry in septic, soil, and groundwater matrices[J]. J Chromatogr A, 2007, 1176(1-2): 26. DOI:10.1016/j.chroma.2007.10.085 |
| [33] |
Owen LJ, Wu FC, Keevil BG. A rapid direct assay for the routine measurement of oestradiol and oestrone by liquid chromatography tandem mass spectrometry[J]. Ann Clin Biochem, 2014, 51(Pt 3): 360. |
| [34] |
Buttler RM, Martens F, Fanelli F, et al. Comparison of 7 published LC-MS/MS methods for the simultaneous measurement of testosterone, androstenedione, and dehydroepiandrosterone in serum[J]. Clin Chem, 2015, 61(12): 1475. DOI:10.1373/clinchem.2015.242859 |
| [35] |
Ionita IA, Fast DM, Akhlaghi F. Development of a sensitive and selective method for the quantitative analysis of cortisol, cortisone, prednisolone and prednisone in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877(8-9): 765. DOI:10.1016/j.jchromb.2009.02.019 |
| [36] |
Rannulu NS, Cole RB. Novel fragmentation pathways of anionic adducts of steroids formed by electrospray anion attachment involving regioselective attachment, regiospecific decompositions, charge-induced pathways, and ion-dipole complex intermediates[J]. J Am Soc Mass Spectrom, 2012, 23(9): 1558. DOI:10.1007/s13361-012-0422-y |
| [37] |
Dumont Q, Barcenas M, Dossmann H, et al. Improved steroids detection and evidence for their regiospecific decompositions using anion attachment mass spectrometry[J]. Anal Chem, 2016, 88(7): 3585. DOI:10.1021/acs.analchem.5b04097 |
| [38] |
Robb DB, Covey TR, Bruins AP. Atmospheric pressure photoionization:an ionization method for liquid chromatography-mass spectrometry[J]. Anal Chem, 2000, 72(15): 3653. DOI:10.1021/ac0001636 |
| [39] |
Kushnir MM, Neilson R, Roberts WL, et al. Cortisol and cortisone analysis in serum and plasma by atmospheric pressure photoionization tandem mass spectrometry[J]. Clin Biochem, 2004, 37(5): 357. DOI:10.1016/j.clinbiochem.2004.01.005 |
| [40] |
Duxbury K, Owen L, Gillingwater S, et al. Naturally occurring isotopes of an analyte can interfere with doubly deuterated internal standard measurement[J]. Ann Clin Biochem, 2008, 45(Pt 2): 210. |
| [41] |
Honour JW. Development and validation of a quantitative assay based on tandem mass spectrometry[J]. Ann Clin Biochem, 2011, 48(Pt 2): 97. |
| [42] |
Wu AH, Gerona R, Armenian P, et al. Role of liquid chromatography-high-resolution mass spectrometry(LC-HR/MS) in clinical toxicology[J]. Clin Toxicol(Phila), 2012, 50(8): 733. DOI:10.3109/15563650.2012.713108 |
| [43] |
Zhao W, Huang X, Li X, et al. Qualitative and quantitative analysis of major triterpenoids in Alismatis Rhizoma by high performance liquid chromatography/diode-array detector/quadrupole-time-of-flight mass spectrometry and ultra-performance liquid chromatography/triple quadrupole mass spectrometry[J]. Molecules, 2015, 20(8): 13958. DOI:10.3390/molecules200813958 |
| [44] |
Russell E, Koren G, Rieder M, et al. The detection of cortisol in human sweat:implications for measurement of cortisol in hair[J]. Ther Drug Monit, 2014, 36(1): 30. |
| [45] |
Arlt W, Stewart PM. Adrenal corticosteroid biosynthesis, metabolism, and action[J]. Endocrinol Metab Clin North Am, 2005, 34(2): 293. DOI:10.1016/j.ecl.2005.01.002 |
| [46] |
O'Reilly MW, Taylor AE, Crabtree NJ, et al. Hyperandrogenemia predicts metabolic phenotype in polycystic ovary syndrome:the utility of serum androstenedione[J]. J Clin Endocrinol Metab, 2014, 99(3): 1027. DOI:10.1210/jc.2013-3399 |
| [47] |
Shibata Y, Arai S, Honma S. Methodological approach to the intracrine study and estimation of DHEA and DHEA-S using liquid chromatography-tandem mass spectrometry(LC-MS/MS)[J]. J Steroid Biochem Mol Biol, 2015, 145: 193. DOI:10.1016/j.jsbmb.2014.04.002 |
| [48] |
Monaghan PJ, Owen LJ, Trainer PJ, et al. Comparison of serum cortisol measurement by immunoassay and liquid chromatography-tandem mass spectrometry in patients receiving the 11beta-hydroxylase inhibitor metyrapone[J]. Ann Clin Biochem, 2011, 48(Pt 5): 441. |
| [49] |
Ceccato F, Antonelli G, Barbot M, et al. The diagnostic performance of urinary free cortisol is better than the cortisol:cortisone ratio in detecting de novo Cushing's syndrome:the use of an LC-MS/MS method in routine clinical practice[J]. Eur J Endocrinol, 2014, 171(1): 1. DOI:10.1530/EJE-14-0061 |
| [50] |
Soeborg T, Frederiksen H, Fruekilde P, et al. Serum concentrations of DHEA, DHEAS, 17 alpha-hydroxyprogesterone, delta 4-androstenedione and testosterone in children determined by TurboFlow-LC-MS/MS[J]. Clin Chim Acta, 2013, 419: 95. DOI:10.1016/j.cca.2013.01.019 |
| [51] |
Ketha H, Girtman A, Singh RJ. Estradiol assays-The path ahead[J]. Steroids, 2015, 99(Pt A): 39. |
| [52] |
Newman JD, Handelsman DJ. Challenges to the measurement of oestradiol:comments on an endocrine society position statement[J]. Clin Biochem Rev, 2014, 35(2): 75. |
 2018, Vol. 38
2018, Vol. 38 
