肿瘤的发病率和死亡率居高不下,已成为威胁人类健康的首要疾病。免疫逃逸是肿瘤细胞的重要行为特征,其机制之一便是高表达免疫抑制信号。目前已有针对免疫抑制信号如CTLA-4、PD1等靶点的药物上市,并表现出显著的抗肿瘤效果,然而其针对的均为T细胞的特异性免疫。CD47是一种“别吃我”信号,在生理状态下,可维持机体自身细胞的免疫耐受,而在病理状态下,它可在多种血液肿瘤和实体瘤上高表达,通过与吞噬细胞上配体的结合启动一系列抑制性的信号转导而躲避吞噬,并抑制吞噬细胞对肿瘤抗原的提呈。这是从天然免疫和适应性免疫两方面同时诱导免疫逃逸。因此,可以预期CD47是一个新的、有前景的抗肿瘤靶点。本文将从CD47的分子结构、作用机制、成药性等方面进行介绍。
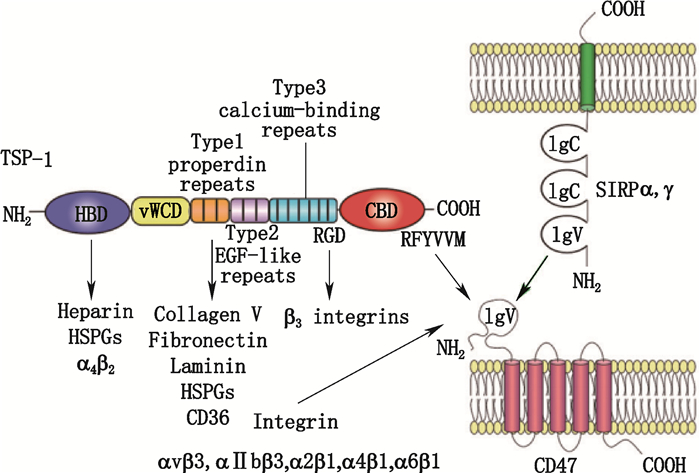
1 CD47分子结构与表达谱CD47是广泛表达于细胞膜表面的受体,属于免疫球蛋白超家族,由于最初与整合素αvβ3结合和共纯化而被发现,因此又名整合素相关蛋白(integrin-associated protein,IAP)[1-2]。其相对分子质量为5×104,胞外N端为1个IgV结构域,上面含有5个N-糖基化位点,中间为5个跨膜结构域,胞内C端是可以选择性剪接的尾部。利用酵母模型显示,翻译后修饰如糖基化对CD47锚定在细胞膜上是必需的,但糖基化是否对CD47配体结合和后续信号有影响尚不清楚[27]。因CD47胞内C端尾部含4~36个氨基酸,CD47可有4种剪接体。不同的剪接体具有不同的表达谱,其中尾部含有16个氨基酸的剪接体2表达最广泛[3],分布在几乎所有的造血细胞、内皮细胞和上皮细胞上,它以较低水平在正常细胞上表达,代表一种“自我”的信号,使自身细胞不被免疫系统识别,通过与巨噬细胞上的信号调节蛋白α(SIRPα)结合抑制巨噬细胞对自身细胞吞噬。例如在年轻的红细胞上CD47表达相对较高,而在衰老的红细胞上CD47表达下调,使得衰老的红细胞被识别和清除[4]。Kaur等[5]还发现了一种表达于Jurkat T细胞、小鼠初始T细胞、人脐静脉内皮细胞(HUVECs)上高度糖基化的CD47分子,其相对分子质量可达到2.5×105,含有肝素和硫酸软骨素粘多糖,Ser64上的这些修饰对于CD47与配体凝血酶致敏蛋白1(thrombospondin-1,TSP-1)结合,进而抑制T细胞信号转导具有重要作用。
迄今为止,人们已证实CD47在几乎所有的肿瘤细胞上高表达,并与不良预后相关[6]。Majeti和Chao等[7-10]发现CD47在急性髓细胞白血病、慢性髓细胞白血病、急性淋巴细胞白血病干细胞亚群上的表达显著高于相应的正常细胞;此外,Pang等[11]在急性髓细胞白血病和骨髓增生异常综合征中发现,疾病由低风险类型转变为高风险类型后,CD47的表达也随之增高。Chao等[12]发现CD47在多种B细胞非霍奇金淋巴瘤细胞上的表达均高于正常外周血和生发中心B细胞,包括弥漫性大B细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤等,并且CD47高表达与不良的分子标记和较差的临床预后相关。除了血液肿瘤,CD47也在多种实体瘤细胞上表达增高,如Willingham等[13]发现CD47在非小细胞肺癌组织中表达高于正常肺组织;Zhao等[14]还发现CD47表达与肿瘤分期、淋巴结转移与远端转移呈正相关;Weiskopf等[15]发现,与正常细胞相比,无论在小细胞肺癌细胞系上还是从患者体内分离的原代小细胞肺癌细胞上,无论是mRNA水平还是蛋白水平,CD47的表达量均增高;Xiao等[16]通过免疫组化染色和流式细胞染色发现,与正常肝细胞相比,肝癌细胞上的CD47过表达,且表达量高,预后差。其他高表达CD47的实体瘤还包括卵巢癌、乳腺癌、膀胱癌以及脑肿瘤等[17-20]。CD47在肿瘤细胞上的广泛的高表达使其不被吞噬,从而逃避机体免疫系统的监视,促进肿瘤生长和扩散。
2 CD47的配体CD47的配体包括SIRPα、TSP-1、整合素等(图 1),其中最受关注的是SIRPα。SIRPα是一种细胞表面糖蛋白,属于免疫球蛋白超家族,主要表达于巨噬细胞、树突状细胞和神经元上,以单体存在,胞外具有3个免疫球蛋白样结构域,最远端为1个IgV结构域,近膜端为2个IgC结构域;在胞内的尾部,具有2个免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)[21]。SIRPα胞外的IgV结构域与CD47结合后,胞内的ITIM基序上的酪氨酸磷酸化,并可结合含有SH2结构域的酪氨酸磷酸酶SHP-1和SHP-2,两者均可抑制肌球蛋白IIA在吞噬细胞突触中的集聚,进而传递抑制性信号,传递“别吃我”的信号,抑制巨噬细胞的吞噬作用,减少肿瘤坏死因子(TNF)分泌等[22]。人的SIRPα具有较高的多态性,有多种变体,如有一种剪接体只有最远端结构域为免疫球蛋白样结构域[23],小鼠的SIRPα在不同品系间也显示出多态性。SIRP家族的另外2个成员SIRPβ和SIRPγ中,只有表达于淋巴细胞和自然杀伤(NK)细胞的SIRPγ可以与CD47结合,但亲和力比SIRPα低[24-25],且其胞内段仅4个氨基酸,没有信号转导基序,不能传导信号,因此尽管SIRPγ能结合CD47,但并无生物学功能。
TSP-1是一种存在于细胞外基质中的钙结合糖蛋白,具有同源三聚体结构,存在于多种组织中,TSP-1的C末端细胞结合结构域(C-terminal cell-binding domain,CBD)可以与CD47的胞外IgV结构域结合,参与抗CD47抗体诱导的肿瘤细胞凋亡[26]。
3 靶向CD47药物在肿瘤免疫治疗中的作用机制与作用效果肿瘤细胞可通过多种方式进行免疫逃逸,其中之一便是高表达自身信号CD47。CD47在多种肿瘤细胞上的高表达和它代表的“别吃我”信号,使得靶向CD47-SIRPα相互作用作为一种可能的免疫治疗靶点,如抗CD47抗体以及SIRPα-Fc融合蛋白。抗CD47抗体可以通过多种机制清除肿瘤细胞[28]。
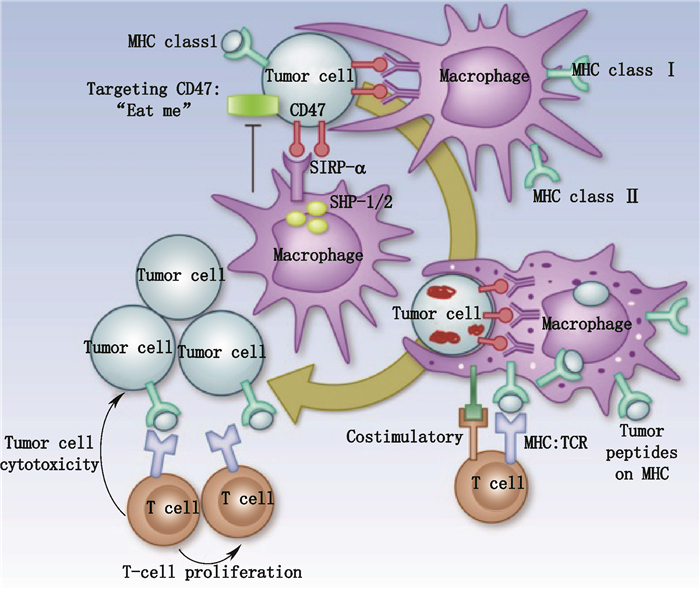
首先,抗CD47抗体可以通过阻断肿瘤细胞上的CD47与吞噬细胞上的SIRPα结合而增强吞噬细胞对各种肿瘤细胞的吞噬(见图 2),抗SIRPα抗体和SIRPα-Fc融合蛋白也可有效促进肿瘤细胞的清除,而非阻断性的抗体或融合蛋白则没有该作用。这一作用机制在多种B细胞肿瘤如弥漫大B细胞淋巴瘤、多发性骨髓瘤、急性淋巴细胞白血病、慢性淋巴细胞白血病以及非小细胞肺癌、肝癌等肿瘤中均有体外试验证实[7-8, 10, 12-13, 20, 29]。
|
图 2 靶向CD47药物的作用机制:促进巨噬细胞对肿瘤细胞吞噬及抗原提呈[32] Figure 2 The mechanism of pharmaceutical targeting CD47:promoting phagocytosis and antigen presentation of tumor cells[32] |
第二,抗CD47抗体可以通过阻断肿瘤细胞上的CD47与巨噬细胞或树突状细胞上的SIRPα结合而增强2种细胞对肿瘤细胞吞噬并加工提呈给T细胞,从而激活肿瘤细胞特异性的适应性免疫(见图 2)[30-32]。Liu等[33]发现,对C57BL/6小鼠给予MC38肿瘤负荷后,低剂量的抗鼠CD47抗体主要通过提高树突状细胞对肿瘤抗原的敏感性,增强抗原提呈功能,同时能诱导产生Ⅰ型干扰素,增强CD8+T细胞对肿瘤细胞的杀伤作用,并能产生记忆T细胞继续发挥免疫监视作用,进而保持对肿瘤细胞的持续清除,维持小鼠长期的无瘤生存。
第三,抗CD47抗体或SIRPα-Fc融合蛋白还可通过Fc效应子功能发挥作用,如抗体依赖的细胞介导的细胞毒作用(ADCC)。Kim等[34]报道过1个可以通过ADCC促进NK细胞对头颈部鳞状细胞癌细胞系杀伤的抗CD47抗体,由于NK细胞上不表达SIRPα,因此该作用应该并不是通过CD47-SIRPα途径实现的。
第四,抗CD47抗体还可通过诱导凋亡而直接清除肿瘤细胞,已有一些研究从体外和体内2个方面对抗CD47抗体的这一作用机制进行了证实[35-37],不过不同抗体的促凋亡作用有强有弱,这可能与抗体的结合位点、抗体亚型等有关。抗CD47抗体的促凋亡作用很可能需要TSP-1的参与[2, 35],其作用机制并不同于经典的凋亡途径,它不依赖于Fas介导的天冬氨酸特异的半胱氨酸蛋白酶(caspase)的激活,也没有DNA片段化等特征,主要表现为细胞皱缩,特征为肌动蛋白聚合,线粒体膜电位降低,细胞膜上磷脂酰丝氨酸(phosphatidylserine,PS)外翻等,在激活的Jurkat T细胞系和数个乳腺癌细胞系上,在TSP-1的参与下,抗CD47抗体结合肿瘤细胞上的CD47后,通过激活Gi蛋白偶联系统,抑制腺苷酸环化酶(adenyl cyclase,AC)活性,使胞内cAMP水平降低,抑制蛋白激酶A(PKA)依赖的磷酸化通路,进而促进细胞凋亡[36, 38-39]。尽管与Fas介导的细胞凋亡途径不同,但在CD47敲除的Jurkat T细胞系中,无法诱导Fas介导的细胞凋亡,说明需要CD47协同才能使Fas介导的细胞凋亡发生,其机制为CD47会影响Fas下游通路中的细胞色素C(cytochrome C)的释放,caspase的激活及DNA片段化等事件[40]。从以上可以看出,CD47可以通过多种途径参与和调节机体对肿瘤细胞的识别和清除,是一个很有潜力的抗肿瘤靶点。
目前,已有不少研究证实了拮抗CD47对肿瘤细胞的抑制作用。体外试验显示,抗CD47抗体增强巨噬细胞对多种非霍奇金淋巴瘤细胞系、小细胞肺癌细胞系、非小细胞肺癌细胞系、肝癌细胞系、乳腺癌细胞系、卵巢癌细胞系等的吞噬作用[12-13, 15-18, 29, 41-42];在NOD-SCID IL-2 receptor gamma null(NSG)小鼠模型中,通过人源细胞系接种(cell line-derived xenograft,CDX)建模可以发现,抗CD47抗体对多种肿瘤细胞系如HL-60细胞、Raji细胞、Namalwa细胞、Toledo细胞、HepG2、NCI-H1975细胞等均可产生明显的抑制作用[15-16, 43],CD47-shRNA也对A549、NCI-H1975细胞的生长产生明显的抑制作用[14];通过患者肿瘤组织接种(patient-derived xenograft,PDX)建模发现,抗CD47抗体对小细胞肺癌、肝癌、乳腺癌、结肠癌及脑胶质瘤等的生长和转移有明显抑制作用,并能延长NSG小鼠的生存期[15, 41-42]。由于抗肿瘤药物的临床有效率只有约25%,而PDX与临床药效之间具有很高的相关性,因此,PDX中的结果对于药物转化具有很强的指导性,以上结果预示着拮抗CD47分子会具有良好的抗肿瘤作用。
4 靶向CD47药物可能的不良反应靶向CD47药物最大的不良反应是对正常细胞的清除。由于CD47表达广泛,在正常细胞如红细胞、血小板、白细胞等血细胞上均表达,代表一种自身信号,保护正常细胞不被巨噬细胞清除,而肿瘤细胞上高表达CD47这种“别吃我”信号,则是逃避免疫清除的一种方式,因此,如果靶向肿瘤细胞上的CD47,很有可能会同时清除机体自身的正常细胞,如何在发挥抗肿瘤作用的同时降低或避免对正常细胞的损伤是在设计分子时需要充分考虑的问题[32]。已有体外研究显示,抗CD47抗体会结合正常红细胞,且在临床前非人灵长类动物试验中会导致贫血的发生[44]。然而,也有试验发现,另一种抗CD47抗体在清除B细胞非霍奇金淋巴瘤细胞的同时并不会清除正常的B细胞[12];此外,与正常细胞相比,2种SIRPa-Fc融合蛋白均表现出对肿瘤细胞的优势结合,并且能在不吞噬正常细胞的前提下,促进巨噬细胞对肿瘤细胞的吞噬[43]。造成这种差异的原因之一可能是肿瘤细胞上除了高表达CD47,还表达钙网织蛋白(calreticulin,crt)等促吞噬信号,而在正常细胞上并不表达这些信号,某些靶向CD47的分子在阻断CD47-SIRPα途径的同时也激活了促吞噬通路,进而诱发对肿瘤细胞的特异性吞噬[45-46];另一个可能的原因是正常细胞上CD47的表达密度低于肿瘤细胞,而这些靶向CD47的分子与CD47结合力较弱,因此不能有效交联正常细胞上的CD47,也不会引起巨噬细胞对正常细胞的吞噬。
靶向CD47药物可能的另一个不良反应是肿瘤细胞的耐药。比如肿瘤细胞上表达的CD47适应性地降低、消失或突变,甚至高表达其他的自我信号,导致靶向CD47药物无法发挥作用;或者CD47表达量增高导致原有剂量的药物无法有效发挥抗肿瘤作用,而增加剂量又会带来机体无法承受的副作用[32]。在用药过程中辨别不同的耐药机制有助于调整用药方式或开发联合用药等可行的方案,使用药效果达到最优。
5 靶向CD47药物的研发现状和应用前景目前,靶向CD47药物都处在早期阶段,全球共有3个CD47抗体项目处于临床Ⅰ期,1个处于IND阶段,4个处于临床前阶段。处于临床Ⅰ期的3个药物分别是Forty Seven的Hu5F9-G4、Celgene的CC90002以及Trillium的TTI-621[43],针对的适应症既包括血液肿瘤也包括实体瘤[47]。其中,前2个药物为完整IgG分子,后者为相对分子质量更小的SIRPα-Fc融合蛋白,仅约8×104,具有更好的组织穿透力,并且不与人红细胞结合,预示着较低的不良反应发生概率。这些研究都还处在患者招募状态,故没有临床试验结果相关的报道。国内还没有申请临床试验的CD47项目,不过已有不少企业在进行CD47靶点的药物研发。
抗CD47抗体或SIRPα-Fc融合蛋白很可能是继PD1/PD-L1、CTLA-4抗体之后,又一肿瘤免疫治疗的热点药物。与其他免疫检查点抗体相比,CD47的优势在于它几乎在所有类型的肿瘤中高表达,因此应用范围广。另外,靶向CD47的作用机制多样化,既可以作用于天然免疫系统,促进巨噬细胞对肿瘤细胞的吞噬;又可以作用于适应性免疫系统,通过增强树突状细胞对肿瘤抗原的提呈,促进T细胞对肿瘤细胞的特异性杀伤;还可以直接诱导肿瘤细胞的凋亡,这些交互的作用机制使得靶向CD47药物表现出良好的抗肿瘤效果[47-49]。此外,已有研究在探索联合用药的可能性和可行性,利用作用机制的互补,达到最大的抗肿瘤疗效[31]。例如某抗CD47抗体以阻断CD47-SIRPα进而促进吞噬作用为主,则可与抗CD20、抗HER2抗体等具有抑制肿瘤生长、ADCC等作用的抗体联合用药;已有研究显示,在NSG小鼠中构建的非霍奇金淋巴瘤PDX,采用抗CD47抗体与抗CD20单抗联合用药治疗,结果显示出了优越的肿瘤清除效果,能达到治愈肿瘤的程度,并抑制了肿瘤的复发[12, 50]。与单独用药相比,抗CD47抗体与抗HER2抗体联合应用也使小鼠乳腺肿瘤包块的体积显著减小[51]。与其他抗体、传统放化疗等的联合治疗也在积极探索中,通过增强抗原提呈并激活特异性抗肿瘤T细胞等途径而发挥抗肿瘤作用[33, 42, 52]。
如上所述,体外试验和动物试验显示,靶向CD47药物能通过天然免疫和适应性免疫等途径发挥广泛而有效的抗肿瘤作用,如果后续的临床试验数据能支持前期结果,显示出对肿瘤较好抑制和清除效果,同时不良反应又在可控的范围内,那么CD47将是一个非常有前景和吸引力的免疫检查点靶点。
| [1] |
BROWN EJ, FRAZIER WA. Integrin-associated protein(CD47) and its ligands[J]. Trends Cell Biol, 2001, 11(3): 130. DOI:10.1016/S0962-8924(00)01906-1 |
| [2] |
OLDENBORG PA. CD47:a cell surface glycoprotein which regulates multiple functions of hematopoietic cells in health and disease[J]. ISRN Hematol, 2013, 614619. DOI:10.1155/2013/614619 |
| [3] |
REINHOLD MI, LINDBERG FP, PLAS D, et al. In vivo expression of alternatively spliced forms of integrin-associated protein(CD47)[J]. J Cell Sci, 1995, 108(Pt 11): 3419. |
| [4] |
OLDENBORG PA. Role of CD47 as a marker of self on red blood cells[J]. Science, 2000, 288(5473): 2051. DOI:10.1126/science.288.5473.2051 |
| [5] |
KAUR S, KUZNETSOVA SA, PENDRAK ML, et al. Heparan sulfate modification of the transmembrane receptor CD47 is necessary for inhibition of T cell receptor signaling by thrombospondin-1[J]. J Biol Chem, 2011, 286(17): 14991. DOI:10.1074/jbc.M110.179663 |
| [6] |
LIU X, KWON H, LI Z, et al. Is CD47 an innate immune checkpoint for tumor evasion?[J]. J Hematol Oncol, 2017, 10(1): 12. DOI:10.1186/s13045-016-0381-z |
| [7] |
MAJETI R, CHAO MP, ALIZADEH AA, et al. CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells[J]. Cell, 2009, 138(2): 286. DOI:10.1016/j.cell.2009.05.045 |
| [8] |
CHAO MP, ALIZADEH AA, TANG C, et al. Therapeutic antibody targeting of CD47 eliminates human acute lymphoblastic leukemia[J]. Cancer Res, 2011, 71(4): 1374. DOI:10.1158/0008-5472.CAN-10-2238 |
| [9] |
CURRAN E, CORRALES L, KLINE J. Targeting the innate immune system as immunotherapy for acute myeloid leukemia[J]. Front Oncol, 2015, 5: 83. |
| [10] |
JAISWAL S, JAMIESON CH, PANG WW, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138(2): 271. DOI:10.1016/j.cell.2009.05.046 |
| [11] |
PANG WW, PLUVINAGE JV, PRICE EA, et al. Hematopoietic stem cell and progenitor cell mechanisms in myelodysplastic syndromes[J]. Proc Natl Acad Sci USA, 2013, 110(8): 3011. DOI:10.1073/pnas.1222861110 |
| [12] |
CHAO MP, ALIZADEH AA, TANG C, et al. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010, 142(5): 699. DOI:10.1016/j.cell.2010.07.044 |
| [13] |
ZHANG X, FAN J, WANG S, et al. Targeting CD47 and autophagy elicited enhanced antitumor effects in non-small cell lung cancer[J]. Cancer Immunol Res, 2017, 5(5): 363. DOI:10.1158/2326-6066.CIR-16-0398 |
| [14] |
ZHAO H, WANG J, KONG X, et al. CD47 promotes tumor invasion and metastasis in non-small cell lung cancer[J]. Sci Rep, 2016, 6: 29719. DOI:10.1038/srep29719 |
| [15] |
WEISKOPF K, JAHCHAN NS, SCHNORR PJ, et al. CD47-blocking immunotherapies stimulate macrophage-mediated destruction of small-cell lung cancer[J]. J Clin Invest, 2016, 126(7): 2610. DOI:10.1172/JCI81603 |
| [16] |
XIAO Z, CHUNG H, BANAN B, et al. Antibody mediated therapy targeting CD47 inhibits tumor progression of hepatocellular carcinoma[J]. Cancer Lett, 2015, 360(2): 302. |
| [17] |
KAUR S, ELKAHLOUN AG, SINGH SP, et al. A function-blocking CD47 antibody suppresses stem cell and EGF signaling in triple-negative breast cancer[J]. Oncotarget, 2016, 7(9): 10133. |
| [18] |
LI Y, LU S, XU Y, et al. Overexpression of CD47 predicts poor prognosis and promotes cancer cell invasion in high-grade serous ovarian carcinoma[J]. Am J Transl Res, 2017, 9(6): 2901. |
| [19] |
GHOLAMIN S, MITRA SS, FEROZE AH, et al. Disrupting the CD47-SIRPα anti-phagocytic axis by a humanized anti-CD47 antibody is an efficacious treatment for malignant pediatric brain tumors[J]. Sci Transl Med, 2017, 9(381): pii:eaaf2968. DOI:10.1126/scitranslmed.eaaf2968 |
| [20] |
CHAN KS, ESPINOSA I, CHAO M, et al. Identification, molecular characterization, clinical prognosis, and therapeutic targeting of human bladder tumor-initiating cells[J]. Proc Natl Acad Sci USA, 2009, 106(33): 14016. DOI:10.1073/pnas.0906549106 |
| [21] |
FUJIOKA Y, MATOZAKI T, NOGUCHI T, et al. A novel membrane glycoprotein, SHPS-1, that binds the SH2-domain-containing protein tyrosine phosphatase SHP-2 in response to mitogens and cell adhesion[J]. Mol Cell Biol, 1996, 16(12): 6887. DOI:10.1128/MCB.16.12.6887 |
| [22] |
TSAI RK, DISCHER DE. Inhibition of "self" engulfment through deactivation of myosin-Ⅱ at the phagocytic synapse between human cells[J]. J Cell Biol, 2008, 180(5): 989. DOI:10.1083/jcb.200708043 |
| [23] |
VEILLETTE A, THIBAUDEAU E, LATOUR S. High expression of inhibitory receptor SHPS-1 and its association with protein-tyrosine phosphatase SHP-1 in macrophages[J]. J Biol Chem, 1998, 273(35): 22719. DOI:10.1074/jbc.273.35.22719 |
| [24] |
BROOKE G, HOLBROOK JD, BROWN MH, et al. Human lymphocytes interact directly with CD47 through a novel member of the signal regulatory protein(SIRP) family[J]. J Immunol, 2004, 173(4): 2562. DOI:10.4049/jimmunol.173.4.2562 |
| [25] |
SEIFFERT M. Signal-regulatory protein alpha(SIRPalpha) but not SIRPbeta is involved in T-cell activation, binds to CD47 with high affinity, and is expressed on immature CD34+CD38- hematopoietic cells[J]. Blood, 2001, 97(9): 2741. DOI:10.1182/blood.V97.9.2741 |
| [26] |
GAO AG, LINDBERG FP, DIMITRY JM, et al. Thrombospondin modulates alpha v beta 3 function through integrin-associated protein[J]. J Cell Biol, 1996, 135(2): 533. DOI:10.1083/jcb.135.2.533 |
| [27] |
SICK E, JEANNE A, SCHNEIDER C, et al. CD47 update:a multifaceted actor in the tumour microenvironment of potential therapeutic interest[J]. Br J Pharmacol, 2012, 167(7): 1415. DOI:10.1111/j.1476-5381.2012.02099.x |
| [28] |
ZHANG L, HUANG H. Targeting the cancer biomarker CD47:a review on the diverse mechanisms of the CD47 pathway in cancer treatment[J]. Anticancer Agents Med Chem, 2016, 16(6): 658. DOI:10.2174/1871520615666151008123223 |
| [29] |
XIAO Z, CHUNG H, BANAN B, et al. Antibody mediated therapy targeting CD47 inhibits tumor progression of hepatocellular carcinoma[J]. Cancer Lett, 2015, 360(2): 302. |
| [30] |
LATOUR S, TANAKA H, DEMEURE C, et al. Bidirectional negative regulation of human T and dendritic cells by CD47 and its cognate receptor signal-regulator protein-alpha:down-regulation of IL-12 responsiveness and inhibition of dendritic cell activation[J]. J Immunol, 2001, 167(5): 2547. DOI:10.4049/jimmunol.167.5.2547 |
| [31] |
CHAO MP, WEISSMAN IL, MAJETI R. The CD47-SIRPalpha pathway in cancer immune evasion and potential therapeutic implications[J]. Curr Opin Immunol, 2012, 24(2): 225. DOI:10.1016/j.coi.2012.01.010 |
| [32] |
MCCRACKEN MN, CHA AC, WEISSMAN IL. Molecular pathways:activating T cells after cancer cell phagocytosis from blockade of CD47 "Don't Eat Me" signals[J]. Clin Cancer Res, 2015, 21(16): 3597. DOI:10.1158/1078-0432.CCR-14-2520 |
| [33] |
LIU X, PU Y, CRON K, et al. CD47 blockade triggers T cell-mediated destruction of immunogenic tumors[J]. Nat Med, 2015, 21(10): 1209. DOI:10.1038/nm.3931 |
| [34] |
MIN JK, LEE JC, LEE JJ, et al. Association of CD47 with natural killer cell-mediated cytotoxicity of head-and-neck squamous cell carcinoma lines[J]. Tumour Biol, 2008, 29(1): 28. DOI:10.1159/000132568 |
| [35] |
MANNA PP, FRAZIER WA. CD47 mediates killing of breast tumor cells via Gi-dependent inhibition of protein kinase A[J]. Cancer Res, 2004, 64(3): 1026. |
| [36] |
MATEO V, LAGNEAUX L, BRON D, et al. CD47 ligation induces caspase-independent cell death in chronic lymphocytic leukemia[J]. Nat Med, 1999, 5(11): 1277. DOI:10.1038/15233 |
| [37] |
UNO S, KINOSHITA Y, AZUMA Y, et al. Antitumor activity of a monoclonal antibody against CD47 in xenograft models of human leukemia[J]. Oncol Rep, 2007, 17(5): 1189. |
| [38] |
FRAZIER WA, GAO A-G, DIMITRY J, et al. The thrombospondin receptor integrin-associated protein(CD47) functionally couples to heterotrimeric Gi[J]. J Biol Chem, 1999, 274(13): 8554. DOI:10.1074/jbc.274.13.8554 |
| [39] |
PETTERSEN RD, HESTDAL K, OLAFSEN MK, et al. CD47 signals T cell death[J]. J Immunol, 1999, 162(12): 7031. |
| [40] |
MANNA PP, DIMITRY J, OLDENBORG PA, et al. CD47 augments Fas/CD95-mediated apoptosis[J]. J Biol Chem, 2005, 280(33): 29637. DOI:10.1074/jbc.M500922200 |
| [41] |
CHROSCINSKI D, MAHERALI N, GRINER E, et al. The CD47-signal regulated protein alpha(SIRPα) interaction is a therapeutic target for human solid tumors[J]. Proc Natl Acad Sci USA, 2012, 109(17): 6662. DOI:10.1073/pnas.1121623109 |
| [42] |
LO J, LAU EY, SO FT, et al. Anti-CD47 antibody suppresses tumour growth and augments the effect of chemotherapy treatment in hepatocellular carcinoma[J]. Liver Int, 2016, 36(5): 737. DOI:10.1111/liv.12963 |
| [43] |
PETROVA PS, VILLER NN, WONG M, et al. TTI-621(SIRPalphaFc):a CD47-blocking innate immune checkpoint inhibitor with broad antitumor activity and minimal erythrocyte binding[J]. Clin Cancer Res, 2017, 23(4): 1068. DOI:10.1158/1078-0432.CCR-16-1700 |
| [44] |
LIU J, WANG L, ZHAO F, et al. Pre-clinical development of a humanized anti-CD47 antibody with anti-cancer therapeutic potential[J]. PLoS One, 2015, 10(9): e0137345. DOI:10.1371/journal.pone.0137345 |
| [45] |
CHAO MP, JAISWAL S, WEISSMAN-TSUKAMOTO R, et al. Calreticulin is the dominant pro-phagocytic signal on multiple human cancers and is counterbalanced by CD47[J]. Sci Transl Med, 2010, 2(63): 6394. |
| [46] |
CHEN J, ZHONG MC, GUO H, et al. SLAMF7 is critical for phagocytosis of haematopoietic tumour cells via Mac-1 integrin[J]. Nature, 2017, 544(7651): 493. DOI:10.1038/nature22076 |
| [47] |
WEISKOPF K. Cancer immunotherapy targeting the CD47/SIRPalpha axis[J]. Eur J Cancer, 2017, 76: 100. DOI:10.1016/j.ejca.2017.02.013 |
| [48] |
RATNIKOVA NM, LEZHNIN YN, FROLOVA EI, et al. CD47 receptor as a primary target for cancer therapy[J]. Mol Biol(Mosk), 2017, 51(2): 251. DOI:10.1134/S0026893317020133 |
| [49] |
MATLUNG HL, SZILAGYI K, BARCLAY NA T, et al. The CD47-SIRPalpha signaling axis as an innate immune checkpoint in cancer[J]. Immunol Rev, 2017, 276(1): 145. DOI:10.1111/imr.2017.276.issue-1 |
| [50] |
PICCIONE EC, JUAREZ S, LIU J, et al. A bispecific antibody targeting CD47 and CD20 selectively binds and eliminates dual antigen expressing lymphoma cells[J]. MAbs, 2015, 7(5): 946. DOI:10.1080/19420862.2015.1062192 |
| [51] |
ZHAO XW, van BEEK EM, SCHORNAGEL K, et al. CD47-signal regulatory protein-α(SIRPα) interactions form a barrier for antibody-mediated tumor cell destruction[J]. Proc Natl Acad Sci USA, 2011, 108(45): 18342. DOI:10.1073/pnas.1106550108 |
| [52] |
LO J, LAU EY, CHING RH, et al. Nuclear factor kappa B-mediated CD47 up-regulation promotes sorafenib resistance and its blockade synergizes the effect of sorafenib in hepatocellular carcinoma in mice[J]. Hepatology, 2015, 62(2): 534. DOI:10.1002/hep.v62.2 |
 2018, Vol. 38
2018, Vol. 38