甲苯咪唑(mebendazole,CAS No.31431-39-7),苯并咪唑类药物,又名甲苯达唑,1971年由VanGelDev首次化学合成,并获得美国专利,比利时杨森(Janssen)公司同年投入临床,原研药商品名Vermox,首先在美国、加拿大应用,以后在亚洲、非洲各国广泛用于肠道线虫病的治疗。我国于1976年开始生产,1990年版《中华人民共和国药典》(简称中国药典)开始收录甲苯咪唑原料和片剂。目前国内市场上常见制剂为甲苯咪唑片和咀嚼片,主要用于治疗蛲虫、蛔虫、鞭虫、十二指肠钩虫、粪类圆线虫和绦虫的单独感染及混合感染。甲苯咪唑作为一种广谱、高效的驱虫药,是我国常用药物,亦被世界卫生组织(WHO)基本药物清单收录[1-2]。
通过查询国家食品药品监督管理总局数据,全国甲苯咪唑片有7家生产企业7个批准文号,规格均为0.1 g;甲苯咪唑咀嚼片有3家生产企业和4个批准文号,规格有0.1 g和0.2 g。甲苯咪唑被中国药典及多国药典(BP、EP、USP、IP)收载[3-7]。国家食品药品监督管理总局将甲苯咪唑片和咀嚼片列入2016年度全国药品质量评价性抽验计划,本次抽样共完成74批次甲苯咪唑片和2批次甲苯咪唑咀嚼片的法定标准检验。在全面系统地分析国产甲苯咪唑片和咀嚼片生产工艺和质量标准的基础上,结合调研情况及收集到的国内外样品,开展了一系列探索性研究。以甲苯咪唑片和咀嚼片的晶型、有关物质和溶出度为考察指标,研究甲苯咪唑片和咀嚼片的安全性、有效性与稳定性,通过产品质量研究与分析,使各企业对产品自身质量状况有较全面的了解,为企业提高产品质量提供改进方向,也为标准完善提供依据。
1 仪器和试药 1.1 仪器AVATAR 360红外分光光度计(美国尼高力仪器公司);Thermo SMART SPECUL ATR傅立叶变换红外光谱仪(美国热电公司);LabRAM ARAMIS共焦显微拉曼光谱仪(法国HORIBA公司);X’Pert3 Powder X-射线粉末衍射仪(荷兰Panalytical公司);Waters Acquity UPLC H-Class/Waters Xevo G2 XS QTof MS高分辨液质联用系统(美国沃特世公司);Waters e2695高效液相色谱系统(美国沃特世公司);Agilent 1260高效液相色谱系统(美国安捷伦公司);RC8MD溶出试验仪(天津天大天发公司)。
1.2 试药甲苯咪唑对照品(批号41112,纯度99.5%)购自Dr.Ehrenstorfer GmbH。水为重蒸水,甲醇、乙腈为色谱纯(Merck公司),其他试剂均为分析纯(国药集团化学试剂有限公司)。1#甲苯咪唑片(规格100 mg,参比制剂),批号151222384;2#甲苯咪唑咀嚼片(规格100 mg),批号130901;3#甲苯咪唑咀嚼片(规格100 mg),批号140601;4#甲苯咪唑咀嚼片(规格100 mg),批号140901;5#甲苯咪唑咀嚼片(规格100 mg),批号140501;6#甲苯咪唑咀嚼片(规格100 mg),批号140502;7#甲苯咪唑咀嚼片(规格200 mg),批号1820160102;8#甲苯咪唑咀嚼片(规格:200 mg),批号1820160103。
2 试验方法 2.1 制剂晶型的研究文献报道[8-11]甲苯咪唑具有A、B、C 3种晶型,其热力学稳定性A > C > B;C晶为临床所青睐的有效晶型,A晶无效,B晶疗效待证,一定条件下有效C晶会转化为无效A晶,微量的A晶能够加速C晶向A晶转化。生产过程及储存条件不当可能导致转晶,因此有必要进行制剂中甲苯咪唑的晶型考察。通过探索分析,利用原辅料溶解度的差异,建立了水洗后减压干燥的样品前处理方法,同时对甲苯咪唑晶型纯品也进行相同前处理,证明水洗后的晶型与直接压片后的晶型无明显差异。采用红外光谱法,鉴别甲苯咪唑制剂中的晶型,并通过X射线衍射法、衰减全反射和拉曼光谱验证红外结果。
2.2 有关物质、溶出度及含量测定参照BP 2014年版甲苯咪唑原料有关物质检查项方法,进行条件优化后,以乙腈-0.75%醋酸铵溶液为流动相,梯度洗脱的方法测定甲苯咪唑片和咀嚼片有关物质及含量。
2.3 溶出度研究甲苯咪唑难溶于水,生物药剂学分类为BCSⅡ类,其不同晶型在一定的溶出介质中溶出行为不同,利用其溶出行为的差异可以对晶型做初步判断[12-14]。甲苯咪唑咀嚼片的使用对象以少年儿童居多,而小儿的咀嚼依从性不高,咀嚼程度各异,考察咀嚼片的溶出度可以为企业优化产品提供参考数据。参照中国药典2015年版溶出度测定方法,采用溶出度测定法第二法桨法(中国药典2015版通则0931),分别采用溶出介质Ⅰ(0.1 mol·L-1盐酸溶液)和溶出介质Ⅱ(含1%十二烷基硫酸钠的0.01 mol·L-1盐酸溶液),测定甲苯咪唑片和咀嚼片的溶出曲线。
2.4 包材与药品稳定性相关性研究为考察各企业产品的稳定性,采用高温高湿条件对各样品进行试验。此次抽验的4个企业中1个生产企业为铝塑泡罩包装,2个生产企业为PET/AL/PE复合膜包装包装,1个生产企业为塑料袋包装。将产品分别置于60 ℃/RH90%的环境中,放置10 d;采用“2.1”、“2.2、“2.3”项方法,分析样品晶型、有关物质及溶出度,考察储存条件和包装材料对样品质量的影响。
3 结果与讨论 3.1 制剂晶型研究据文献报道[8-9],晶型A、C分别对应甲苯咪唑氨基-亚氨基互变异构体,X射线衍射法的2θ特征衍射峰分别为7.7°和4.9°,红外光谱中的特征波数分别为3 370 cm-1和3 410 cm-1,拉曼光谱中分别表现为6个特征峰和4个特征峰[9, 13, 15]。结果显示,国产样品2θ特征衍射峰均为4.9°,红外特征波数均为3 410 cm-1,拉曼光谱中呈现4个特征峰;而部分国外样品2θ特征衍射峰为7.7°,红外特征波数为3 368 cm-1,拉曼光谱中呈现6个特征峰。表明所有国产样品均为有效C晶型,未发现A、B晶型;部分国外样品为无效A晶型。
3.2 甲苯咪唑制剂杂质谱研究甲苯咪唑片、咀嚼片现行质量标准中无有关物质检查项,仅甲苯咪唑原料标准采用薄层色谱法对有关物质进行检查,而国外药典(EP 8.0、USP 37)采用高效液相法控制了原料中的7个杂质(A~G)。针对国内的原料合成工艺和制剂工艺,参考国外药典中有关物质的控制方法,采用十八烷基硅烷键合硅胶为填充剂(BDS HYPERSIL C18,100 mm×4.6 mm,3 μm),柱温40 ℃,乙腈-0.75%醋酸铵溶液梯度洗脱,流速1.2 mL·min-1,检测波长250 nm测定甲苯咪唑的7种已知杂质。使用甲苯咪唑对照品碱破坏溶液作为系统适用性溶液,避免购买价格昂贵的杂质对照品,既方便快捷又经济实用。采用该方法分析甲苯咪唑制剂中的有关物质,各杂质分离度好,专属性高。探索性检验结果表明,有关物质含量总体情况较好,含量在0.07%~0.41%之间,其中降解产物杂质A是最主要的杂质来源,含量在0.02%~0.2%之间,其它的有关物质均低于0.1%。
3.3 溶出度研究甲苯咪唑片现行质量标准溶出度检验方法对不同晶型区分力较弱,测定溶出量时所用的氨基柱易损耗,检验成本较高,现行检验方法有改进和提升的空间。甲苯咪唑咀嚼片现行质量标准无溶出度检查项。
日本橙皮书中收载的甲苯咪唑在不同pH介质中溶解度(37 ℃)分别是121 μg·mL-1(pH 1.2)、1 μg·mL-1(pH 4.0)、2 μg·mL-1(pH 6.8)、3 μg·mL-1(水)。由于甲苯咪唑在pH 4.0和pH 6.8及水中难溶,故选择pH 1.0溶出介质进行优化。甲苯咪唑溶解度试验表明,0.1 mol·L-1盐酸中A、C晶型溶解度分别为13、120 μg·mL-1,晶型C溶解度远大于晶型A;而在含有1%十二烷基硫酸钠的0.01 mol·L-1盐酸中,A、C晶型溶解度分别为700、330 μg·mL-1,晶型C溶解度低于晶型A;提示0.1 mol·L-1盐酸对甲苯咪唑不同晶型有一定区分力。
由于甲苯咪唑溶解行为的特殊性,规格成为溶出度试验的影响因素,100 mg的甲苯咪唑制剂适用于0.1 mol·L-1盐酸溶液的溶出介质,而高于100 mg的甲苯咪唑制剂须采用含1%十二烷基硫酸钠的0.01 mol·L-1的盐酸溶液作为溶出介质,才能保证甲苯咪唑完全溶解。含1%十二烷基硫酸钠的0.01 mol·L-1的盐酸溶液虽不具晶型指证作用,但可比较不同产品生产工艺的差异。
采用拟定条件进行探索性试验,在2种溶出介质中,参比制剂均完全溶出,部分受试制剂甲苯咪唑咀嚼片呈现极低溶出量,而晶型鉴别结果显示均为有效C晶,进一步考察崩解时限,发现受试制剂120 min内也无法完全崩解,提示咀嚼片的处方及生产工艺与参比制剂存在差异,释放结果见图 1。
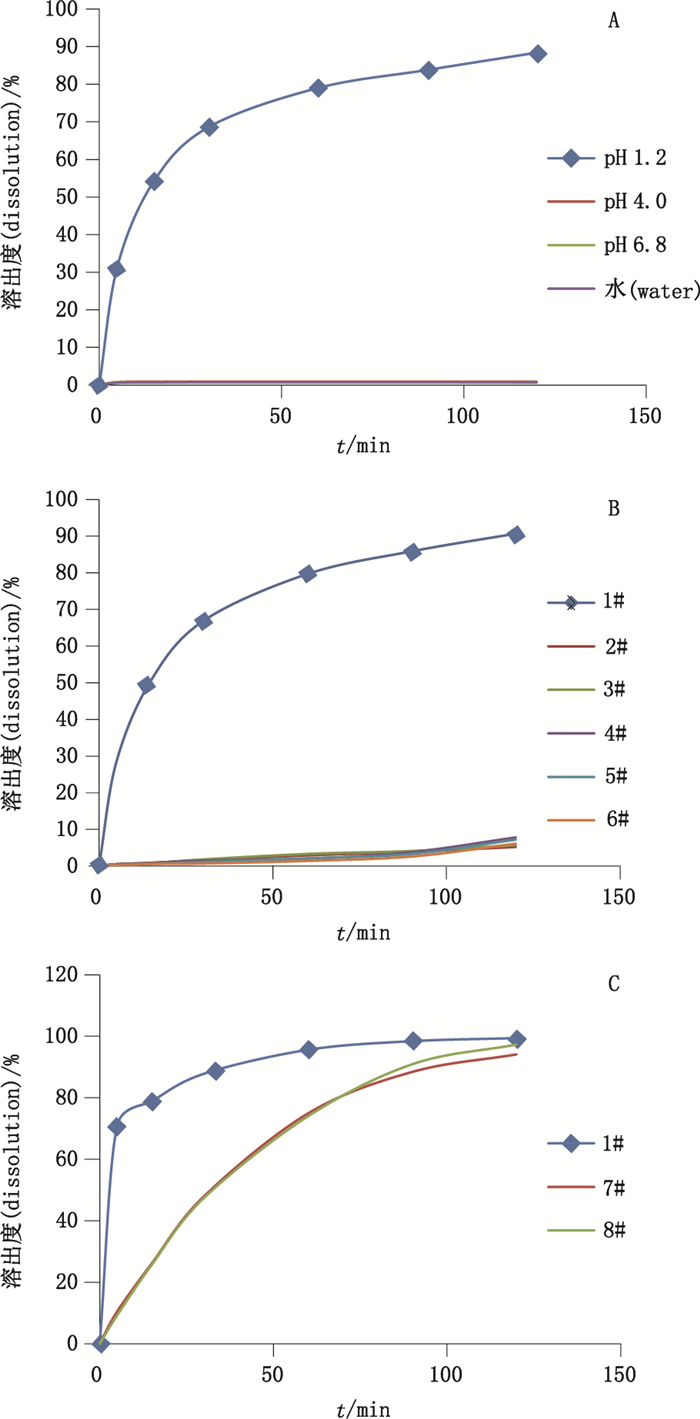
|
A.参比制剂在4种释放介质中(reference preparation in four release mediums) B.1批甲苯咪唑片(1#参比)和5批甲苯咪唑咀嚼片(100 mg)在0.1 mol·L-1盐酸释放介质中(1 batches of Mebendazole tablets(1#reference)and 5 batches of chewable mebendazole tablets(100 mg)in 0.1 mol·L-1 hydrochloric acidsolution) C.1批甲苯咪唑片(1#参比)和2批甲苯咪唑咀嚼片(200 mg)在1%SDS的0.01 mol·L-1盐酸释放介质中(1 batches of Mebendazole tablets(1#reference)and 2 batches of chewable Mebendazole tablets(200 mg)in 0.01 mol·L-1 hydrochloric acid solution with 1%SDS) 图 1 平均释放曲线图 Figure 1 The average release curves |
高温高湿试验中,铝塑包装和PET/AL/PE复合膜的产品片型保持完好,而塑料袋包装的咀嚼片发生了严重粘片,说明包装防潮功能不足,致使以蔗糖为主要辅料的咀嚼片发生了严重的吸湿。试验结果显示,高温高湿环境下各企业产品均有转晶趋势,高温高湿会导致有效C晶转变为无效A晶;相比样品初始杂质含量,高温高湿试验中,各企业样品的总杂质含量增加5~6倍,主要杂质均来自于降解杂质A;随放置时间的延长,溶出曲线降低,这与甲苯咪唑晶型转变及辅料变化有关。试验结果提示,企业应注意控制甲苯咪唑制剂生产及流通过程中的温湿度,采用防潮包装,减少甲苯咪唑的转晶、降解等变化,以保证产品的安全有效。高温温湿对溶出度影响见图 2。
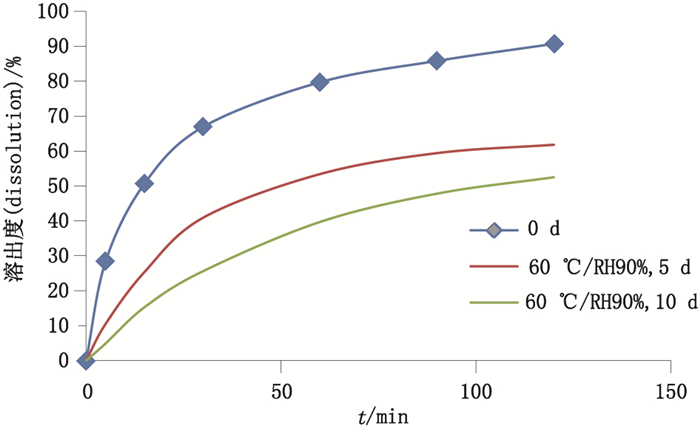
|
图 2 高温高湿试验参比制剂溶出度测定结果 Figure 2 Dissolution results of reference preparation in high temperature and humidity study |
本次评价性抽验采用法定检验结合探索性研究的模式,对甲苯咪唑片和咀嚼片从标准到质量现状及质量影响因素等各方面进行了较为全面的分析和评价。
研究结果表明:所有国产样品均为有效的C晶型,有关物质含量0.07%~0.41%,主要杂质为降解杂质A,片剂溶出结果合格并相对一致,咀嚼片溶出行为存在差异,高温高湿使产品转晶,有关物质增多,溶出度降低,提示生产企业应注意包装的防潮性。目前国外甲苯咪唑咀嚼片均为可咀嚼也可吞服,表明国际产品充分考虑到患者咀嚼程度的差异,而国产甲苯咪唑咀嚼片缺乏溶出度考察,可能影响产品有效性,建议企业结合原辅料和生产工艺考察溶出度,提高产品质量,与国际接轨。
| [1] |
中华人民共和国药典委员会. 中华人民共和国药典临床用药须知[M]. 北京: 中国医药科技出版社, 2010, 1442. Chinese Phamacopoiea Committee. ChP the Notice of Drugs in Clinical Use[M]. Beijing: China Medical Science Press, 2010, 1442. |
| [2] |
殷为勇, 郑荣远, 朱振国, 等. 甲苯咪唑的研发、市场与临床应用[J]. 中国现代应用药学, 2008, 25(4): 301. YIN WY, ZHENG RY, ZHU ZG, et al. Research marketing and clinical application of mebendazole[J]. Chin J Mod Appl Pharm, 2008, 25(4): 301. |
| [3] |
中华人民共和国药典2015年版. 二部[S]. 2015: 200 ChP 2015. VolⅡ[S]. 2015: 200 |
| [4] |
BP 2014[S]. 2014: Ⅱ-193
|
| [5] |
EP 8. 0[S]. 2014: 2696
|
| [6] |
USP 37[S]. 2014: 3657
|
| [7] |
IP 6[S]. 2016
|
| [8] |
ALINE Q, PENNA G, TASSIA H, et al. Evaluation and study of mebendazole polymorphs present in raw materials and tablets available in the Brazilian pharmaceutical market[J]. J App Pharm Sci, 2014, 4(11): 001. |
| [9] |
MARIUS B, WILNA L, MELGARDT M. Characterization of polymorph transformations that decrease the stability of tablets containing the WHO essential drug mebendazole[J]. J Pharm Sci, 2010, 99(3): 1138. DOI:10.1002/jps.21899 |
| [10] |
OLIMPIA M, MARIA E, JENNIFER T, et al. Polymorphism:an evaluation of the potential risk to the quality of drug products from the Farmácia Popular RedePrópria[J]. Braz J Pharm Sci, 2014, 55(1): 1. |
| [11] |
庞庆林, 袁耀佐, 张玫, 等. 国产利福平口服制剂质量评价[J]. 药物分析杂志, 2011, 31(10): 1862. PANG QL, YUAN YZ, ZHANG M, et al. Assessment the quality of domestic rifampicin for oral preparation[J]. Chin J Pharm Anal, 2011, 31(10): 1862. |
| [12] |
ERNA S, WILNA L, MELGARDT M. Quality evaluation of generic drugs by dissolution test:changing the USP dissolution medium to distinguish between active and non-active mebendazole polymorphs[J]. Eur J Pharm Biopharm, 2003, 55(3): 345. DOI:10.1016/S0939-6411(03)00004-3 |
| [13] |
SARA B, SILVIA F, ARNALDO V, et al. Polymorphism evaluation in generic tablets containing mebendazole by dissolution tests[J]. Braz Chem Soc, 2012, 23(2): 220. |
| [14] |
刘洁, 刘辉. 阿司匹林肠溶片质量研究与分析[J]. 药物分析杂志, 2015, 35(12): 2187. LIU J, LIU H. Quality evaluation and analysis of domestic aspirin enteric-coated tablets[J]. Chin J Pharm Anal, 2015, 35(12): 2187. |
| [15] |
NATALIA L, TEODORO S, RUBEN M. Mebendazole crystal forms in tablet formulations.An ATR-FTIR/chemometrics approach to polymorph assignment[J]. J Pharm Biomed Anal, 2016, 122(1): 157. |
 2018, Vol. 38
2018, Vol. 38 