2. 安徽省食品药品检验研究院, 合肥 230051
2. Anhui Institute of Food and Drug Control, Hefei 230051, China
橘络又名橘丝、橘筋,来源于芸香科植物橘Citrus reticulata Blanco及其栽培变种干燥果皮内层筋络;其味甘、苦,平。归肝、脾经。橘络具通络、理气、化痰的功效。主治经络气滞,久嗽胸痛,痰中带血,伤酒口渴等症。橘络应用历史悠久,《本草求原》 《纲目拾遗》《本草便读》等医书中均有记载[1-2];现代也常被配方使用。目前《中华人民共和国药典》(简称中国药典)2015年版一部未收载橘络,各省市的炮制规范中的质量标准也较为简单,《安徽省中药饮片炮制规范》2005年版中橘络质量标准仅收载性状鉴别项,缺少对药效成分的定性、定量测定,难以控制其内在质量。因此,有必要建立更为完善的橘络药材质量标准,有利于对药材质量进行有效的控制。文献报道橘络含有黄酮类成分最多,主要为橙皮苷[3-4];橙皮苷具有广泛的药理活性,如抗炎,抗菌,调节免疫力,防辐射,保护心血管系统等方面的药理作用[5-6]。因此本文以橙皮苷作为橘络含量测定的指标性成分。本文参考部分文献[7-10],首次建立了橘络药材完善的质量控制方法和标准,包括薄层色谱鉴别、水分、总灰分、浸出物和含量测定等方面,并对10批不同产地的橘络进行了测定,制定了合理的限度,为完善其质量控制标准提供了方法和依据,以期收入新版《安徽省中药饮片炮制规范》,成为新的地方标准[11]。
1 试验材料Waters e2695高效液相色谱仪;C18色谱柱(250mm×4.6 mm,5 µm;填料:十八烷基硅烷键合硅胶,安捷伦公司),电子天平(METTLER AB265-S),光学显微镜(LEICA DM750),全自动薄层点样仪(CAMAG Linomat-5),硅胶G薄层板,双槽展开缸,橙皮苷(购自中国食品药品检定研究院,批号110721-201115,含量95.3%,使用前无需处理),乙腈为色谱纯,其他试剂为分析纯。10批橘络经安庆市食品药品检验中心杨积慧主任中药师鉴定为芸香科植物橘Citrus reticulata Blanco及其栽培变种干燥果皮内层筋络。样品采集信息详见表 1。
|
|
表 1 橘络样品采集信息 Table 1 Sample collection information for Retinervus Citri Furctus |
取橘络粉末(过2号筛)0.5 g,加甲醇10 mL,超声处理30 min,滤过,滤液浓缩至约1 mL,即得。
2.1.2 对照品溶液制备取橙皮苷对照品,加甲醇制成饱和溶液[12],即得。
2.1.3 点样、展开、显色和检视照薄层色谱法(中国药典2015年版四部通则0502)[12]试验,吸取上述2种溶液各2 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(3:1:0.1)为展开剂,展开,取出,晾干,喷以1%三氯化铝乙醇溶液,置紫外光灯(365 nm)下检视。10批橘络样品色谱中,在与对照品色谱相应的位置上显相同颜色的荧光斑点,实验结果见图 1。
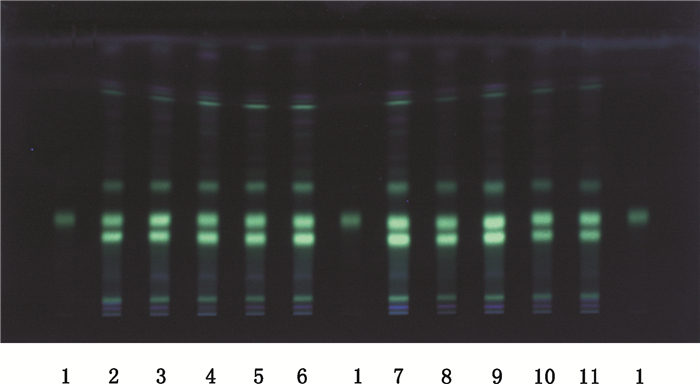
|
1.橙皮苷对照品(standard of hesperidin) 2~11.橘络样品(samples of Retinervus Citri Furctus) 图 1 橘络TLC鉴别图谱 Figure 1 TLC of Retinervus Citri Furctus |
取各批次橘络粉末2~3 g,平行实验2份,精密称定,照2015年版中国药典四部(通则0832第二法)[13]测定,10批橘络水分结果见表 2。
|
|
表 2 橘络水分、总灰分、浸出物和橙皮苷含量测定结果(%,n=2) Table 2 Results of water content, total ash, ethanol soluble extractives and hesperidin content of Retinervus Citri Furctus |
取各批次橘络粉末(过2号筛)2~3 g,平行实验2份,精密称定,照2015年版中国药典四部(通则2302总灰分测定法)[13]测定,10批橘络总灰分结果见表 2。
2.3 浸出物取各批次橘络粉末(过2号筛)2~4 g,平行实验2份,精密称定,照2015年版中国药典四部(通则2201热浸法)[13]测定,用稀乙醇为溶剂,10批橘络浸出物结果见表 2。
2.4 橙皮苷含量测定 2.4.1 色谱条件“/”中它有色谱柱:G18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.2%磷酸溶液(20:80);流速:1.0 mL·min-1;检测波长:283 nm;柱温:30 ℃。理论板数以橙皮苷峰计不得少于3 000。对照品和橘络样品的HPLC色谱图见图 2。
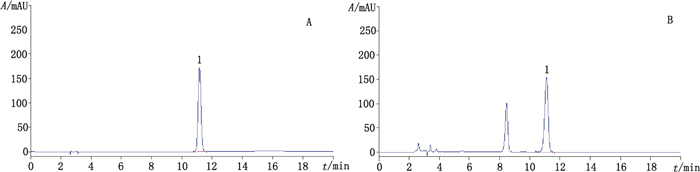
|
1.橙皮苷(hesperidin) 图 2 橙皮苷对照品(A)和橘络样品(B)色谱图 Figure 2 HPLC chromatograms of hesperidin reference substance(A)and sample of Retinervus Citri Furctus(B) |
取本品粉末0.1 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称量,加热回流60 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.4.3 对照品溶液的制备精密称取橙皮苷对照品12.92 mg,置50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即将对照品溶液(质量浓度:0.246 2 mg·mL-1)。
2.4.4 线性关系的考察精密吸取对照品溶液(质量浓度:0.246 2 mg·mL-1)1、2、4、6、8、10 µL,按上述色谱条件依法测定峰面积积分值,以峰面积积分值为纵坐标,橙皮苷进样量(µg)为横坐标,绘制标准曲线。实验数据经直线回归,得回归方程(n=6):
| $ Y = 1.925 \times {10^6}X - 99.72\;\;\;r = 0.999\;9 $ |
实验表明:橙皮苷对照品在所试量为0.246~2.46 µg范围内与峰面积积分值具有良好的线性关系。
2.4.5 精密度试验精密吸取橙皮苷对照品溶液5 µL,连续进样5次,其峰面积测量值的RSD为0.61%,表明仪器精密度良好。
2.4.6 重复性试验取同一批橘络样品(编号JL-01)6份,按照建立的含量测定方法测定供试品中橙皮苷的含量为70.92 mg·g-1,按干燥品计算为81.8 mg·g-1;其RSD=0.20%,实验表明:本法重复性较好。
2.4.7 稳定性试验取供试品溶液,于配制后精密量取5 µL注入液相色谱仪,并每隔一定时间测定1次峰面积积分值,直至24 h。结果表明:橙皮苷在24 h内稳定。其RSD=0.27%。
2.4.8 准确度试验取同一批已知含量的橘络样品(编号JL-01,含量为70.92 mg·g-1)6份,每份取0.05 g,精密称定,分别精密加入橙皮苷对照品甲醇溶液(浓度为0.251 9 mg·mL-1)15 mL,称量,按照建立的含量测定方法测定,计算,其平均回收率为100.3%,RSD=0.90%。实验表明:本法准确性较好。结果见表 3。
|
|
表 3 橙皮苷回收率试验结果 Table 3 The recovery results of hesperidin |
取10批样品,按“2.4.2”项下方法制备供试品溶液,并按“2.4.1”项下色谱条件测定,按干燥计算,10批样品测定结果见表 2。
3 小结与讨论 3.1 薄层色谱鉴别建立橘络的薄层色谱鉴别,选择橘络所含主要成分之一的橙皮苷作为对照,结果薄层色谱斑点清晰,重复性及分离度好,斑点信息量较多,该方法简单快速,兼具了柱色谱和纸色谱的优点,可作为橘络质量控制方法之一。试验中比较了2种展开系统三氯甲烷-甲醇-水(3:1:0.1)、甲苯-乙酸乙酯-甲酸-水(20:10:1:1)[14]的上层溶液,根据试验结果选择三氯甲烷-甲醇-水(3:1:0.1)为最终展开剂。试验中比较了不同湿度下、室温与低温(2~10 ℃)下、不同厂家的薄层板,结果均取得良好的分离效果,表明该薄层色谱法的耐用性良好。
3.2 橙皮苷含量测定本试验对提取方法和提取时间进行了筛选优化,结果显示以用甲醇加热回流60 min所得橙皮苷含量最高,故选择其作为提取方法。根据橙皮苷在全光谱扫描结果和文献资料显示,橙皮苷在283 nm处有最大吸收,再参考中国药典2015年版一部陈皮项下含量测定波长,最终选择283 nm为检测波长。本试验分别考察了不同流动相(乙腈-水系统、乙腈-0.2%磷酸系统、甲醇-醋酸-水)[14-15]下橙皮苷的分离情况,经试验采用乙腈-0.2%磷酸溶液(20:80)为流动相时,样品中橙皮苷分离效果好,出峰时间适中,分离度效果好,最后采用乙腈-0.2%磷酸溶液(20:80)。在确定的色谱条件下测定10批橘络药材中橙皮苷平均值为8.61%;按照不得低于平均值的80%制定标准[16],橘络药材橙皮苷含量不得少于6.88%。综合考虑试验测定结果和实际情况,建议橘络药材橙皮苷(按干燥品计算)含量不得少于6.0%。
3.3 水分、总灰分和浸出物的限量标准建议考察橘络水分,经测定10批橘络药材平均值为13.21%,按不高于平均值的120%制定标准限度,橘络药材中水分不得过15.85%,再结合2015年版中国药典中对该类药材的限量要求,建议橘络水分不得过16.0%。10批橘络总灰分平均值为3.79%;按不高于平均值的120%制定标准限度,总灰分不得过4.55%,建议橘络总灰分不得过5.0%。根据橘络所含化学成分的性质和试验结果,用稀乙醇作溶剂,采用热浸法测定橘络的浸出物含量,结果10批橘络药材醇溶性浸出物平均值为16.59%,按不低于平均值的80%制定标准,橘络药材醇溶性浸出物不得少于13.27%,建议橘络醇溶性浸出物不得少于13.0%。
橘络药材质量标准研究报道较少,本文建立的薄层色谱鉴别方法、检查、浸出物和含量测定方法能更好地控制橘络药材的质量,为完善橘络药材质量标准提供了方法和依据。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999, 896. Chinese Herbalism Editorial Board, State Administration of Traditional Chinese Medicine. Chinese Herbalism[M]. Shanghai: Shanghai Science and Technology Publishers, 1999, 896. |
| [2] |
安徽省中药饮片炮制规范[S]. 2005: 282 Anhui Standard of Chinese Medicinal Herbs Preparation[S]. 2005: 282 |
| [3] |
余菁, 宋旭峰. HPLC测定橘络中橙皮苷的含量[J]. 中国中药杂志, 2006, 31(10): 850. YU J, SONG XF. HPLC method to determine the content of orange peel in orange[J]. China J Chin Mater Med, 2006, 31(10): 850. DOI:10.3321/j.issn:1001-5302.2006.10.022 |
| [4] |
肖培根. 新编中药志.第2卷[M]. 北京: 化学工业出版社, 2002, 349. XIAO PG. New Chinese Materia Medica. VolⅡ[M]. Beijing: Chemistry Industry Press, 2002, 349. |
| [5] |
张冬松, 高慧媛, 吴立军, 等. 橙皮苷的药理活性研究进展[J]. 中国现代中药, 2006, 8(7): 25. ZHANG DS, GAO HY, WU LJ, et al. The progress in pharmacological activities of hesperidin[J]. Mod Chin Med, 2006, 8(7): 25. |
| [6] |
钱俊臻, 王伯初. 橙皮苷的药理作用研究进展[J]. 天然产物研究与开发, 2010, 22(2): 176. QIAN JZ, WANG BC. New research progress in pharmacological activities of hesperidin[J]. Nat Prod Res Dev, 2010, 22(2): 176. |
| [7] |
胡志军, 陈建秋. HPLC测定不同基原陈皮药材中橙皮苷的含量[J]. 中国实验方剂学杂志, 2012, 18(10): 95. HU ZJ, CHEN JQ. Content determination of hesperidin from different kinds of Pericarpium Citri Reticulatae by HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(10): 95. DOI:10.3969/j.issn.1005-9903.2012.10.027 |
| [8] |
汪金玉, 陈康, 徐小飞, 等. 高效液相色谱法测定橘核中橙皮苷的含量[J]. 广东药学院学报, 2010, 26(5): 501. WANG JY, CHEN K, XU XF, et al. Determination of hesperidin in Semen Citri Reticulatae by HPLC[J]. J Guangdong Coll Pharm, 2010, 26(5): 501. |
| [9] |
韦媛媛, 陈忠坤, 肖芳, 等. 广西不同品种柑橘皮中橙皮苷含量测定[J]. 食品科技, 2011, 36(10): 256. WEI YY, CHEN ZK, XIAO F, et al. Content analysis of hesperidin in Pericarpium Citri Reticulatae from different species in Guangxi[J]. Food Sci Technol, 2011, 36(10): 256. |
| [10] |
蒋以号, 吕妍, 曹旻旻, 等. HPLC法测定枳壳不同炮制品中柚皮苷、橙皮苷和新橙皮苷的含量[J]. 中华中医药杂志, 2011, 26(3): 601. JIANG YH, LÜ Y, CAO MM, et al. Content determination of naringin, hesperidin and neohesperidin in processed products of Fructus Aurantii by HPLC[J]. China J Tradit Chin Med Pharm, 2011, 26(3): 601. |
| [11] |
王伟影, 毛菊华, 陈张金, 等. 畲药山里黄根的质量标准研究[J]. 药物分析杂志, 2015, 35(6): 1105. WANG WY, MAO JH, CHEN ZJ, et al. Study on quality standard of traditional She medicine Gardeniae Radix[J]. Chin J Pharm Anal, 2015, 35(6): 1105. |
| [12] |
赵燕. 薄层色谱鉴别胃苏颗粒中橙皮苷和柚皮苷[J]. 海峡药学, 2016, 28(1): 73. ZHAO Y. TLC identification of hesperidin and naringin in Weisu granules[J]. Strait Pharm J, 2016, 28(1): 73. |
| [13] |
中华人民共和国药典2015年版. 四部[S]. 2015: 57, 103, 202, 204 ChP 2015. Vol Ⅳ[S]. 2015: 57, 103, 202, 204 |
| [14] |
中华人民共和国药典2015年版. 一部[S]. 2015: 191 ChP 2015. Vol Ⅰ[S]. 2015: 191 |
| [15] |
刘传夫, 石俊英. 橘叶药材质量评价研究[J]. 药学研究, 2014, 33(1): 21. LIU CF, SHI JY. Study on medicinal materials quality control of orange leaves[J]. J Pharm Res, 2014, 33(1): 21. |
| [16] |
张亚中, 袁杰, 班永生, 等. 蔓生百部质量标准研究[J]. 药物分析杂志, 2014, 34(10): 1856. ZHANG YZ, YUAN J, BAN YS, et al. Research on quality standard of roots of Stemona japonica(Bl.)Miq.[J]. Chin J Pharm Anal, 2014, 34(10): 1856. |
 2018, Vol. 38
2018, Vol. 38 
