2. 上海微创医疗器械(集团)有限公司, 上海 201203
2. Shanghai MicroPort Medical(Group) Co., Ltd., 1601 Zhang Dong Rd., ZJ Hi-Tech Park, Shanghai 201203, China
目前我国大多数医疗器械使用的增塑剂是邻苯二甲酸二(2-乙基)己酯(diethylhexyl phthalate,DEHP),然而DEHP被广泛研究出具有一定的生殖毒性并已被美国FDA限制使用[1-2]。ATBC作为一种新型的无毒增塑剂,批准在食品包装以及部分医疗器械中使用,但是,ATBC作为一种化学品,仍然存在一定的使用风险,尤其是接触介质为脂类物质[3]。Welle[4]对比了环己烷-1,2-二甲酸二异壬酯(DINCH)、偏苯三酸三辛酯(triocty 1 trimelli fate,TOTM)、ATBC和DEHP在不同营养液中的溶出情况,发现ATBC的迁移率至少是DEHP的10倍,不过ATBC慢性毒理学的无明显不良作用水平(NOAEL)为300 mg·kg-1·bw-1[5],而DEHP的NOAEL值却为4.8 mg·kg-1·bw-1 [6]。一次性聚氯乙烯(polyringl choride,PVC)动静脉插管一般用于心脏手术,在临床上会与大量血液接触,血液中含有血脂,而含脂量高的介质可能造成增塑剂ATBC从插管中大量溶出进入人体[7],因此根据国家对于医疗器械产品助剂含量控制要求的有关规定,需要对其进行溶出风险评估。
在临床使用过程中增塑剂溶出量的测定是对其进行增塑剂溶出风险评估的基础。目前ATBC的检测方法包括超临界流体色谱-蒸发光散射检测(SFC-ELSD),气相色谱法(GC)和气质联用色谱法(GC/MS)。由于血液成分的复杂性等原因,国内外尚无ATBC在血液中,尤其是在循环血液中的溶出量测定的报道[8-10]。本文以威高公司生产的一次性使用动(静)脉插管为研究对象,模拟产品在临床使用条件与极限条件,建立了ATBC在全血以及乙醇水(密度0.937 3~ 0.937 8 g·cm-3)的溶出量的GC测定方法,从而为评估以ATBC为增塑剂的医疗器械产品在临床使用中,特别是在血液循环系统中的溶出风险评估提供依据。
1 仪器与材料 1.1 仪器Agilent 7890A离子火焰检测器-气相色谱仪(GC-FID,Agilent公司),HP-5MS色谱柱(30 m×0.25 mm×0.25 μm,Agilent公司),ED恒温水浴(Julabo公司),WT600-2J蠕动泵(保定兰格恒流泵有限公司),GP-300G液体相对密度与浓度测试仪(苏州市玛艺电子有限公司)。
1.2 材料成人型使用的插管:一次性使用动脉插管:规格Fr24(最大型号),生产批号20130502。
一次性使用静脉插管:规格Fr42(最大型号),生产批号20130101;试验采用的最大规格组合样品为Fr24(1根)+Fr42(2根)。上述样品均为东莞科威医疗器械有限公司生产。正己烷(色谱纯,赛默飞世尔科技(中国)有限公司),乙醇(分析纯,科龙化工有限公司),ATBC对照品(山东威高有限公司提供,纯度99%),新鲜抗凝全血(成都市血液中心提供)。
2 方法与结果 2.1 试验设计选取产品最大型号(成人型),采用新鲜抗凝全血以及密度为0.937 3~ 0.937 8 g·cm-3的乙醇水作为浸提介质,通过蠕动泵使浸提介质在管道中以临床使用速度(2 L·min-1)与极限速度(6 L·min-1)在37 ℃下循环4 h,以制备浸提液,用正己烷萃取血液中溶出的ATBC,用真空干燥法萃取乙醇水中的ATBC,再用GC法测定ATBC的含量,以此计算该产品在模拟过程中所能溶出增塑剂ATBC的总量。
根据国标GB/T 16886.17—2005,成人平均体重按70 kg计算[11],由于人体血液约占体重的7%,全血比重为1.06 g·mL-1,因此全部血液体积为70×1 000×7%÷1.06=4 622 mL。为了提高了实验的可靠性,同时节约了宝贵的血液资源,本研究在流速、循环时间一定且单位面积材料表面接触的血量不变的条件下,将研究所需的循环浸提介质体积定为实际循环介质体积的1/10,由此将循环浸提血液体积确定为462 mL。同理,乙醇水的体积也确定为462 mL。
2.2 色谱条件气相色谱柱:HP-5MS(30 m×0.25 mm×0.25 μm);进样量:2 μL;进样温度:250 ℃;分流比:1:1;载流气体:高纯氮气;流速:5 mL·min-1。升温程序:75 ℃保持1 min,按15 ℃·min-1速率升至270 ℃,保持2 min对照品的保留时间为15.80 min,色谱图见图 1。
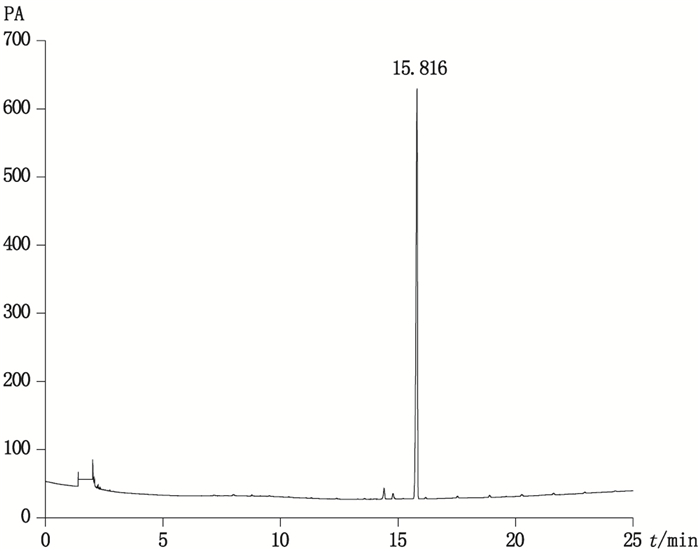
|
图 1 ATBC对照品气相色谱图 Figure 1 GC chromagram of ATBC standard |
精密称取ATBC对照品0.106 7 g,用正己烷稀释并定容至100 mL,得到质量浓度为1.067 mg·mL-1的对照品储备液。取对照品储备液用正己烷逐级稀释,得到5.34、10.67、25.17、50.34、106.7 μg·mL-1浓度的系列对照品溶液,按照“2.2”项条件进行测定,以峰面积为纵坐标,ATBC浓度为横坐标绘制ATBC标准曲线,得到线性回归方程:
| $ Y = 25.17X + 5.202\;\;\;\;\;r = 0.999\;7 $ |
表明ATBC质量浓度在5.34~106.7 μg·mL-1范围内线性关系良好。
2.5 灵敏度试验取ATBC对照品储备液,用正己烷逐级稀释,得到不同浓度的对照品溶液,按照“2.2”项条件进行定量测定,以信噪比不低于3确定检测下限。由此确定在“2.2”项条件下ATBC的检测下限为2.134 ng。
2.6 精密度试验取质量浓度为106.7、53.35与10.67 μg·mL-1的ATBC对照品溶液,按照“2.2”项条件分别连续定量测定5次,得到峰面积的RSD均小于5%,表明此方法具有较好的仪器精密度。
2.7 准确度试验准确度试验采用浸提液加标方法。精确吸取“2.1”项中在不同循环速度下循环了4 h后的样品,每个流速下的浸提介质各取4份,1份为本底,其他3份分别加入由甲醇(甲醇能与血液混溶)配制的质量浓度为2 134、1 067和534 μg·mL-1的ATBC对照品溶液50 μL混匀,然后按照“2.8”项方法制备供试液。按照“2.2”项条件进行测定,根据标准曲线计算供试液中ATBC的浓度,结果见表 1,计算得到正己烷处理全血介质的回收率为(75.1±4.1)%。本试验的目的是建立一种操作简单、分析快速的检测方法,因此只对浸提液进行了1次萃取,从而导致回收率偏低,但是本试验的萃取回收率稳定,结果可靠。此浸提液的真空干燥法处理乙醇水介质的回收率为(70.5±2.4)%,以此计算的溶出量。
|
|
表 1 2种方法的回收率(n=3) Table 1 The recovery results of two methods |
取“2.1”项中不同循环速度下循环了4 h后的全血浸提液,各1 mL,与正己烷按1:1(V/V)混合,涡旋震荡后4 000 r·min-1速度离心20 min,取上清过0.22 μm滤膜得到样品检验液,按照“2.2”项色谱条件进样测定得到峰面积。
取“2.1”项中不同循环速度下循环了4 h后的乙醇水浸提液,各1 mL,60 ℃真空干燥12 h,1 mL正己烷溶解干燥后的残留物,涡旋振荡30 s后,将溶液以4 000 r·min-1的速度离心20 min,取上清过0.22 μm滤膜得到样品检验液,按照“2.2”项色谱条件进样测定得到峰面积。
ATBC溶出量按公式MATBC=Cs×V/R进行计算, MATBC为ATBC溶出总量(mg),Cs为GC检测出的检验液浓度,V为浸提液总体积,R为在“2.7”中列出的全血浸提液的平均回收率和乙醇水浸提液的平均回收率。在临床使用条件下和极限条件下,ATBC在2种浸提介质中的溶出情况见表 2。
|
|
表 2 ATBC在两种浸提介质中溶出量结果(n=3) Table 2 The migration of ATBC from two extraction medium |
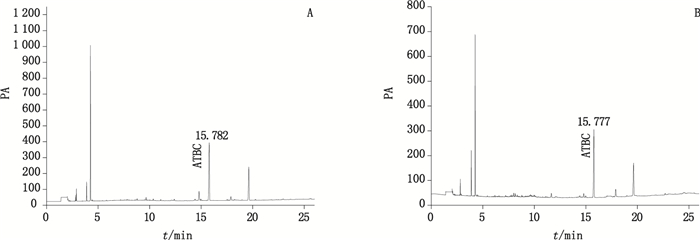
|
A.2L·min-1;B.6L·min-1 图 2 血液样品溶液中ATBC气相色谱图 Figure 2 GC chromatograms of ATBC sample solution for blood |
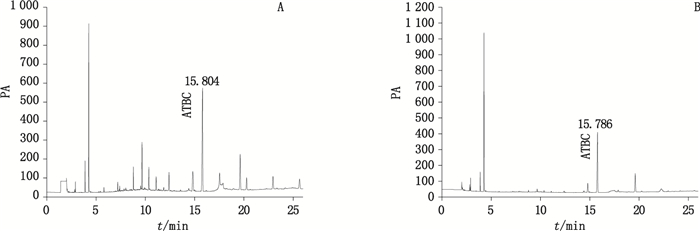
|
A.2 L·min-1 B.6 L·min-1 图 3 乙醇水样品溶液中ATBC气相色谱图 Figure 3 GC chromatograms of ATBC sample solution for ethanol-water |
在实际情况中,由于血液样本是很难获得,因此收集新鲜全血作为浸提介质来测定PVC产品中增塑剂的溶出会有一定难度。在这种情况下,可替代全血的浸提介质是有必要的。ISO 3826—12003提出可用密度为0.937 3~0.937 8 g·m-3的乙醇水替代全血作为浸提介质,测量PVC血袋中DEHP的溶出。然而,目前国内外尚未提出任何一种浸提溶液,可作为全血的替代介质用于测定以ATBC增塑的PVC医疗器械中增塑剂的溶出。因此,本实验研究了密度为0.937 3 ~ 0.937 8 g·cm-3的乙醇水作为全血的替代介质来测定ATBC溶出的可能性。
一次性动(静)脉插管的原材料为PVC,其使用的增塑剂为ATBC,在使用过程中,材料中的部分增塑剂可迁移至循环的全血中并随血液进入体内。本文以全血与乙醇水作为浸提介质,采用正己烷萃取法以及用真空干燥法提取浸提液中的ATBC,2种方法对浸提液中ATBC的提取回收率均稳定,且具有较高的灵敏度与较好的精确度,因此各项数据显示本文采用的2种方法对于提取全血-乙醇水中的ATBC均准确可靠。此外,本文通过比较在不同条件下浸提液中ATBC的溶出量以及人体静脉途径摄入ATBC的TI值和可耐受量(TE),对ATBC在全血中的溶出进行风险分析。
根据ISO 10993—17 [12]中指出的溶出物的可摄入量(TI)计算方法以及CSTEE中指出的ATBC子宫内暴露的慢性毒理学NOAEL为100 mg·kg bw-1·d-1[13],ATBC的TI的计算方法如下:
| $ \begin{array}{l} {\rm{TI = NOAEL/UF1/UF2/UF3}}\\ \;\;\;\;\; = 100\;{\rm{mg}} \cdot {\rm{kg}} \cdot {\rm{b}}{{\rm{w}}^{ - 1}}\cdot{\rm{da}}{{\rm{y}}^{ - 1}} \div (10 \times 10 \times 1)\\ \;\;\;\;\; = 1.0\;{\rm{mg}} \cdot {\rm{kg}} \cdot {\rm{b}}{{\rm{w}}^{ - 1}}\cdot{{\rm{d}}^{ - 1}} \end{array} $ |
其中,UF1=10,代表人体间个体差异的不确定性;
UF2=10,代表动物与人之间物种差异系数;
UF3=1,代表实验数据的定性和相关性的不确定性。
根据国标GB/T 16886.17—2005,成人平均体重按70 kg计算,每日ATBC的TE为:
| $ \begin{array}{l} {\rm{TE = UTF}} \times {\rm{Mb}} \times {\rm{TI}}\\ \;\;\;\;{\rm{ = 1}} \times {\rm{1}}{\rm{.0}}\;{\rm{mg}} \cdot {\rm{kg}} \cdot {\rm{b}}{{\rm{w}}^{ - 1}}\cdot{{\rm{d}}^{ - 1}} \times 70\;{\rm{kg}}\\ \;\;\;\;{\rm{ = 70}}\;{\rm{mg}} \cdot {{\rm{d}}^{ - 1}} \end{array} $ |
其中,UTF=1,代表医疗器械的利用系数;
Mb,代表成人平均体质量;
根据表 2结果,在临床循环速度(2 L·min-1)以及极限循环速度(6 L·min-1)条件下,一次性PVC动静脉插管在2个条件下在全血和乙醇水中的溶出量均低于ATBC TE,说明本产品在临床使用中是安全的。
3.2 浸提介质对ATBC溶出量的影响目前尚无研究对比ATBC在全血和乙醇水这2种浸提介质中的溶出情况,从而探讨乙醇水是否也可以作为替代介质来检测与血液接触的医疗器械中增塑剂ATBC的溶出量。
本研究对比了在2种流速下,一次性动静脉插管增塑剂ATBC在全血介质以及乙醇水介质中的溶出情况,发现在2种流速下,ATBC在乙醇水中的溶出量均高于全血介质。因此,在没有足够全血的情况下,可以使用密度为0.937 3 ~ 0.937 8 g·cm-3的乙醇水作为替代介质用于检测与血液或血液成分接触的医疗器械中ATBC的溶出量。
3.3 循环速度对ATBC溶出量的影响本研究对比了ATBC在2种不同的临床循环速度下从PVC插管中的溶出情况。研究结果发现,ATBC在浸提介质循环速度为2 L·min-1时的溶出总量要高于循环速度为6 L·min-1时的溶出总量,说明低流速可能会增加ATBC的迁移量。Takehisa[14]曾研究了在不同流速下,DEHP迁移至Tween 80溶液中,发现循环速度越快,溶出量更高,并指出这是因为介质速度越快,对PVC管壁的机械压力更高,因此造成了溶解量越高。PVC产品中增塑剂在液体介质中的溶出是一个较为复杂的问题,在接触过程中会发生增塑剂从PVC产品中迁移出来进入浸提介质,同时浸提介质进入到PVC产品中这2个相互作用的过程,影响这2个过程的因素包含温度及增塑剂在介质中的溶解性等,尤其对于接触过程是在一个动态条件下,影响因素就会更加多样化[15]。本研究中发现循环速度越快,增塑剂ATBC溶出量越低,可能是由于介质循环速度低,与管壁接触时间越长,从而增塑剂能更加充分地迁移至介质中,导致在相同循环时间下,流速越低增塑剂的溶出量越高,这与辛凤鲜研究的DEHP在不同流速下从体外循环管道中溶出情况[16]相似。本研究后续将进一步探讨高流速造成ATBC溶出量减少的原因。
3.4 小结本研究以全血体系以及密度为0.937 3~0.937 8 g·cm-3的乙醇水体系作为浸提介质,模拟临床使用条件与极限条件,考察增塑剂ATBC在2种体系中的的溶出量并建立了准确可靠的检测方法;同时,本文研究了浸提介质以及循环速度对增塑剂ATBC溶出量的影响,为评估该产品在临床使用中的溶出风险提供依据,更为今后以ATBC作为增塑剂的管路医疗器械的研发提供参考。
| [1] |
BLASS CR, JONES C, COURTNET JM. Biomaterials for blood tubing:the application of plasticized poly(vinyl chloride)[J]. Int J Artif Organs, 1992, 15(4): 200. DOI:10.1177/039139889201500402 |
| [2] |
BERNARD L, CUEFF R, CHAGNON MC, et al. Migration of plasticizers from PVC medical devices:development of an infusion model[J]. Int J Pharm, 2015, 494(1): 136. DOI:10.1016/j.ijpharm.2015.08.033 |
| [3] |
ZYGOURA PD, RIGANAKOS KA, KONTOMINAS MG, et al. Study of the migration behavior of acetyl tributyl citrate from PVDC/PVC film into fish fillets as affected by intermediate doses of electron beam radiation[J]. Eur Food Res Technol, 2011, 232: 1017. DOI:10.1007/s00217-011-1475-z |
| [4] |
WELLE F, WOLZ G, FRANZ R. Migration of plasticizers from PVC tubes into enteral feeding solutions[J]. Pharm Int, 2005, 3: 17. |
| [5] |
BRIAN SN, DORTHE NA, ESTELLE G, et al. Alternatives to classified phthalates in medical devices[EB/OL]. Danish Ministry of the environment Environmental Protection Agency, 2014. [2016-09-18]. https://www2.mst.dk/Udgiv/publications/2014/03/978-87-93178-27-4.pdf
|
| [6] |
Scientific Committee for Toxicity, Ecotoxicity and the Environment(CSTEE): Opinion on the results of a second Risk Assessment of: Bis(2-ethylhexyl)Phtalate[DEHP] Human health part[C/OL]. European Commission Health&Consumer Protection Directorate-General, January 8, 2004. [2016-10-27]. http://ec.europa.eu/health/ph_risk/committees/sct/documents/out214_en.pdf
|
| [7] |
TESTAI E, HARTEMANN P, CHANDRA RS, et al. The safety of medical devices containing DEHP-plasticized PVC or other plasticizers on neonates and other groups possibly at risk[C/OL]. Scientific Committee on Emerging and Newly Identified Health Risks(Scenihr), 2015. https://ec.europa.eu/health/scientific_committees/emerging/docs/scenihr_o_047.pdf
|
| [8] |
LECOEUR M, DECAUDIN B, GUILLOTIN Y, et al. Comparison of high-performance liquid chromatography and supercritical fluid chromatography using evaporative light scattering detection for the determination of plasticizers in medical devices[J]. J Chromatogr A, 2015, 1417: 104. DOI:10.1016/j.chroma.2015.09.026 |
| [9] |
SUHRHOFF TJ, SCHOLZ-BÖTTCHE BM. Qualitative impact of salinity, UV radiation and turbulence on leaching of organic plastic additives from four common plastics-A lab experiment[J]. Mar Poll Bull, 2016, 102(1): 84. DOI:10.1016/j.marpolbul.2015.11.054 |
| [10] |
BOURDEAUX D, YESSAAD M, CHENNEL P, et al. Analysis of PVC plasticizers in medical devices and infused solutions by GC-MS[J]. J Pharm Biomed Anal, 2016, 118: 06. |
| [11] |
王红, 韩玎玎, 刘曦, 等. 液质联用法测定体外循环管道中增塑剂DINCH在血液中的溶出量[J]. 药物分析杂志, 2015, 35(12): 2204. WANG H, HAN DD, LIU X, et al. Determination of BTHC releasing into pooled platelet concentrates from platelet storage containers by HPLC[J]. Chin J Pham Anal, 2015, 35(12): 2204. |
| [12] |
ISO 10993-17-2002 Biological evaluation of Medical Devices Part 17: Establishment of Allowable Limits for Leachable Substances[S]. 2002
|
| [13] |
Scientific Committee for Toxicity, Ecotoxicity and the Environment(Cstee). Opinion on the risk assessment for acetyl tributyl citrate(ATBC)plasticizer used in children's toys[C/OL]. European Commission Health & Consumer Protection Directorate-General, January 8, 2004. http://ec.europa.eu/health/ph_risk/committees/sct/documents/out222_en.pdf
|
| [14] |
TAKEHISA H, NAOKOA E, MASAHIKO S, et al. Release behavior of diethylhexyl phthalate from the polyvinyl-chloride tubing used for intravenous administration and the plasticized PVC membrane[J]. Int J Pharm, 2005, 297(1-2): 30. DOI:10.1016/j.ijpharm.2005.02.015 |
| [15] |
TAVERDET JL, VERGNAUD JM. Study of transfer process of liquid into and plasticizer out of plasticized PVC by using short tests[J]. J Appl Poly Sci, 1984, 29: 3391. DOI:10.1002/app.1984.070291116 |
| [16] |
辛凤鲜, 薛云燕, 马才. 体外循环管道中DEHP溶出量的测定[J]. 中国医疗器械信息, 2011, 17(6): 36. XIN FX, XUE YY, MA C. Determinated total amount of DEHP released from disposable extracorporeal circulation tube[J]. China Med Dev Inf, 2011, 17(6): 36. |
 2018, Vol. 38
2018, Vol. 38 
