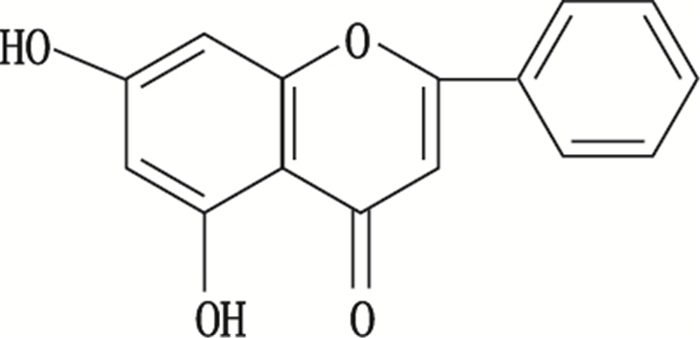
白杨素[1](chrysin),又称为白杨黄素,其化学名为5,7-二羟基黄酮(5,7-dihydroxyflavone),结构式见图 1。它是一种主要存在于紫葳科植物木蝴蝶、蜂胶中的黄酮类化合物,在蜂胶中含量较高,是蜂胶的主要有效成分。白杨素具有广泛的药理作用[2-4],目前已有实验室研究表明其在抗癌、降血脂、防心脑血管疾病、抗菌、消炎等方面均具有一定的作用。
|
图 1 白杨素的结构式 Figure 1 The structural of chrysin |
药物的物理化学参数与生物体内膜渗透性具有一定的相关性,平衡溶解度、lgP和pKa能够在此基础上推测药物在生物体内的吸收状况,因此测定药物的平衡溶解度、lgP和pKa具有重要意义。目前国内尚无文献同时对白杨素在不同pH溶液中的lgP和pKa进行测定。本文对白杨素在不同介质中的平衡溶解度以及其在水和不同pH溶液中的lgP和pKa进行了测定,旨在预测其体内吸收状况,并为白杨素制剂学研究提供实验依据。
1 仪器与试剂Agilent 1260高效液相色谱仪(Agilent 1260四元泵内嵌式在线真空脱气机,Agilent 1260 G1311B四元泵,Agilent 1260 G1328C手动进样器,Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶,安捷伦公司),Agilent 1260 G1316A标准柱温箱,Agilent 1260 G1315D VL二极管阵列检测器(DAD))(安捷伦科技有限公司);pHS-3C型pH计(上海雷磁仪器厂);JK-DO-9203A恒温箱(上海精学科学仪器有限公司);TDZ5-WS型离心机(长沙平凡仪器仪表有限公司);超纯水系统(英国ELGA PURELAB Classic经典型超纯水系统);KH-400KDB型高功率数控超声波清洗器(昆山禾创超声仪器有限公司);津腾溶剂过滤器(天津市津腾实验设备有限公司);UV-2550紫外可见分光光度计(日本岛津公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);电子分析天平(瑞士Mettler Toledo AG285);SHA-C恒温振荡器(常州智博瑞仪器制造有限公司);EYEL4 FDE-2110型冷冻干燥机(上海爱朗仪器有限公司);Mini-7K微型离心机(上海沪粤明科学仪器有限公司);水浴氮吹仪(上海秉越电子仪器有限公司)。
白杨素对照品(上海源叶生物科技有限公司,HPLC≤98%,批号X24O6C4947);白杨素样品(南京道斯夫生物科技有限公司,HPLC≤98%,批号160616);中链甘油三脂(MCT,上海艾韦特医药科技有限公司,批号140101);蓖麻油聚氧乙烯醚(Cremophor EL,上海麦克林生化科技有限公司,批号C10057611);二乙二醇单乙基醚(Transcutol HP,嘉法狮贸易有限公司,批号162998);丙二醇单辛酸酯(Capryol 90,嘉法狮贸易有限公司,批号161371);辛酸癸酸聚乙二醇甘油酯(Labrasol,嘉法狮贸易有限公司,批号162677);甲醇和乙腈;乙腈(色谱纯,德国默克公司);曲拉通X-100(Triton X-100,上海晶都生物技术有限公司,批号201705);聚氧乙烯40氢化蓖麻油(cremophor RH40,上海笃玛生物科技有限公司,批号0200208800);蓖麻油聚烃氧酯(35)(纯化)(Kolliphor ELP,上海笃玛生物科技有限公司,批号69768468E0);其他试剂均为分析纯。
2 方法与结果 2.1 白杨素含量测定的方法学考察 2.1.1 对照品溶液的制备精密称取在105 ℃下干燥至恒重的白杨素对照品20.31 mg,置25 mL量瓶中,加入适量乙腈,超声(400 W,40 kHz)使溶解,放冷,用乙腈定容至刻度,摇匀后备用,得到质量浓度为0.812 4 g·L-1的白杨素对照品溶液。
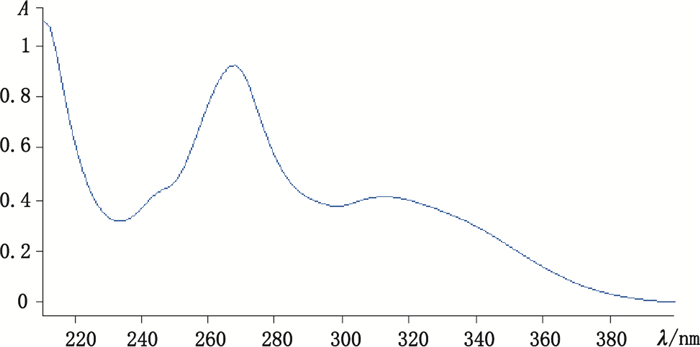
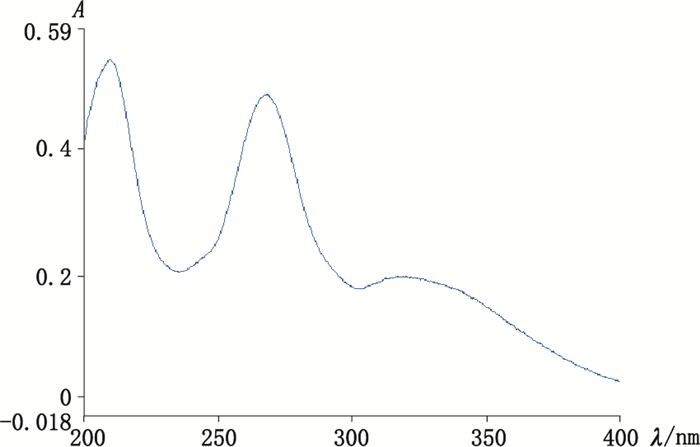
2.1.2 最大吸收波长的测定精密吸取“2.1.1”项下白杨素对照品溶液1 mL,加入乙腈稀释至5 mL,以乙腈为空白调零溶液,用紫外可见分光光度计在200~400 nm范围内进行扫描。根据白杨素对照品溶液的最大吸收峰,确定白杨素的最大吸收波长为268 nm,紫外吸收光谱见图 2。
|
图 2 白杨素紫外吸收光谱 Figure 2 Ultraviolet absorption spectrum of Chrysin |
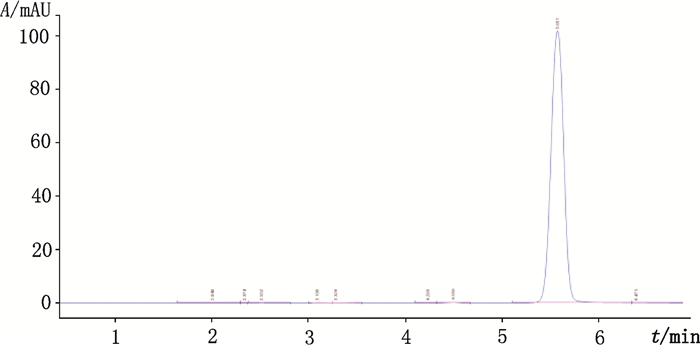
色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.1%甲酸溶液(60:40);检测波长:268 nm;流速:1.0 mL·min-1;柱温:25 ℃。在上述色谱条件下,白杨素的保留时间为5.6 min,如图 3。
|
图 3 白杨素对照品的HPLC图 Figure 3 HPLC chromatogram of chrysin reference substance |
分别精密量取“2.1.1”项下白杨素对照品溶液50.0 0、100.0、200.0、500.0、750.0、100 0 μL,置5 mL量瓶中,加乙腈至刻度,摇匀,得到0.008 124、0.016 20、0.032 50、0.081 24、0.121 9、0.162 5 g·L-1的标准系列溶液,经过0.45 μm微孔滤膜过滤后,分别精密吸取各标准系列溶液20 μL,按照色谱条件注入高效液相色谱仪,记录峰面积。以白杨素质量浓度(X,g·L-1)为横坐标,白杨素峰面积(Y)为纵坐标进行线性回归,得白杨素的线性回归方程:
| $ Y=1.0538×10^5 X-160.2 \ \ \ \ r^2=0.999 \ 9 $ |
结果表明,白杨素在0.008 124 ~0.162 5 g·L-1质量浓度范围内,峰面积和质量浓度呈现良好的相关性。
2.1.5 精密度试验取质量浓度分别为0.02、0.06、0.1 g·L-1的白杨素溶液,按色谱条件在1 d内连续进样6次,测得日内精密度;3种溶液连续测定5 d,测得日间精密度,分别计算RSD,结果表明,日内、日间精密度RSD<2 %,数据见表 1。
|
|
表 1 精密度试验结果 Table 1 Results of precision |
重复配制6组0.05 g·L-1的白杨素对照品溶液,经过0.45 μm微孔滤膜过滤后,取20 μL按色谱条件进样测定,记录峰面积,计算峰面积的RSD为1.3%,结果表明,所用实验方法能够有效地避免偶然误差。
2.1.7 稳定性试验取“2.1.1”项下白杨素对照品溶液,用乙腈稀释至0.081 25 g·L-1,经过0.45 μm微孔滤膜过滤后,在37 ℃放置0、2、8、12、24、36、48 h,分别取20 μL按色谱条件进样测定,记录峰面积。实验测得的峰面积无明显变化,计算峰面积的RSD为0.84%,说明白杨素的稳定性良好。
2.2 白杨素平衡溶解度的测定 2.2.1 在不易挥发的介质中取多个10 mL具塞玻璃试管,将过量的白杨素置于10 mL具塞玻璃试管中,在每个试管中分别加入1,2-丙二醇、正丁醇、吐温-80、正辛醇、甘油、丙二醇单辛酸酯、辛酸癸酸聚乙二醇甘油酯、蓖麻油聚氧乙烯醚、聚乙二醇400、中链甘油三脂、油酸、油酸乙酯、聚氧乙烯40氢化蓖麻油、蓖麻油聚烃氧酯(35)(纯化)、曲拉通X-100、二乙二醇单乙基醚各2 mL,在37 ℃下摇床振摇48 h后,离心(10 000 r·min-1,15 min),取上清液用适量乙腈稀释至标准曲线范围内(其中乙酸乙酯、油酸乙酯用甲醇稀释),经过0.45 μm微孔滤膜过滤后,取20 μL按照色谱条件注入高效液相色谱仪,记录峰面积,代入标准曲线计算白杨素在上述介质中的平衡溶解度,其测定结果见表 2。
|
|
表 2 白杨素在不同介质中的平衡溶解度 Table 2 Chrysin equilibrium solubility in different media |
取多个10 mL具塞玻璃试管,将过量的白杨素置于10 mL具塞玻璃试管中,在每个试管中分别加入丙酮、甲醇、无水乙醇、氯仿、二氯甲烷、乙醚、异丙醇、乙酸乙酯、石油醚、正丙醇各6 mL,在37 ℃下摇床振摇48 h后,离心(10 000 r·min-1,15 min),取上清液1 mL,水浴挥干,加入适量乙腈溶解至其浓度在标准曲线范围内,离心(10 000 r·min-1,15 min)后取上清液按色谱条件进样20 μL测定,记录峰面积,代入标准曲线计算白杨素在上述介质中的平衡溶解度,其测定结果见表 2。
2.2.3 在水和不同pH溶液中将过量的白杨素置于15 mL离心管中,在每个离心管中分别加入水、pH分别为1.2、2.5、4、5.8、6.8、7.8、9、10、11的磷酸盐溶液[5]各8 mL,在37 ℃下摇床振摇48 h后,离心(10 000 r·min-1,15 min),经0.45μm微孔滤膜过滤后,取续滤液7 mL,于50 mL离心管中,冷冻干燥。在冷冻干燥后的离心管中加入适量乙腈,将溶液经0.45 μm微孔滤膜转移至2 mL离心管中,用氮吹仪将溶液挥干,加入适量乙腈后,离心(10 000 r·min-1,15 min),取上层清液按色谱条件进样20 μL进行测定,记录峰面积,代入标准曲线计算得所测白杨素的浓度为ρ1,根据公式:
| $ S=ρ_1/35 $ |
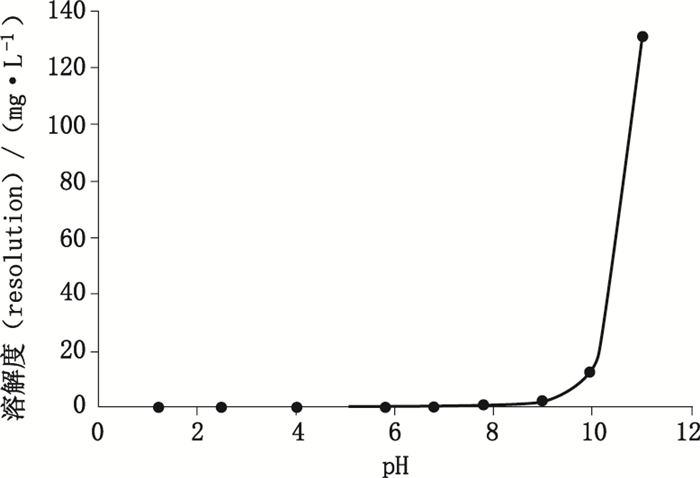
得出白杨素在水和不同pH溶液中的平衡溶解度。测得白杨素在水中的平衡溶解度为38.43 μg·L-1,白杨素在不同pH溶液中的平衡溶解度见图 4。
|
图 4 白杨素在不同pH溶液中的平衡溶解度 Figure 4 Chrysin equilibrium solubility in different pH solutions |
采用经典摇瓶法,将等量正辛醇和水混合,超声(400 W,40 kHz)振荡后静置24 h,制得正辛醇饱和溶液,加入过量白杨素,超声(400 W,40 kHz)5 min使溶解。取上述溶液1 mL,10 000 r·min-1离心15 min,取上清液用乙腈稀释至标准曲线范围内,0.45μm微孔滤膜过滤,续滤液按色谱条件进样20 μL分析,记录峰面积,按标准曲线计算出饱和正辛醇中白杨素的初始浓度C1为1.137 g·L-1。
精密量取浓度为C1的溶液1 mL,置于离心管中,分别加入正辛醇饱和的水溶液、pH分别为1.2、2.5、4、5.8、6.8、7.8、9、10、11的磷酸盐溶液各9 mL,密封后放入37 ℃恒温水浴振荡器中振摇48 h,使其在两相中充分平衡,离心(10 000 r·min-1,15 min),取下层水液,过0.45 μm微孔滤膜,精确量取8 mL,冷冻干燥,在冷冻干燥后的离心管中精确加入乙腈1.0 mL,将溶液经0.45 μm微孔滤膜转移至2 mL离心管中,用氮吹仪将溶液挥干,加入乙腈200 μL后用微型离心机离心15 min(7 000 r·min-1),取上层清液按色谱条件进样20 μL测定,记录峰面积,按标准曲线计算水相中的质量浓度C2。按照下列公式计算白杨素的logP。
| $ {{C}_{3}}=({{C}_{1}}{{V}_{1}}-{{C}_{2}}{{V}_{2}})/{{V}_{1}}~\ \ \ \ \ \ \ \ \ P={{C}_{3}}/{{C}_{2}}~\ \ \ \ \ \ \text{log}P=\text{log}_{10}^{P} $ |
式中,logP为白杨素的油水分配系数,P为白杨素的表观油水分配系数,C1为饱和正辛醇中白杨素的初始浓度,V1为被水饱和的正辛醇体积,C3为分配平衡后饱和正辛醇中白杨素的浓度,C2为分配平衡后水相中白杨素的浓度,V2为水相的体积。
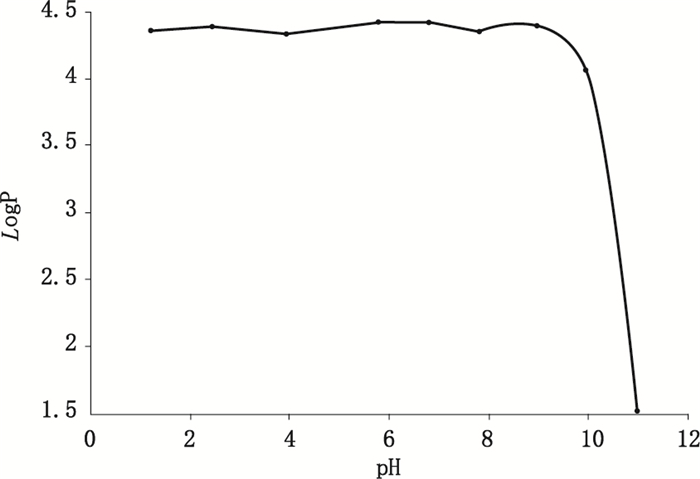
计算得出,白杨素在水中的logP为4.37。白杨素在不同pH溶液中的logP见图 5,其中,在pH为11时,白杨素的logP达到最小值1.54。
|
图 5 白杨素在不同pH溶液中的油水分配系数 Figure 5 Oil-water partition coefficient of chrysin in different pH solution |
以磷酸氢二钾和磷酸二氢钾配制磷酸盐缓冲溶液,用1 moL·L-1氢氧化钠溶液调节成不同pH的磷酸盐溶液[6]。精密称取在105 ℃下干燥至恒重的白杨素10.4 mg,置100 mL量瓶中,加入适量无水乙醇,超声(400 W,40 kHz)使溶解,放冷,用无水乙醇定容至刻度,摇匀后作为储备液待用。精密量取储备液0.5 mL,置10 mL量瓶中,加入不同pH的磷酸盐溶液定容至刻度,摇匀后定容至刻度。室温下,在200~400 nm范围内进行扫描,并用pH计测定不同白杨素溶液的pH。
扫描结果表明,在200~400 nm,pH在5.84~8.86的白杨素溶液吸收存在差异,且在274 nm处差异较为明显。因此,选择在274 nm处对不同pH的白杨素溶液进行扫描,测定其吸收度。结果见表 3。
|
|
表 3 白杨素在不同pH溶液中的紫外吸收度 Table 3 UV absorption spectra of chrysin in the buffer solution at different pH |
同时,从不同pH白杨素溶液的紫外吸收曲线变化趋势来看,白杨素分2步进行解离:当溶液pH<5.84时,白杨素的紫外吸收曲线无明显变化,可近似认为其此时仅以分子形式存在;当溶液pH在6.29~7.13时,274 nm处的吸收度随溶液pH的升高而升高,且各吸收度之间存在较大差异,此时白杨素部分以分子形式存在,部分以一级解离形式存在;当溶液pH分别为7.38(图 6)和7.55(图 7)时,发现白杨素的紫外吸收曲线差异较大,呈现不同的变化趋势,又因两者pH较为相近,可近似认为白杨素在pH 7.38以一级解离形式存在,而pH 7.55为白杨素二级解离的初始状态;当溶液的pH范围为7.75~8.4时,白杨素部分以一级解离形式存在,部分以二级解离形式存在;当溶液的pH>8.86时,白杨素的紫外吸收吸收曲线无明显变化,可近似认为完全解离。
|
图 6 白杨素在pH 7.38的溶液中的紫外吸收光谱 Figure 6 UV absorption spectra of chrysin in pH 7.38 buffer solution |

|
图 7 白杨素在pH 7.55的溶液中的紫外吸收光谱 Figure 7 UV absorption spectra of chrysin in pH 7.55 buffer solution |
根据Henderson-Hasselbaleh方程,得到pKa= pH+lg(Cu/Ci)。在特定的波长下,解离态与未解离态具有各自的吸收系数,根据吸收度的加和原理,得到下式:Cu/Ci=(Ai-A)/(A-Au),式中Au为未解离状态的吸收度,Ai为解离状态的吸收度,A为混合状态下的吸收度,因此pKa=pH+lg[(Ai-A)/(A-Au)]。以此原理,将白杨素在pH 5.84、6.29~.13和7.38下的状态分别作为完全未解离、部分解离和完全解离状态,利用上述式子,计算pKa1为6.52(见表 4);将白杨素在pH 7.55、7.75~.4和8.86下的状态分别作为完全未解离、部分解离和完全解离状态,利用上述式子,计算pKa2为7.92,见表 5。
|
|
表 4 白杨素一级解离常数pKa1的计算 Table 4 Calculation of first-order dissociation constant pKa1 for chrysin |
|
|
表 5 白杨素一级解离常数pKa2的计算 Table 5 Calculation of first-order dissociation constant pKa2 for chrysin |
本文在白杨素含量测定方法学的考察中,将甲酸作为流动相的组成成分之一,与其他文献[7-8]中所选择的流动相成分之一磷酸有所不同。考虑到磷酸对色谱柱有较大程度的损坏且不易降解,可能对色谱柱的使用产生一定的影响, 因此,使用0.1%的甲酸作为流动相的组成成分之一效果更好。在本文的方法学考察当中,线性、精密度、重复性、溶液的稳定性均符合要求,表明此含量测定方法准确、可靠。
3.2 样品的处理技术本文在测定白杨素在水和不同pH溶液中的平衡溶解度时,由于其水溶性很差,我们采用了冷冻干燥浓缩的方式,可从一定程度上增大白杨素的检测浓度,提高了实验测定的准确度。同时,测定白杨素在其他不同介质中的平衡溶解度时,考虑到易挥发的部分介质会对色谱柱产生损害,采取水浴挥干的方式,将有害溶剂进行分离,有效地保护了色谱柱。此外,测定白杨素在水和不同pH溶液中的lgP时,采用油相水相的比例为1:9,可最大程度提高药物在水相中的溶解量,并采用冷冻干燥浓缩的方式,以减小测定误差。
3.3 白杨素测定介质的选择目前已有白杨素平衡溶解度测定的相关报道[9],但其测定介质较为单一,均为不同浓度的甲醇溶液;张慧杰等[10]对12个黄酮化合物在水中的油水分配系数进行了测定,其中白杨素在水中的lgP为4.38。本文在此基础上,对白杨素在不同介质(尤其是常用油相、表面活性剂、助表面活性剂)中的平衡溶解度进行了测定,并对其在不同pH溶液中的lgP进行了测定,使研究更加系统和全面,可为白杨素在药物制剂方面的研究提供更多参考依据。
3.4 pH对白杨素平衡溶解度和lgP的影响及测定结果的分析本文在测定白杨素在不同介质中的平衡溶解度和lgP时,重点采用了不同pH的溶液,且控制其变化范围在0.5~1.5之间,使得测量的数据更加全面。实验结果表明,白杨素在不同pH溶液中的溶解度存在差异:在酸性环境下,白杨素几乎不溶;在pH 7.8~9时,随着pH的增大,白杨素的溶解能力略微有所提高;而当pH达到10时,白杨素的溶解能力突然增大且呈现不断上升的趋势;但从实验现象观察到,当pH继续增加到12时,白杨素颜色将会加深,推测白杨素在碱性较强时可能发生了C-环的开环反应[11],生成了其他物质,具体原因还需后续实验进一步研究。因此,本文在测定不同pH溶液中的平衡溶解度和lgP时,拟定的pH范围为1.2~11。
体外测定油水分配系数(lgP)是为了模拟生物体内药物在水相和生物相之间的分配情况,以此预测其吸收情况[12-13],为制剂学研究提供依据。测定结果显示,白杨素在水中的lgP为4.37。本文继续对不同pH溶液中的lgP进行了测定,使研究更加系统和全面。所测得的lgP结果显示:在pH 1.2~9时,白杨素在不同pH溶液中的lgP在4.34~4.41之间,无明显变化;当pH达到10时,白杨素的lgP突然变小;当pH达到11时,白杨素的lgP进一步减小。
一般认为,大多数药物是通过被动扩散,借助生物膜中的脂溶性物质顺浓度差转运,其转运速率与脂溶性大小有关。而具有较高lgP(一般lgP>3)的药物,其较强的脂溶性可能会导致其很难从细胞另一侧的膜释放出来,进入附近的血管或淋巴管,从而影响其吸收[14-15]。本实验测得白杨素在水中的lgP为4.37,仅以测定的结果来看,推测其在体内具有较差的吸收。
3.5 pKa测定方法与结果的分析及白杨素吸收的相关讨论酸碱性是药物重要的理化性质,同时该性质与药物在体内的吸收、分布和溶解度密切相关,而pKa是与药物酸碱性和溶解度有关的理化常数,因此,药物pKa的测定可为在分子水平上研究药物的吸收提供重要的信息,同时,也在药物新制剂和新剂型的研制中具有重要的指导意义[16]。本文用紫外分光光度法测得白杨素具有2个解离常数,即pKa1、pKa2分别为6.52、7.92,根据以上测定结果,白杨素具有2个pKa可能是由于其结构中具有2个酚羟基,且2个酚羟基的解离能力各不相同。本文采用的紫外分光光度法不需要知道样品溶液的准确浓度,只需要测得不同pH的白杨素溶液的吸收度,即可计算出其pKa,该方法简便、准确、可靠[17]。
弱酸性和弱碱性药物占全部药物的95%以上[18],对弱酸性或弱碱性药物而言,由于受胃肠道内pH的影响,药物以未解离型(分子型)和解离型2种形式存在。根据Henderson-Hasselbaleh方程,2种存在形式的比例,由药物的解离常数pKa和胃肠道内的pH所决定。由实验测得的结果来看,白杨素属于弱酸性药物,通过Henderson-Hasselbaleh方程计算得出,白杨素在胃部不易解离,大部分以未解离型形式存在,此时白杨素在胃中应具有较好的吸收[19]。然而,结合白杨素在水中的平衡溶解度和logP来看,白杨素较大的脂溶性限制了其吸收能力,同时,白杨素极差的水溶性导致其不能像液体那样与脂质膜充分接触,所以吸收更加困难。而在小肠中,白杨素主要发生一级解离,其未解离型仍占据较大的比例,且随着未解离型的吸收,解离型将会通过平衡移动转变为未解离型,同时,随着溶液pH的增大,白杨素的溶解度将有所改善。因此,仅从白杨素pKa1和pKa2的数值来看,推测其在胃部不易吸收,而在小肠中会有一定的吸收。
3.6 展望通过上述白杨素平衡溶解度、logP和pKa的测定结果可预测:白杨素的吸收状况并不理想,其临床应用有限。在已有文献研究的基础上,可以运用环糊精包合、微乳、脂质体、PLGA-PEG纳米粒子[20]等制剂学技术来提高白杨素的溶解度,以促进其在胃肠道内的吸收。
| [1] |
SONG JH, KWON BE, JANG H, et al. Antiviral activity of chrysin derivatives against Coxsackievirus B3 in vitro and in vivo[J]. Biomol Therap, 2015, 23(5): 465. DOI:10.4062/biomolther.2015.095 |
| [2] |
DOU W, ZHANG J, ZHANG E, et al. Chrysin ameliorates chemically induced colitis in the mouse through modulation of a PXR/NF-κB signaling pathway[J]. J Pharmacol Exper Therap, 2013, 345(3): 473. DOI:10.1124/jpet.112.201863 |
| [3] |
SUN XM, HUO XD, LUO T, et al. The anticancer flavonoid chrysin induces the unfolded protein response in hepatoma cells[J]. J Cell Mol Med, 2011, 15(11): 2389. DOI:10.1111/j.1582-4934.2010.01244.x |
| [4] |
FENG X, QIN H, SHI Q, et al. Chrysin attenuates inflammation by regulating M1/M2 status via activating PPARγ[J]. Biochem Pharmacol, 2014, 89(4): 503. DOI:10.1016/j.bcp.2014.03.016 |
| [5] |
张婷婷, 徐文, 胡生亮, 等. 水飞蓟宾在不同介质中平衡溶解度和表观油水分配系数的测定[J]. 中国药学杂志, 2006, 41(20): 1569. ZHANG TT, XU W, HU SL, et al. Determination of equilibrimn solubmty of silibinin in various medium and its apparent oil/water partition coefficient[J]. Chin Pharm J, 2006, 41(20): 1569. DOI:10.3321/j.issn:1001-2494.2006.20.015 |
| [6] |
王宁, 刘汉清. 胡黄连苷Ⅱ解离常数的测定[J]. 西北药学杂志, 2012, 27(3): 218. WANG N, LIU HQ. Determination of the dissociation constant of picroside Ⅱ[J]. Northwest Pharm J, 2012, 27(3): 218. |
| [7] |
赵瑞瑞, 邹江冰, 孔秋玲, 等. HPLC法测定紫果西番莲叶中白杨素的含量[J]. 中国药房, 2012, 23(23): 2154. ZHAO RR, ZOU JB, KONG QL, et al. Content determination of chrysin from the leaves of Passiflora edulis by HPLC[J]. China Pharm, 2012, 23(23): 2154. DOI:10.6039/j.issn.1001-0408.2012.23.16 |
| [8] |
文萍, 范婷婷, 吕武清, 等. RP-HPLC测定蜂胶中乔松素、白杨素和高良姜素的含量[J]. 中国实验方剂学杂志, 2013, 19(19): 108. WEN P, FAN TT, LÜ WQ, et al. RP-HPLC method for simultaneous determination of propolis pinocembrin, chrysin and galangin concentration[J]. Chin J Exp Tradit Med Form, 2013, 19(19): 108. |
| [9] |
关小彬, 范艳芳, 夏笔军, 等. 野黄芩素和白杨素的溶解度与稳定性研究[J]. 新中医, 2009, 41(9): 101. GUAN XB, FAN YF, XIA B J, et al. Study on solubility and stability of scutellarein and chrysin[J]. J New Chine Med, 2009, 41(9): 101. |
| [10] |
张慧杰, 王萌, 陈丽娜, 等. 12种黄酮化合物油水分配系数的测定[J]. 中成药, 2016, 38(8): 1708. ZHANG HJ, WANG M, CHEN LN, et al. Determination of twelve flavonoids'oil-water partition coefficients[J]. Chin Tradit Pat Med, 2016, 38(8): 1708. |
| [11] |
张燕琴. 6, 8-二-三氟甲基-7-乙酰氧基白杨素在Caco-2模型的跨膜转运及首过糖基化速率研究[D]. 衡阳: 南华大学, 2007 ZHANG YQ. Evaluation of the Transport and First-pass Glucuronidation of 6, 8-ditrifluoromethyl-7-acetoxychrysin in Caco-2 Monolayer Model[D]. Hengyang: University of South China, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10540-2007206713.htm |
| [12] |
顾杰, 李嬛, 秦昆明, 等. HPLC法测定甘草素的平衡溶解度和表观油水分配系数[J]. 药物分析杂志, 2013, 63(8): 1293. GU J, LI H, QIN KM, et al. Determination of the equilibrium solubility and apparent oil/water partition coefficients of liquiritigenin using HPLC[J]. Chin J Pharm Anal, 2013, 63(8): 1293. |
| [13] |
杨滨, 马攀勤, 孙进, 等. HPLC法测定盐酸普拉克索平衡溶解度和表观油水分配系数[J]. 中国药剂学杂志:网络版, 2016, 14(1): 26. YANG B, MA PQ, SUN J, et al. Determination of equilibrium solubility and apparent oil/water partition coefficients of pramipexole dihydrochloride by HPLC[J]. Chin J Pharm:Network Ed, 2016, 14(1): 26. |
| [14] |
薛璟, 贾晓斌, 谭晓斌, 等. 雷公藤甲素表观油水分配系数的测定及其对吸收预测的研究[J]. 中国药学杂志, 2009, 44(20): 1560. XUE J, JIA XB, TAN XB, et al. Determination of apparent oil/water partition coefficient and absorption prediction of triptolide[J]. Chin Pharm J, 2009, 44(20): 1560. |
| [15] |
ABRAHAM DJ. Burger's Medicinal Chemistry and Drug Discovery.Vol 2:Drug Discover and Drug Development[M]. 6th ed. New Zealand: John Wiley & Sons Inc, 2003, 249.
|
| [16] |
黄群莲, 邓以平, 徐绍友. 紫外分光光度法测定氧氟沙星的解离常数[J]. 中国药房, 2010, 21(41): 3907. HUANG QL, DENG YP, XU SY. Determination of dissociation constants of ofloxacin by UV spectrophotometry[J]. China Pharm, 2010, 21(41): 3907. |
| [17] |
曹颖, 李永吉, 吕邵娃, 等. 丁香苦苷解离常数及油水分配系数的测定[J]. 中国实验方剂学杂志, 2011, 17(23): 65. YING C, LI YJ, LÜ SW, et al. Determination of dissociation constants and apparent oil/water partition coefficient of syringopicroside[J]. Chine J Exp Tradit Med Form, 2011, 17(23): 65. DOI:10.3969/j.issn.1005-9903.2011.23.020 |
| [18] |
平其能. 现代药剂学[M]. 北京: 中国医药科技出版社, 1998, 24. PING QN. Modern Pharmaceutics[M]. Beijing: China Medical Science and Technology Press, 1998, 24. |
| [19] |
陶涛, 赵雁, 陈庆华. 石杉碱甲的解离常数、表观溶解度和表观油/水分配系数的测定[J]. 中国医药工业杂志, 2005, 36(8): 487. TAO T, ZHAO Y, CHEN QH. Determination of dissociation constant, apparent solubility and apparent partition coefficient of huperzine A[J]. Chin J Pharm, 2005, 36(8): 487. |
| [20] |
MOHAMMADIAN F, PILEHVARSOLTANAHMADI Y, MOFARRAH M, et al. Down regulation of miR-18a, miR-21 and miR-221 genes in gastric cancer cell line by chrysin-loaded PLGA-PEG nanoparticles[J]. Artif Cells Nanomed Biotechnol, 2016, 44(8): 1972. DOI:10.3109/21691401.2015.1129615 |
 2018, Vol. 38
2018, Vol. 38 
