2. 北京市药品检验所, 中药成分分析与生物评价北京市重点实验室, 北京 102206
2. Beijing Institute for Drug Control, Beijing Key Laboratory of Analysis and Evaluation on Chinese Medicine, Beijing 102206, China
白茅根为禾本科植物白茅Imperata cylindrical Beauv. var. major (Nees) C.E. Hubb.的干燥根茎,具有凉血止血及清热利尿的功效,用于血热吐血,衄血,尿血,热病烦渴,湿热黄疸,水肿尿少,热淋涩痛[1]。白茅根中活性成分有三萜、糖、内酯、有机酸、香豆素等类成分,并含有钾、铁、钙等多种元素[2]。糖类是白茅根的主要化学成分,研究表明,白茅根中糖的含量达总提取物的80%以上;糖类主要有多糖、葡萄糖、果糖、木糖和蔗糖等[3]。近年对白茅根多糖的研究较多[4-6],单糖及二糖的含量测定未见报道。
目前,糖类化合物色谱检测方法有多种,如高效液相色谱法、气相色谱法及纸色谱法等,其中高效液相色谱法快速、准确,得到广泛应用。常采用的检测器有蒸发光散射检测器(ELSD)[7-11]和示差折光率检测器(RID)[12],由于RID灵敏度较低,无法进行梯度洗脱,易受温度和流动相的影响,在进行多组分分析时效果不好。ELSD灵敏度较高,可以进行梯度洗脱,得到了广泛的应用,但由于结构的特点,其耐用性和稳定性存在不足。电喷雾检测器(CAD)是近年来发展起来的一种新型检测器,与紫外检测器、RID和ELSD相比,该检测器属于通用型质量检测器,灵敏度高,稳定性和耐用性较好,分析测定单糖和二糖等低聚糖[13-15]有较好的效果。
为分析白茅根中的果糖(单糖)、葡萄糖(单糖)和蔗糖(二糖)3个糖类成分的含量,明确其在白茅根品质评价中的意义,本文建立了高效液相色谱-电喷雾检测器法(HPLC-CAD法)同时测定单糖、二糖的含量,并对测定结果进行了分析,以期准确评测不同来源白茅根样品的质量差异,为其质量标准的提高提供可行的方法和依据。
1 仪器与试药 1.1 仪器ThermoUltiMate 3000高效液相色谱仪,Corona Ultra RS电喷雾检测器(上海赛默飞仪器公司);Sartorius CP225D电子分析天平(精密度为0.0001,赛多利斯公司);SB25-12D型超声波清洗器(宁波新芝生物科技股份有限公司)。
1.2 试药对照品D-果糖(批号100231-201606,纯度99.7%)、D-无水葡萄糖(批号110833-201506,纯度99.9%),蔗糖(批号111507-201303,纯度99.8%)供含量测定用,均由中国食品药品检定研究院提供。白茅根样品30份,分别来源于5个不同品种与6个不同产区。所有样品均为资源普查采集的植物样品,经自然干燥而成。乙腈(德国默克公司)、三乙胺(德国默克公司)为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果 2.1 混合对照品溶液的制备取D-果糖、D-无水葡糖糖、蔗糖的对照品适量,精密称定,加20%乙醇水溶液制成质量浓度分别为1.155 0、0.932 0、5.296 0 mg·mL-1的混合溶液,即得。
2.2 供试品溶液的制备取白茅根粉末约1.0 g,精密称定,置具塞锥形瓶中,精密加入20%乙醇水溶液25 mL,称量,超声处理(功率500 W,频率40 kHz)30 min,取出,放冷,再称量,用20%乙醇水溶液补足减失的量,摇匀,滤过,取续滤液,即得。
2.3 色谱条件色谱柱:Waters公司Xbridge Amide(4.6 mm×250 mm,3.5 μm);流动相:乙腈-0.2%三乙胺水溶液(75:25);流速:1 mL·min-1;柱温:30 ℃;检测器:CAD(气压55.0 Pa)。在上述色谱条件下,对照品及样品色谱图见图 1。
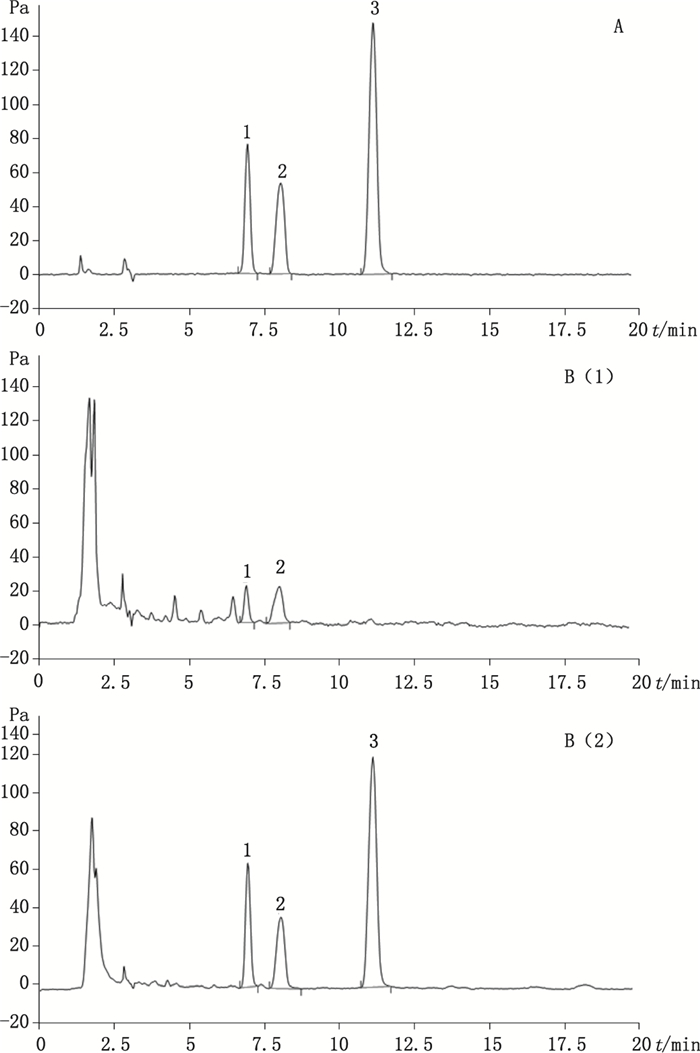
|
1.果糖(fructose) 2.葡萄糖(glucose) 3.蔗糖(sucrose) 图 1 对照品(A)及7号(B1)、16号(B2)白茅根样品HPLC色谱图 Figure 1 HPLC chromatograms of reference substances(A), sample No.7(B1) and sample No. 16(B2) of Imperatae Rhizoma |
取各对照品适量,以20%乙醇水溶液配制混合对照品溶液(果糖、葡萄糖、蔗糖的质量浓度分别为2.124 8、2.016 8、5.274 4 mg·mL-1),逐步稀释成不同浓度梯度。精密吸取系列浓度混合对照品溶液各10 μL,分别注入HPLC仪,记录峰面积;以各对照品进样量X(μg)为横坐标,峰面积Y为纵坐标,绘制标准曲线,结果见表 1。
|
|
表 1 线性关系考察结果 Table 1 The regression equation, correlation coefficient and linear range of three components |
取已知浓度的混合对照品溶液逐步稀释,照“2.3”项下色谱条件进行测定,结果当信噪比为3:1时,果糖、葡萄糖、蔗糖的检测下限分别为1.155×10-2、9.273×10-3、5.285×10-3 mg·mL-1,折算成白茅根样品的最低检出量分别为0.289、0.232、0.132 mg·g-1。
2.6 精密度试验精密吸取供试品溶液(30号样品)10 μL,连续进样6次,测得果糖、葡萄糖、蔗糖峰面积的RSD分别为0.74%、0.14%、0.75%。
2.7 稳定性试验精密吸取供试品溶液(30号样品)10 μL,分别于配制后0、2、4、8、16、24 h进样测定,测得果糖、葡萄糖、蔗糖峰面积的RSD分别为1.4%、1.1%、0.24%,结果表明供试品溶液在24 h内基本稳定。
2.8 重复性试验取样品(30号)6份,按照“2.2”项下方法制备供试品溶液,测得果糖、葡萄糖、蔗糖的平均含量(n=6)分别为28.524、25.165、55.897 mg·g-1,RSD分别为1.0%、1.1%、1.2%。
2.9 回收率试验精密称取已知含量的样品(30号)0.5 g,精密加入混合对照品溶液(果糖:0.713 4 mg·mL-1;葡萄糖:0.659 9 mg·mL-1;蔗糖:1.387 3 mg·mL-1)20 mL,按照“2.2”项下方法制备供试溶液,平行操作6份,进样10 μL进行测定,计算加样回收率,结果见表 2。
|
|
表 2 3个成分加样回收率测定结果 Table 2 Recoveries of three components |
取30批次白茅根药材,按“2.2”项下方法制备供试品溶液,按“2.3”项色谱条件进行含量测定,采用外标法计算果糖、葡萄糖、蔗糖的含量。结果见表 3、图 2。
|
|
表 3 白茅根样品中3个成分的含量测定(mg·g-1) Table 3 Content determination of three components in Imperatae Rhizoma |
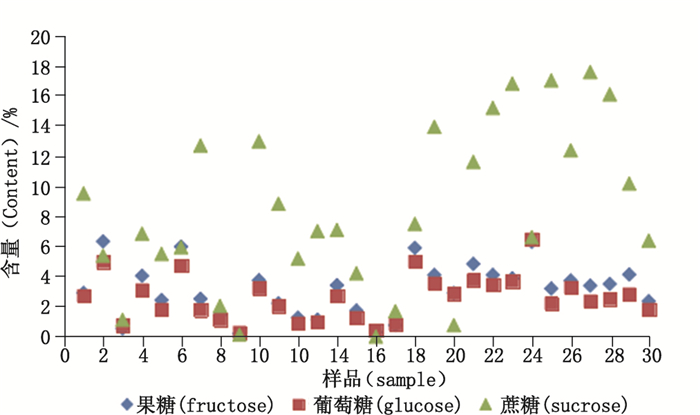
|
图 2 白茅根样品中3个成分的百分含量 Figure 2 Percentage of three components in Imperatae Rhizoma |
实验过程中还发现,个别白茅根样品的外观性状不符合《中华人民共和国药典》规定,30个白茅根样本的性状可以分为4种情况。第1类,性状符合药典规定(标记为a,共23个样本);第2类,与药典规定外观性状相比,颜色较深,疑似腐烂(标记为b,共3个样本);第3类,直径较细、尺寸偏小,不符合药典规定尺寸(标记为c,共3个样本);第4类,直径较粗,且中间是空心,疑似伪品(标记为d,共1个样本)。以欧氏距离为度量准则,以组间连结法为组群合并准则,用SPSS 8.0统计软件对30个样本的糖类成分进行系统聚类分析,结果见图 3。
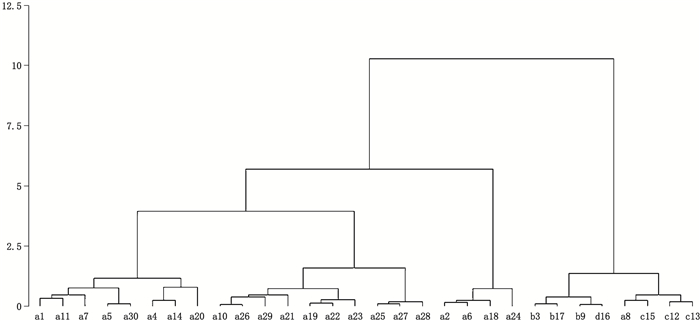
|
图 3 白茅根糖类成分聚类分析 Figure 3 Cluster analysis of sugars in Imperatae Rhizoma |
由图 3可见,在离差平方和的水平上将白茅根划分为两大类群,a8、b3、b9、b17、c12、c13、c15、d16是一类,剩下的22个样品为一类。上述b、c、d 3类样品的性状均不符合药典规定,可以看成一个大类群;聚类分析的方法可以把该类群样本与性状符合药典规定的样本聚成两类。
3 讨论 3.1 含量测定方法的考察本研究对白茅根中单糖、二糖成分进行了筛选,比较了ELSD和CAD的检测效果,考察了C18色谱柱、氨基柱以及酰胺基三键合亚乙基桥化色谱柱,结果选用白茅根中果糖、葡萄糖、蔗糖为检测指标,优化得到了HPLC-CAD色谱条件。
由于糖类成分异构体多,本研究考察了木糖、果糖、甘露糖、葡萄糖、蔗糖、麦芽糖的混合对照品溶液在所建立方法下的分离情况;结果表明在本实验条件下,混合对照品可以得到良好分离效果,白茅根样品中3个糖类成分同时测定时无其他单糖的干扰。CAD的使用简单,易于推广和应用,本文所建立的方法也可用于其他中药中单糖及二糖的分析测定。
3.2 3个成分含量比较结果与分析由图 1、表 3和图 2可知,白茅根样品除个别都同时存在果糖、葡萄糖和蔗糖。图 2显示,不同白茅根样品中果糖、葡萄糖、蔗糖3个成分组成的比例不同;多数样品中果糖与葡萄糖的含量大致相当,蔗糖的含量相对较高。不同样品中每种糖的含量也存在一定的差异;一般情况果糖的含量在2%~5%,葡萄糖含量集中在1%~4%;蔗糖含量比较分散,但大都在5%~18%范围内。1、7、10、19、21、22、23、25、26、27、28、29号样品存在一个共同性,即蔗糖的含量比较高,在0.1 g·g-1左右;2、6、18、24号样品中3个糖的组成比接近1:1:1,且含量均较高,接近5%~6%。聚类分析将30批次白茅根样品分成了性状与《中华人民共和国药典》规定有差异的样本及性状符合《中华人民共和国药典》规定的样本两大类。由聚类分析结果可以推测,不同样品中糖类成分含量的差异可能与白茅根的性状具有相关性;而白茅根性状的差异与其种质、不同产区的生长环境及采收后的存储条件有一定的联系。
3.3 小结《中华人民共和国药典》2015年版一部收录的白茅根质量标准,无含量测定项,本研究建立了白茅根中3个糖类成分的含量测定方法。考虑取正常样本中3个糖的中等含量水平果糖2.5%,葡萄糖1.5%,蔗糖5.5%为限度,该限度可以把性状不符合《中华人民共和国药典》规定的大部分样品排除在外,因此,该限度可作为白茅根药材质量控制的依据。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 84 ChP 2015. Vol Ⅰ[S]. 2015: 84 |
| [2] |
王伟, 郭庆梅, 周凤琴. 白茅根的药效考证与现代研究比较[J]. 中国海洋药物, 2014, 33(5): 92. WANG W, GUO QM, ZHOU FQ. The comparison of research on the efficacy and the modern research of Imperatae Rhizoma[J]. Chin J Mar Drug, 2014, 33(5): 92. |
| [3] |
刘荣华, 付丽娜, 陈兰英, 等. 白茅根化学成分与药理研究进展[J]. 江西中医学院学报, 2010, 22(4): 80. LIU RH, FU LN, CHEN LY, et al. Chemical constituents and pharmacology study of Imperatae Rhizoma[J]. J Jiangxi Univ Tradit Chin Med, 2010, 22(4): 80. |
| [4] |
王海峡, 吴云, 时维静, 等. 白茅根多糖的提取与含量测定[J]. 中国中医药信息杂志, 2010, 17(2): 55. WANG HX, WU Y, SHI WJ, et al. Extraction and content determination of polysaccharide in Imperata cylindrica[J]. Chin J Inf Tradit Chin Med, 2010, 17(2): 55. |
| [5] |
邱丹萍, 邹勇芳, 黄锁义, 等. 白茅根多糖提取方法的比较研究[J]. 中国酿造, 2010(1): 108. QIU DP, ZOU YF, HUANG SY, et al. Comparative study on extraction of Rhizoma Imperatae polysaccharide[J]. China Brew, 2010(1): 108. |
| [6] |
邹一可, 张明月, 王彩云, 等. 白茅根多糖IC1的分离及其相对分子质量和单糖组成的测定[J]. 中国实验方剂学杂志, 2012, 18(2): 80. ZOU YK, ZHANG MY, WANG CY, et al. Determination of molecular weight and analysis of monosaccharide composition in isolation of polysaccharide from Imperata cylindrica[J]. Chin J Exp Tradit Med Form, 2012, 18(2): 80. |
| [7] |
周立春, 纪宏. 乳果糖口服液含量的HPLC测定法研究[J]. 药物分析杂志, 2000, 20(3): 174. ZHOU LC, JI H. Development of HPLC method for lactulose oral solution assay[J]. Chin J Pharm Anal, 2000, 20(3): 174. |
| [8] |
柳杨, 王秀清, 韩波, 等. 甘油果糖氯化钠注射液含量测定方法的改进[J]. 药物分析杂志, 2017, 37(5): 911. LIU Y, WANG XQ, HAN B, et al. Improved method for the content determination of components in glycerol fructose and sodium chloride injection[J]. Chin J Pharm Anal, 2017, 37(5): 911. |
| [9] |
常亮, 陈珍珍, 吴毅, 等. HPLC-ELSD法测定黄精炮制过程中四种糖的含量[J]. 中国现代中药, 2016, 18(12): 1653. CHANG L, CHEN ZZ, WU Y, et al. Determination of four saccharides in Polygonatum processing by HPLC-ELSD[J]. Mod Chin Med, 2016, 18(12): 1653. |
| [10] |
韩爱芝, 王子坤, 马玲, 等. HPLC-ELSD法测定新疆药桑葚中可溶性糖的种类和含量[J]. 塔里木大学学报, 2017, 28(2): 1. HAN AZ, WANG ZK, MA L, et al. Determination of components and contents of water-soluble sugar in mulberry fruit of Morus nigra L.of Xinjiang by HPLC-ELSD[J]. J Tarim Univ, 2017, 28(2): 1. |
| [11] |
刘和平, 周光雄, 许彦, 等. HPLC-ELSD法测定不同储存时间党参药材中果糖、葡萄糖和蔗糖的含量[J]. 中国医药导报, 2017, 14(12): 138. LIU HP, ZHOU GX, XU Y, et al. Determination of fructose, glucose and sucrose in Codonopsis pilosula of different storage times by HPLC-ELSD[J]. China Med Her, 2017, 14(12): 138. |
| [12] |
董玮, 陈加罡, 陆斌. HPLC-RID法测定转化糖电解质注射液中果糖和葡萄糖含量[J]. 中国药师, 2014, 17(11): 1883. DONG W, CHEN JG, LU B. Determination of fructose and glucose in multiple electrolytes and invert sugar injections by HPLC with refractive index detector[J]. China Pharm, 2014, 17(11): 1883. DOI:10.3969/j.issn.1008-049X.2014.11.029 |
| [13] |
杨勇, 吴琳琳, 罗奕, 等. HPLC-CAD法测定乳制品中果糖、葡萄糖、蔗糖、乳糖、半乳糖和麦芽糖含量的不确定度评定[J]. 中国食品添加剂, 2015(9): 172. YANG Y, WU LL, LUO Y, et al. Determination of fructose, glucose, sucrose, lactose, galactose and maltose in dairy products by HPLC-CAD method[J]. China Food Addit, 2015(9): 172. |
| [14] |
游正琴, 杨勇, 许乾丽, 等. HPLC-CAD法同时测定乳制品中糖类[J]. 中国乳品工业, 2015, 43(6): 55. YOU ZQ, YANG Y, XU QL, et al. Determination of fructose, galactose, glucose, sucrose, lactose, and maltose in dairy products by HPLC-CAD[J]. China Dairy Ind, 2015, 43(6): 55. |
| [15] |
李心怡, 蒋运斌, 马逾英. 电喷雾检测器在药物HPLC分析中的优势及应用进展[J]. 中国药房, 2017, 28(15): 2152. LI XY, JIANG YB, MA YY. Advantages and application of charged aerosol detection in drug HPLC analysis[J]. China Pharm, 2017, 28(15): 2152. DOI:10.6039/j.issn.1001-0408.2017.15.38 |
 2018, Vol. 38
2018, Vol. 38 
