2. 马尔文仪器有限公司, 上海 200030
2. Malvern Instruments Ltd., Shanghai 200030, China
来氟米特是一个具有抗增殖活性的异
Morphologi G3-ID是一款可以测试颗粒大小,形貌以及化学组分的先进工具,该系统结合了自动颗粒成像特点和采用拉曼光谱的单个颗粒化学鉴定功能,在一台仪器上即可实现全自动化的粒度和粒形分析与拉曼光谱的化学组分分析,适合于解决颗粒粒度与粒形无法提供足够信息的复杂颗粒表征问题。
在仿制药一致性评价过程中,原料药的晶型、粒度以及制剂与参比制剂的处方、溶出曲线比较是研究的主要内容。但多数情况下,参比制剂较易获得,而参比制剂所用原料以及制剂处方不易获得。当两者溶出曲线存在差异时,如何分析引起差异的原因,给仿制药一致性评价工作带来一定困难。在参比制剂的处方和制剂工艺等具体信息不足的条件下,可采用Morphologi G3-ID颗粒表征系统,对固体制剂的崩解液进行分析,通过拉曼光谱区分处方所用辅料与原料药,通过颗粒成像系统获得原料药的粒度、粒形,进而获得制剂中原料药的粒度分布结果并由此分析其对体外溶出曲线的影响。
1 仪器与试药Varian VK7025+VK8000自动溶出度仪,岛津LC-20A高效液相色谱仪,Marven Morphologi G3-ID全自动粒度粒形和化学成分分析仪,天大天发ZKT-18F真空脱气仪,Millipore超纯水机等。
磷酸二氢钾、醋酸钠、氢氧化钠、盐酸、乙酸等(均来自国药集团化学试剂有限公司),来氟米特对照品(中国食品药品检定研究院,批号100571-200601,含量99.5%),来氟米特片(参比制剂SANOFI,批号5H03A,规格10 mg;受试制剂:国产来氟米特片,批号151201,规格10 mg)。
2 方法与结果 2.1 溶出曲线考察 2.1.1 溶出介质的制备选用pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液及水4种溶出介质,考察受试制剂与参比制剂的溶出差异。
pH 1.0盐酸溶液:取盐酸9 mL,加水稀释至1 000 mL,摇匀,即得。
pH 4.5醋酸盐缓冲液:取2 mol·L-1醋酸溶液14.0 mL和醋酸钠2.99 g,加水稀释至1 000 mL,摇匀,即得。
pH 6.8磷酸盐缓冲液:取0.2 mol·L-1磷酸二氢钾250 mL和0.2 mol·L-1氢氧化钠溶液112 mL混合后,加水稀释至1 000 mL,摇匀,即得。
2.1.2 溶出曲线的绘制采用“2.1.1”项下的4种溶出介质及USP溶出度测定条件桨法,转速为100 r·min-1,取样时间点分别为:5、10、15、30、45、60、90、120、150、180 min,取溶出液5 mL,并及时补入同体积同温度溶出介质,溶出液滤过,作为供试品溶液。另精密量取来氟米特对照品适量,分别加入相应的溶出介质,稀释制成每1 mL中约含11 μg来氟米特的溶液,作为对照品溶液。照高效液相色谱法,以0.025 mol·L-1磷酸二氢钾溶液(磷酸调节pH 3.0)-乙腈(60:40)为流动相,检测波长210 nm。按外标法,以峰面积计算溶出度。
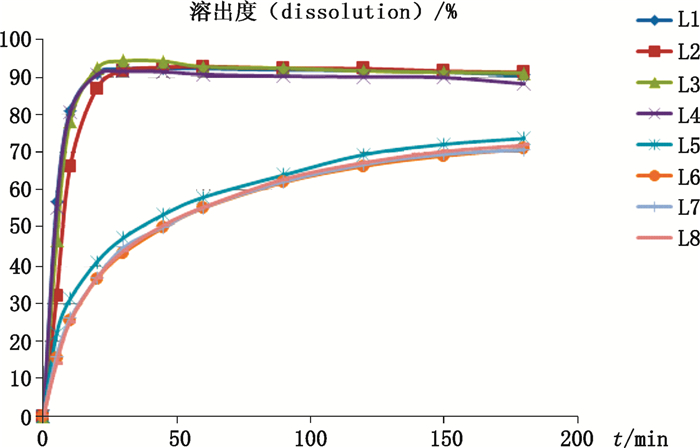
在水、pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液及pH 6.8磷酸盐缓冲液4种溶出介质中,参比制剂溶出行为基本一致,30 min时溶出量均达90%以上;国产样品溶出速率较慢,至180 min时溶出量仅达70%左右,两者溶出差异较大。
2.2 基于马尔文Morphologi G3-ID的研究采用马尔文Morphologi G3-ID全自动粒度粒形和化学成分分析仪对受试制剂与参比制剂的崩解液进行考察,从颗粒粒径分布与崩解液中原料与辅料的分散状态,分析引起溶出曲线差异的影响因素。
|
L1.原研-水(reference-water) L2.原研-pH 1.0盐酸溶液(reference-pH 1.0 solution of hydrochloride) L3.原研-pH 4.5醋酸盐缓冲液(reference-pH 4.5 buffer of acetate) L4.原研-pH 6.8磷酸盐缓冲液(reference-pH 6.8 buffer of phosphate) L5.受试-水(test-water) L6.受试-pH 1.0盐酸溶液(test-pH 1.0 solution of hydrochloride) L7.受试-pH 4.5醋酸盐缓冲液(test-pH 4.5 buffer of acetate) L8.受试-pH 6.8磷酸盐缓冲液(test-pH 6.8 buffer of phosphate) 图 1 溶出曲线比较 Figure 1 The comparison of dissolution profile |
取来氟米特片1片,溶解于30 mL去离子水中,药片基本在10 min内完全崩解;取混合均匀的颗粒悬液2 μL,滴于石英载玻片上,盖上盖玻片,用石蜡油封闭盖玻片四周,以防溶液挥发。
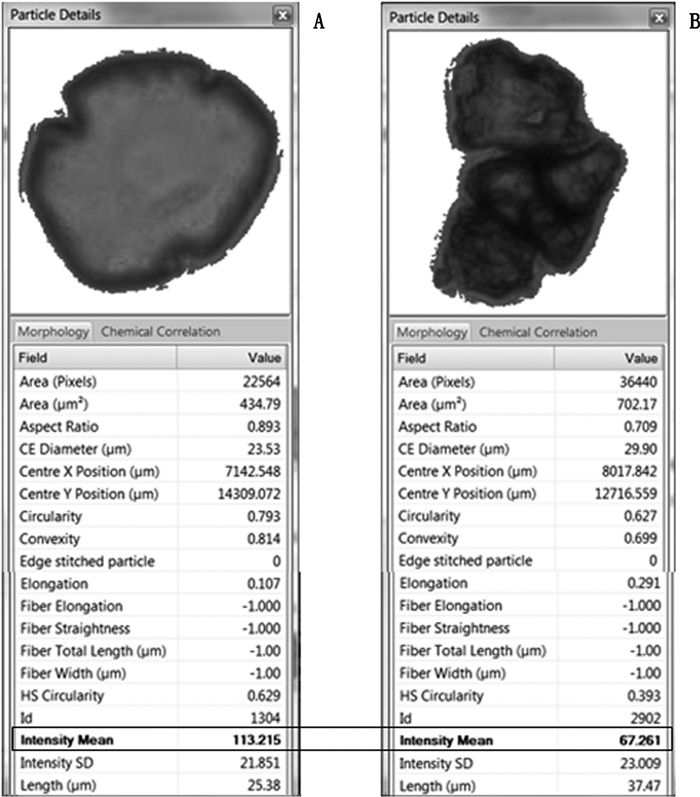
2.2.2 颗粒图像分析用Morphologi G3-ID放大倍数为20X的镜头对载玻片上指定区域进行扫描,对区域内的颗粒进行计数、成像和形态测量。通过对颗粒图像和形态参数的比较发现,崩解液中颗粒大致分为两类:一类颗粒为白色较透明,颗粒亮度平均值很高(图中篮框标示,Group 1);另一类颗粒颜色较深,呈黑色晶体状,亮度平均值较低(图中红圈标示,Group 2),见图 2、3(亮度平均值:指颗粒中各个像素所有灰度值的平均值)。

|
图 2 崩解液G3显微镜成像 Figure 2 G3 microscope image of disintegrating solution |
|
A.典型的Group 1颗粒(typical particle of Group 1) B.典型的Group 2颗粒(typical particle of Group 2) 图 3 两组颗粒的形态学参数比较 Figure 3 The morphological parameter comparision of the two groups of particles |
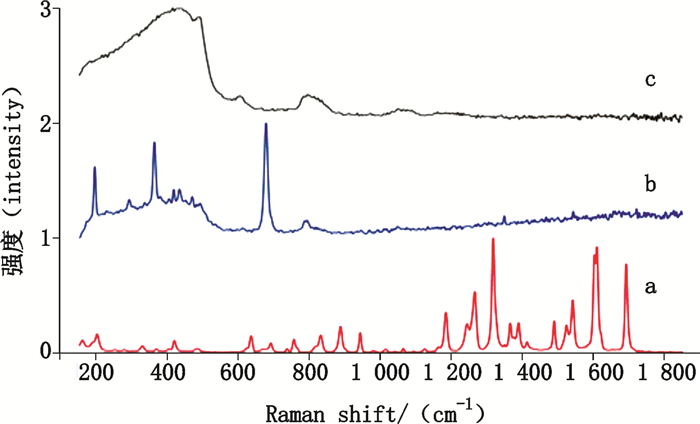
首先用来氟米特原料药和辅料纯物质建立拉曼光谱数据库,选择扫描区域内的颗粒自动进行拉曼光谱分析,将所分析颗粒的拉曼谱图与数据库进行比对,获得颗粒相对于参比物质的相关分数,详见图 4。
|
a.来氟米特原料药(leflunomide) b.辅料1(exicipient 1) c.辅料2(exicipient 2) 图 4 来氟米特原料药与辅料的拉曼光谱 Figure 4 The Raman spectrum of leflunomide and exicipients |
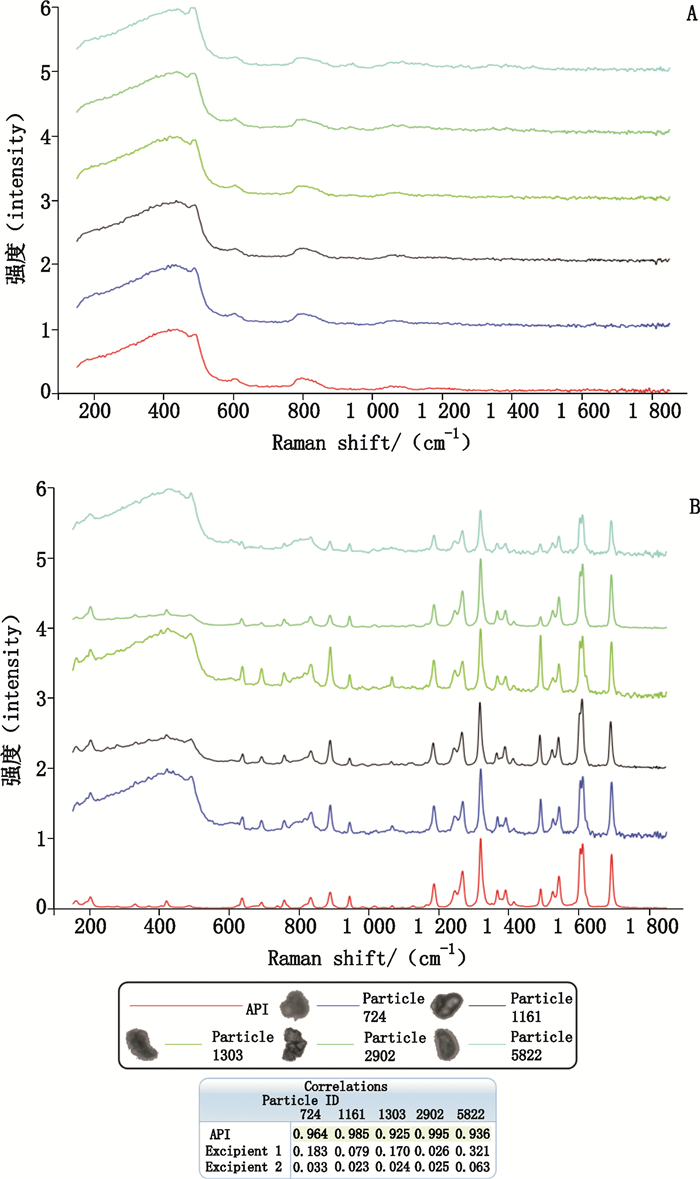
拉曼分析结果显示:亮度平均值高的Group 1颗粒基本为辅料,无明显拉曼位移峰,谱图与空白背景高度相似;亮度平均值低的Group 2颗粒绝大多数为来氟米特原料(API),其拉曼谱图与API的谱图高度相关,相关系数均大于0.8,详见图 5。
|
A. Group 1 B. Group 2 图 5 颗粒拉曼光谱 Figure 5 The Raman spectrum of paritcles |
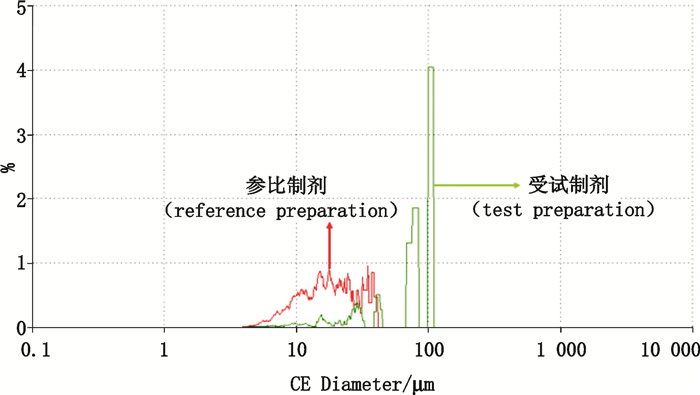
比较崩解液中来氟米特原料药的粒径分布,由表 1分析结果可知,将2种制剂在相同条件下崩解后,参比制剂的API颗粒最大粒径均不超过40 μm,而受试制剂在崩解后可形成最大粒径超过100 μm的大颗粒,导致受试制剂的API颗粒粒径分布明显大于参比制剂,两者API粒径分布频度曲线的叠加比较见图 6。
|
|
表 1 API粒径分布 Table 1 Particle size distribution of API |
|
图 6 崩解液中来氟米特粒径分布 Figure 6 The particle size distribution of leflunomide in disintegrating solution |
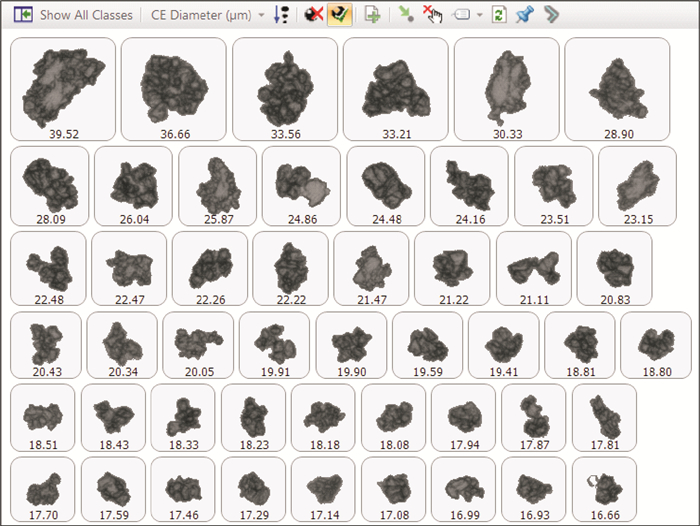
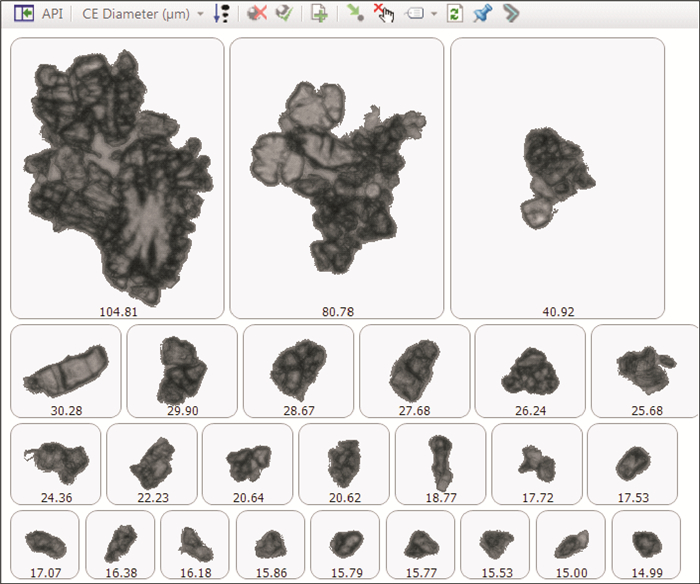
根据颗粒图像分析,在相同崩解条件下,受试制剂崩解液中存在较多“API+辅料”的团聚粒子,这类团聚粒子由API颗粒和辅料颗粒紧密包结在一起,在崩解液中形态稳定难以分散,而且形成的团聚粒子粒度分布较宽,详见图 7~9。
|
图 7 参比制剂来氟米特API颗粒图像(颗粒最大粒径不超过40 μm) Figure 7 The micromorphology of leflunomide inreference product(the maximum particle size is not more than 40 μm) |
|
图 8 受试制剂来氟米特API颗粒图像(存在粒径大于100 μm的大颗粒) Figure 8 The micromorphology of leflunomide in test product(part of particle's size bigger than 100 μm) |

|
图 9 受试制剂崩解后形成的API和辅料的团聚颗粒 Figure 9 The agglomerated particles formed by API and excipients after test products'disintegration |
根据以上研究得知,受试制剂和参比制剂在崩解后,形成的API颗粒的粒径分布不一致,可能是导致两者体外溶出曲线差异较大的原因之一。参比制剂崩解后形成的API颗粒粒度分布较小,体外溶出较快;而受试制剂崩解后API颗粒粒度分布明显偏大,也存在较多API与辅料颗粒包结团聚的现象,致使其溶出较慢。鉴于国内产品与原研产品体外溶出度差异较大,建议国内生产企业有效降低API粒径,同时优化处方工艺,避免原料与辅料团聚现象,并尽快开展该品种仿制药一致性评价。
目前,对仿制药研发而言,颗粒粒度是一项关键质量属性之一,多数仿制药厂在进行原料药采购时都会对颗粒粒度进行严格控制,在制剂生产中尽可能使用与原研制剂相同粒径的原料药,如果所使用的原料药粒径分布与原研制剂不一致,很可能会导致制剂的体外溶出度与原研制剂有差异。此外,除原料药颗粒的粒度分布以外,颗粒的晶型、形状以及制剂工艺不同,都会导致制剂溶出曲线的差异。已经有研究表明,在所使用的原料药和辅料颗粒粒度分布与原研药一致的情况下,有些制剂因后期混料和制粒等工艺不同,也会导致最终制成的片剂中原料药的颗粒大小、粒度分布和颗粒形状发生变化,从而导致体外溶出曲线与原研制剂有差异。对于这类问题,可以采用Morphologi G3-ID全自动粒度粒形和化学成分分析仪对制剂崩解液进行分析,考察制剂崩解后颗粒成分特异性的粒度分布,再结合X射线衍射技术对完整片剂进行无损式CT扫描,以考察片剂内部原料药颗粒的晶型和粒度分布,这样将多种技术结合起来,对固体片剂溶出度差异的原因进行深入分析。
| [1] |
MASARU S, MAKOTO K, MASAHISA S, et al. Effect of excipients on the particle size of precipitated Pioglitazone in the gastrointestinal tract:Impact on bioequivalence[J]. AAPS J, 2014, 16(5): 1119. DOI:10.1208/s12248-014-9646-z |
| [2] |
洪志玲, 杨红娟, 曾明. 高效液相色谱法测定来氟米特片的溶出度[J]. 海峡药学, 2012, 24(10): 63. HONG ZL, YANG HJ, ZENG M. Determination of dissolution in leflunomide tablets by HPLC[J]. Strait Pharm J, 2012, 24(10): 63. DOI:10.3969/j.issn.1006-3765.2012.10.028 |
| [3] |
姜红, 任耕, 罗粤. 新型免疫调节剂-来氟米特[J]. 中国新药与临床杂志, 2014, 23(7): 451. JIANG H, REN G, LUO Y. A new immunomodulatory:leflunomide[J]. Chin J New Drugs Clin Rem, 2014, 23(7): 451. |
| [4] |
余志勇. 来氟米特合成工艺优化及质量控制研究[D]. 大连: 大连理工大学, 2012 YU ZY. Research on Synthetic Process Optimization and Quality Control of Leflunomide[D]. Dalian: Dalian University of Technology, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10141-1012393691.htm |
| [5] |
付莉娜. 难溶性药物体外溶出评价及溶出度方法的建立[D]. 杭州: 浙江工业大学, 2014 FU LN. Study on in vitro Dissolution and Establishment of the Dissolution Methods of Poorly Soluble Drugs[D]. Hangzhou: Zhejiang University of Technology, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2620189 |
| [6] |
PHⅡPP B, PETER L, MAKOTO K, et al. IVIVC in oral absorption for fenofibrate immediate release tablets using a dissolution/permeation system[J]. J Pharm Sci, 2009, 98(6): 2001. DOI:10.1002/jps.21576 |
| [7] |
FILIPPOS K, WU YH. Understanding the effect of API properties on bioavailability through absorption modeling[J]. AAPS J, 2008, 10(4): 516. DOI:10.1208/s12248-008-9061-4 |
| [8] |
杨林, 侯小梅, 龚世学, 等. 采用多条溶出曲线评价国产盐酸普罗帕酮片的内在质量[J]. 药物分析杂志, 2014, 34(2): 372. YANG L, HOU XM, GONG SX, et al. Quality evaluation of domestic propafenone hydrochloride tablets by multiple dissolution curves[J]. Chin J Pharm Anal, 2014, 34(2): 372. |
| [9] |
伏圣青, 陈华, 南楠, 等. 艾司唑仑片溶出度检测方法的建立及溶出曲线评价[J]. 药物分析杂志, 2013, 33(5): 885. FU SQ, CHEN H, NAN N, et al. Establishment of dissolution test method of estazolam tablets and reevaluation of dissolution curves[J]. Chin J Pharm Anal, 2013, 33(5): 885. |
| [10] |
钱伟光, 田仲铭, 张晓玲, 等. 格列吡嗪制剂溶出曲线考察[J]. 药物分析杂志, 2011, 31(7): 1364. QIAN WG, TIAN ZM, ZHANG XL, et al. Inspection of dissolution curve of glipizide preparation[J]. Chin J Pharm Anal, 2011, 31(7): 1364. |
| [11] |
吴凡, 刘屹, 李志远, 等. 复方磺胺甲噁唑片溶出曲线研究[J]. 药物分析杂志, 2012, 32(2): 356. WU F, LIU Y, LI ZY, et al. Research of compound sulfamethoxazole tablets by dissolution curves[J]. Chin J Pharm Anal, 2012, 32(2): 356. |
| [12] |
马雯霞, 唐春燕, 刘秋敏, 等. 非布司他片多条溶出曲线对比研究[J]. 药学研究, 2017, 36(2): 84. MA WX, TANG CY, LIU QM, et al. Comparative study on the dissolution curves of febuxostat tablets[J]. J Pharm Res, 2017, 36(2): 84. |
| [13] |
张晖, 张伟, 陈叶廷, 等. 甲磺酸伊马替尼片溶出度方法的建立[J]. 药物分析杂志, 2015, 35(11): 2045. ZHANG H, ZHANG W, CHEN YT, et al. Establishment of dissolution determination method of imatinibmesylate tablets[J]. Chin J Pharm Anal, 2015, 35(11): 2045. |
 2018, Vol. 38
2018, Vol. 38 
