2. 内蒙古民族大学附属医院, 通辽 028000;
3. 内蒙古民族大学蒙医药学院, 通辽 028000
2. Affiliated Hospital of Inner Mongolia University for Nationalities, Tongliao 028000, China;
3. College of Traditional Medicine and Pharmacy of Inner Mongolia University for Nationalities, Tongliao 028000, China
塔日努
Agilent-1260高效液相色谱仪(美国安捷伦公司)系列,包括在线脱气机,四元泵,自动进样器,柱温箱,二极管阵列检测器。BS224S电子分析天平(北京赛多利斯仪器系统有限公司);KQ-600DB超声波清洗器(昆山市超声仪器有限公司,200 W,40 kHz)。
1.2 试药岩大戟内酯B(批号:M10A7519200,HPLC测得纯度≥98%)对照品购自上海源叶生物科技有限公司;色谱纯乙腈和乙醇购自通辽市鑫海实验器材商行。超纯水由实验室自制。其余试剂均为市售分析纯。
1.3 样品13批塔日努药材,收集于11个不同产地,经内蒙古民族大学蒙药生药教研室布和巴特尔教授鉴定为大戟科植物狼毒大戟Euphorbia fischeriana Steud.的干燥根。饮片由收集的塔日努来源药材按蒙药炮制著作《炮制明藏》[12]中奶、酒、诃子汤制塔日努炮制方法制得(即将塔日努放入8倍量的辅料中(1 kg塔日努用8 L辅料)用文火煮至辅料被吸尽时取出,晒干),药材及饮片信息见表 1。
|
|
表 1 收集的13批塔日努药材及奶、酒、诃子汤制样品信息 Table 1 The samples information of 13 batches of Tarinu and its processed products |
色谱柱为Hypersil C18(4.6 mm×250 mm,5 μm);检测波长:254 nm;流速:1.0 mL·min-1;柱温:40 ℃;流动相:乙腈(A)-0.4%磷酸水(B),梯度洗脱(0~10 min,12%A;10~40 min,12%→19%A;40~55 min,19%→50%A;55~65 min,50%→60%A,65~80 min;60%→70%A)。
2.2 对照品溶液的制备取岩大戟内酯B对照品,精密称定,加乙醇制成浓度为201 μg·mL-1的对照品储备液。
2.3 供试品溶液的制备取塔日努生品及不同炮制品粉末约1.0 g,精密称定,置于50 mL锥形瓶中,精密加入70%乙醇25 mL,称量,超声(200 W,40 kHz)30 min,放冷,称量,用乙醇补足减失的量,0.22 μm微孔滤膜滤过。
2.4 方法学考察 2.4.1 精密度试验取同一份供试品溶液,按“2.1”项下色谱条件连续测定6次,记录指纹图谱。结果表明,各供试品溶液中共有峰的保留时间及各主要峰(占总峰面积5%以上)的峰面积基本保持一致(RSD<3%),以第1次进样所得指纹图谱作为对照图谱计算相似度,结果相似度均不小于0.99,符合指纹图谱的相关技术要求(应不小于0.95)。表明该方法精密度良好。
2.4.2 稳定性试验取同一份供试品溶液,按“2.1”项下色谱条件,分别在0、2、4、8、12、24 h测定,记录色谱图,以0 h所得指纹图谱为对照,计算相似度,各指纹图谱相似度结果均不小于0.99,符合指纹图谱相关技术要求(应不小于0.95)。表明供试品溶液24 h内稳定性良好。
2.4.3 重复性试验取同一批药材,按“2.3”项下方法制备供试品溶液6份,按“2.1”项下色谱条件测定,计算相似度,结果均不小于0.97,符合指纹图谱的技术要求(不小于0.95),说明本方法重复性良好。
2.5 塔日努生品和不同炮制品指纹图谱的建立及分析 2.5.1 指纹图谱的建立将13批塔日努药材、牛奶制塔日努、酒制塔日努及诃子汤制塔日努分别按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录色谱图。分别将13批生品和炮制品指纹图谱导入“中药色谱指纹图谱相似度评价系统2004A版”软件,用中位数矢量法多点校正,分别生成塔日努生品、牛奶制品、酒制品及诃子汤制品的对照指纹图谱。共有模式及对照指纹图谱见图 1。
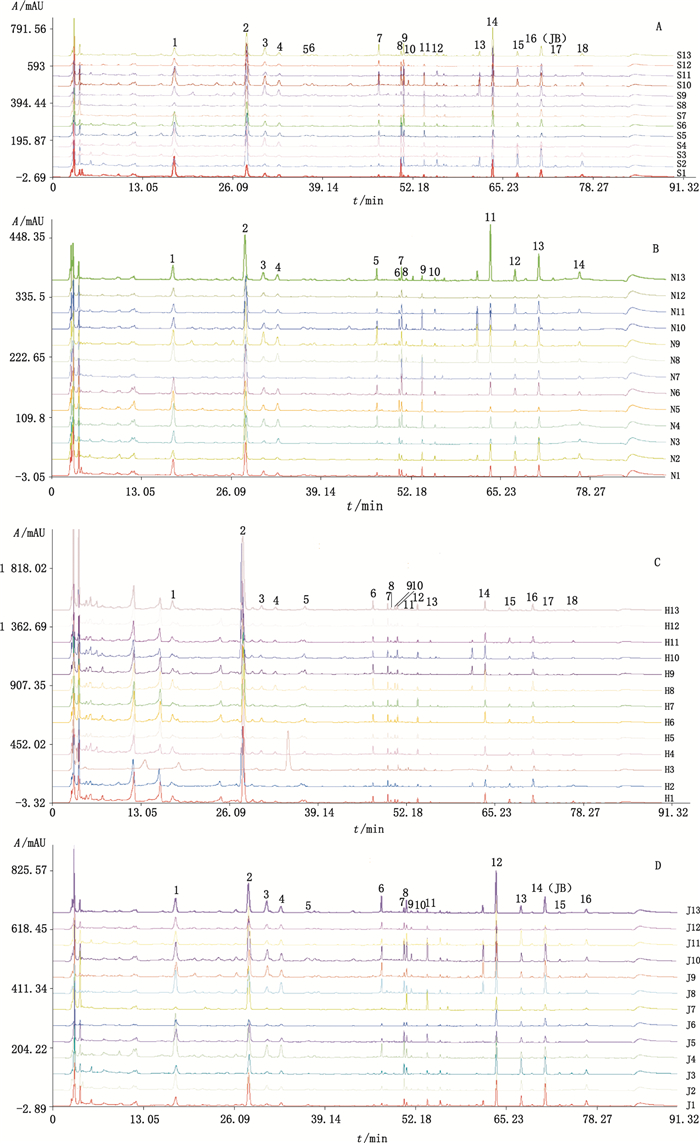
|
A.塔日努生品(raw Tarinu) B.牛奶制塔日努(milk processing Tarinu) C.诃子汤制塔日努(Terminalia chebula Retz.soup processing Tarinu) D.酒制塔日努(alcohol processing Tarinu) 图 1 共有模式指纹图谱 Figure 1 HPLC fingerprints of the common mode |
共有峰标定:经过比较,塔日努生品和诃子汤制品均有18个共有峰,酒制品有16个共有峰,奶制品有14个共有峰。生品和诃子汤制品的16号峰、奶制品13号峰、酒制品14号峰为岩大戟内酯B色谱峰,计算各峰的相对保留时间和峰面积,相对保留时间无显著性差异,相对峰面积的差异性较大,说明塔日努药材存在地域性差异。
2.5.2 色谱峰的指认与对比将13批塔日努药材指纹图谱中的主要共有峰与“2.2 ”项对照品的色谱峰进行对照,见图 2。
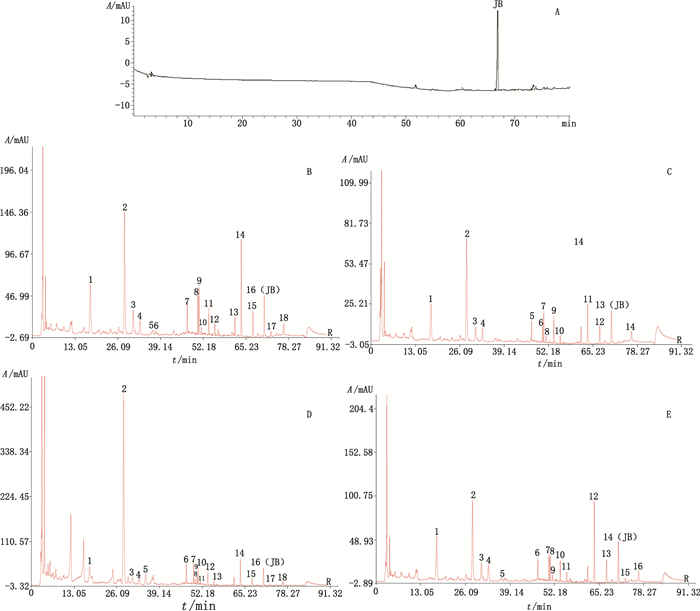
|
图 2 塔日努对照品(A)、塔日努生品(B)、奶制品(C)、诃子汤制品(D)及酒制品(E)的指纹图谱 Figure 2 The fingerprints of reference substance(A), raw Tarinu(B)and its processed products(C, D, E) |
从生成的对照图谱可以看出,塔日努经炮制后,其成分发生了变化,塔日努生品及炮制品的指纹图谱有明显区别。奶制品中5号锋消失,诃子汤制品中新增7号和8号锋、新增的7号峰峰面积较大。
2.5.3 相似度计算将各个批次的塔日努生品、奶制塔日努、酒制塔日努及诃子汤制塔日努指纹图谱分别导入“中药色谱指纹图谱相似度评价系统(2004A)版”,计算各批次样品指纹图谱与各自生成的对照图谱的相似度。其中塔日努生品及3种炮制品与对照图谱的相似度除S1(内蒙古扎鲁特旗前进镇)外,其他也均在0.9以上。见表 2。
|
|
表 2 13批塔日努药材及其3种炮制品与各自生成的对照图谱的相似度 Table 2 Similarities of 13 batches of Tarinu medicines and 3 kinds of processed products |
通过本实验建立的指纹图谱方法及对照指纹图谱,分析比较了内蒙古不同产地13批塔日努及其3种炮制品的指纹图谱,相似度大多在0.9以上,但亦有1批差异较大,这也验证了中药材具有明显的地域性,受生态环境、物种资源和栽培条件的影响,药材品质有所不同。
3.2 指认已知化合物本实验采用HPLC法,建立了塔日努及其3种炮制品的指纹图谱,其中塔日努生品和诃子汤制品均有18个共有特征峰,酒制品有16个共有峰,奶制品有14个共有峰。对特征峰的指认过程中,根据文献记载[13-14],采用岩大戟内酯B作为对照品,对塔日努及其3种炮制品的指纹图谱进行指认,岩大戟内酯B得以确认。另外,指纹图谱中峰面积较大的几个峰的成分未能确认其成分,后续将采用LC-MS对样品进行分析,对塔日努炮制品的化学成分做进一步研究。
3.3 塔日努炮制前后化学成分变化情况从图 1、2塔日努生品、牛奶制品、酒制品和诃子汤制品的指纹图谱及其对照指纹图谱可直观看出,塔日努炮制前后化学成分发生较大变化。奶制品中与生品相对应的5号锋消失,诃子汤制品中新增7号和8号锋、新增的7号峰峰面积较大,其他共有峰在量上有不同程度的变化。结果见表 3。
|
|
表 3 3种炮制品及其塔日努生品中峰面积较大的10个共有峰平均峰面积及对应峰的比较 Table 3 Comparison of average peak area of 10 common peaks with large peak area and corresponding peak in three kinds of processed products |
塔日努诃子汤制品色谱图中2号峰峰面积明显增大:与塔日努生品色谱图比较,2号峰峰面积平均增大4倍;与奶制品色谱图比较,2号峰峰面积平均增大7倍,其余的8个峰均在量上呈现降低趋势。牛奶制塔日努色谱图中6、11号峰峰面积减少较明显,与生品色谱图比较,10个共有峰均在量上呈现降低趋势,经指纹图谱初步检测,峰面积变化较大的2号峰和12号峰,需要进一步研究确认,从而确定塔日努炮制前后化学成分的变化,酒制品中除4号峰和岩大戟内酯B峰面积增加外,其余8个共有峰均在量上呈现降低趋势。推测炮制使塔日努中的某些二萜(如对照品岩大戟内酯B)含量发生变化,同时某些二萜转化成了其他物质。所选的10个共有峰在量上有不同程度的变化,其中奶制品10个共有峰全部在量上呈现降低趋势,酒和诃子汤制品有8个峰均在量上呈现降低趋势,可能是毒性成分经炮制后有所下降,导致塔日努毒性降低,各峰成分的确认有待进一步的研究。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草.蒙药卷[M]. 上海: 上海科学技术出版社, 2004, 325. Chinese Materia Medica"editorial board of State Administration of Traditional Chinese Medicine. Chinese Materia Medica.Mongolian Medicine Volume[M]. Shanghai: Shanghai Science and Technology Press, 2004, 325. |
| [2] |
哲里木盟蒙医研究所. 医药月帝[M]. 赤峰: 内蒙古科学技术出版社, 2013, 375. The Mongolian Medicine Research Institute of Jirem League. Medicine Moon Emperor[M]. Chifeng: Inner Mongolia Science and Technology Press, 2013, 375. |
| [3] |
中华人民共和国药典2015年版. 一部[S]. 2015: 286 ChP 2015. VolⅠ[S]. 2015: 286 |
| [4] |
LI WJ, LIN Y, WANG YC, et al. Development of a matrix solid-phase dispersion extraction combined with UPLC/Q-TOF-MS for determination of phenolics and terpenoids from the Euphorbia fischeriana[J]. Molecules, 2017, 22(9): 1510. DOI:10.3390/molecules22091510 |
| [5] |
WANG CJ, YAN QL, MA YF, et al. ent-Abietane and tigliane diterpenoids from the roots of Euphorbia fischeriana and their inhibitory effects against mycobacterium smegmatis[J]. J Nat Prod, 2017, 80(5): 1248. DOI:10.1021/acs.jnatprod.6b00786 |
| [6] |
CAI DF, ZHAI WY, ZHANG Q, et al. Development of matrix solid-phase dispersion coupled with high-performance liquid chromatography for determination of jolkinolide A and jolkinolide B in Euphorbia fischeriana Steud[J]. Nat Prod Res, 2017, 31(15): 1805. DOI:10.1080/14786419.2017.1297993 |
| [7] |
LEE JW, LEE C, JIN QH, et al. Diterpenoids from the roots of Euphorbia fischeriana with inhibitory effects on nitric oxide production[J]. J Nat Prod, 2016, 79(1): 126. DOI:10.1021/acs.jnatprod.5b00789 |
| [8] |
SUN YX, LIU JC. Chemical constituents and biological activities of Euphorbia fischeriana Steud[J]. Chem Biodiv, 2011, 8(7): 1205. DOI:10.1002/cbdv.v8.7 |
| [9] |
XU L, ZHI GL, YUN FC, et al. Chemotaxonomic and chemical studies on two plants from genus of Euphorbia:Euphorbia fischeriana and Euphorbia ebracteolata[J]. Biochem Syst Ecol, 2014, 57: 345. DOI:10.1016/j.bse.2014.09.009 |
| [10] |
XIN ZK, WWI L, YUICHIRO K. Euphorins A-H:bioactive diterpenoids from Euphorbia fischeriana[J]. J Nat Med, 2016, 70(3): 412. DOI:10.1007/s11418-016-0987-z |
| [11] |
王璞, 王亚旭, 王聿成, 等. 有毒蒙药常用减毒方法研究探讨[J]. 云南中医学院学报, 2013, 36(5): 68. WANG P, WANG YX, WANG YC, et al. Study on common attenuation methods for toxic Mongolian drugs[J]. J Yunnan Univ Tradit Chin Med, 2013, 36(5): 68. |
| [12] |
丹增彭措. 炮制明藏[M]. 赤峰: 内蒙古科学技术出版社, 2013, 88. DANZENGPENGCUO. Processing the Ming Dynasty[M]. Chifeng: Inner Mongolia Science and Technology Press, 2013, 88. |
| [13] |
王宏伟, 王海香, 顾雅静, 等. 狼毒大戟化学成分和药效作用研究进展[J]. 天然产物研究与开发, 2012, 24(12): 1853. WANG HW, WANG HX, GU YJ, et al. The progress of chemical constituents of Euphorbia fischeriana and pharmacodynamic study[J]. Nat Prod Res Dev, 2012, 24(12): 1853. DOI:10.3969/j.issn.1001-6880.2012.12.034 |
| [14] |
么焕开, 张文婷, 郑雪晶, 等. 狼毒大戟化学成分及药理作用研究进展[J]. 中成药, 2010, 32(8): 1404. YAO HK, ZHANG WT, ZHENG XJ, et al. Research progress in chemical constituents and pharmacological effects of Euphorbia fischeriana Steud[J]. Chin Tradit Pat Med, 2010, 32(8): 1404. |
 2018, Vol. 38
2018, Vol. 38 
