2. 福建中医药大学药学院, 福州 350108
2. Fujian University of Traditional Chinese Medicine, Fuzhou 350108, China
腹膜透析是终末期肾脏病患者常用的肾脏替代治疗方法, 而腹膜透析相关性感染是腹膜透析的严重并发症, 是导致腹膜透析患者死亡的主要原因[1-2]。此外, 严重而持久的腹膜炎可使腹膜功能衰竭, 导致患者终止腹膜透析转至血液透析[3-5]。细菌性腹膜炎是连续腹膜透析最常见的并发症, 常见的致病菌为表皮葡萄球菌、金黄色葡萄球菌和绿脓杆菌等。新型碳青霉烯类抗生素对革兰氏阴性菌、革兰氏阳性菌及厌氧菌均有很强的抗菌活性, 因此在腹膜透析相关性感染治疗中应用较广泛[6-7]。
腹腔给药可在局部达到较高药物浓度, 避免了静脉穿刺, 因此经腹腔使用抗菌药较静脉给药疗效显著[8-10]。透出液浑浊程度较重时, 可在腹膜透析液中添加肝素, 以避免纤维素凝结阻塞腹膜透析导管。已知存在配伍禁忌的抗生素和肝素不得加入同一袋透析液中[11], 如庆大霉素与肝素钠注射液存在配伍禁忌, 混有肝素后其在腹膜透析液中的稳定时间减少[9]。肝素钠注射液说明书未提示其与美罗培南存在配伍禁忌, 肝素钠注射液的加入是否影响美罗培南在腹膜透析液中的稳定性目前尚未见相关文献报道。本实验通过模拟临床, 将美罗培南与肝素钠注射液按临床常用剂量加入腹膜透析液(乳酸盐-G1.5%)中, 考察两者在37 ℃腹膜透析液(乳酸盐-G1.5%)中性状、含量及pH的变化, 有助于降低患者用药导致的不良反应的风险, 为临床合理、安全、有效联合用药提供依据。
1 仪器与试药 1.1 仪器Waters2695液相系统:配有Alliance 2695型四元梯度输液泵, Alliance2695型自动进样器, 柱温箱, 2996型二极管阵列检测器(Waters公司); Sunfire C18色谱柱(250 mm× 4.6 mm, 5 μm; 填料:十八烷基硅烷键合硅胶)(Waters公司); FE-20实验室pH计[METTLER TOLEDO/梅特勒-托利多仪器(上海)有限公司]; BSA224S电子天平[赛多利斯科学仪器(北京)有限公司]; PSH-200生化培养箱(Rowsen)。
1.2 试药美罗培南对照品(批号130506, 含量87%), 中国食品药品检定研究院。乙腈为色谱纯, 磷酸二氢钾为分析纯。注射用美罗培南(批号2164C, 规格为500 mg·瓶-1), Dainippon Sumitomo Pharma Co., Ltd.OitaPlant; 腹膜透析液(乳酸盐-G1.5%)[批号G1409807, 规格为2 000 mL(大约80 mL增量):含1.5%葡萄糖], 广州百特医疗用品有限公司; 肝素钠注射液(批号150901, 规格为2 mL:12 500单位), 南京新百药业有限公司。
2 方法与结果 2.1 溶液的制备 2.1.1 流动相称取磷酸二氢钾6.8 g, 置1 L量瓶中, 用超纯水定容至1 000 mL, 通过0.45 μm滤膜过滤脱气备用, 作为水相(B相); 纯乙腈为A相, A相和B相的比例为8:92。
2.1.2 对照品溶液精密称取美罗培南对照品约10 mg, 置于10 mL量瓶中, 加入流动相适量溶解, 然后用流动相定容至刻度, 摇匀, 即为对照品储备液。精密量取对照品储备液适量, 分别用流动相稀释制成质量浓度约为0.10、0.30、0.50及0.70 mg·mL-1的系列对照品溶液, 置于2~8 ℃冰箱保存。
2.1.3 供试品溶液精密称取注射用美罗培南约0.5 g, 置1 L量瓶中, 加腹膜透析液(乳酸盐-G1.5%)溶解并稀释至刻度, 摇匀, 即得。
2.1.4 阴性对照溶液取空白辅料无水碳酸钠0.012 g, 置于100 mL量瓶中, 用腹膜透析液(乳酸盐-G1.5%)溶解并稀释至刻度, 摇匀, 即得。
2.2 色谱条件《中华人民共和国和国药典》(以下简称中国药典)2015年版及美国药典30版分别采用220 nm及300 nm作为检测波长。本实验取0.1 mg·mL-1美罗培南对照品溶液, 在200~400 nm波长范围内扫描, 预设流动相为乙腈-0.05 mol· L-1磷酸二氢钾(pH 6.5±0.1, 8:92), 流速为1.0 mL· min-1, 通过二极管阵列检测器拟合确定, 美罗培南在检测波长为298 nm处峰面积最大、峰形最佳、干扰最少, 因此选取298 nm作为检测波长。根据上述情况, 本文将色谱系统优化为:乙腈-0.05 mol·L-1磷酸二氢钾(pH 6.5)(8:92)为流动相; 色谱柱为Waters sunfire C18柱(250 mm× 4.6 mm, 5μm); 柱温30 ℃; 检测波长298 nm, 流速为1 mL·min-1, 进样量10 μL。
2.3 方法学验证 2.3.1 专属性试验分别取对照品溶液(0.30 mg·mL-1)、供试品溶液(0.50 mg·mL-1)、阴性对照溶液, 在“2.2”项色谱条件下进样, 记录色谱图。结果表明, 在拟定的分析条件下, 美罗培南的出峰时间为7.30 min, 辅料无水碳酸钠在美罗培南峰处无干扰, 色谱图见图 1。
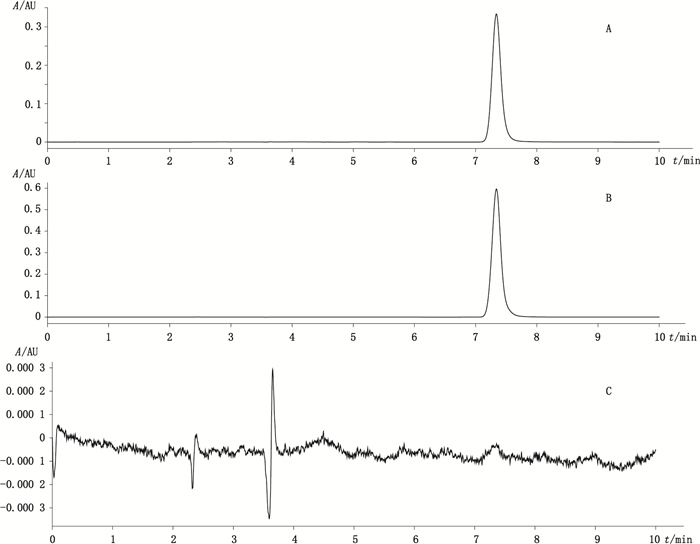
|
A.对照品溶液(0.30 mg·mL-1美罗培南)[reference solution(0.30 mg·mL-1 meropenem)] B.供试品溶液(0.50 mg·mL-1美罗培南)[test sample solution(0.50 mg·mL-1 meropenem)] C.阴性对照溶液(negative control solution) 图 1 高效液相色谱图 Figure 1 HPLC chromatograms |
按照上述色谱条件, 分别取“2.1.2”项已配制好的5个浓度的对照品溶液10 μL进样, 各浓度进样3次, 以峰面积A对浓度C(mg·mL-1)作线性回归, 得回归方程:
A=1E+07C+21 588 r=0.999 7
结果表明, 美罗培南检测质量浓度在0.1~1.0 mg·mL-1范围内与峰面积呈良好线性关系。
2.3.3 精密度试验取同1份供试品溶液, 按“2.2”项色谱条件连续进样测定6次, 美罗培南质量浓度的RSD(n=6)为0.68%, 表明方法的重复性良好。另外一个分析人员于次日在另一台Waters2695高效液相色谱仪器上重复操作, 计算美罗培南质量浓度的RSD(n=6)为0.56%, 表明方法的中间精密度良好。
2.3.4 加样回收试验精密吸取供试品溶液适量, 共9份, 分别加美罗培南对照品储备液(1.0 mg·mL-1)4、5、6 mL, 加腹膜透析液(乳酸盐-G1.5%)溶解并稀释至50 mL, 每个浓度平行配制3份溶液, 进样测定, 按峰面积以外标法计算回收率, 结果低、中、高浓度回收率分别为98.8%、95.3%、95.6%, RSD分别为2.5%、1.2%、1.0%。平均回收率(n=9)为96.5%。
2.3.5 耐用性试验取“2.1.3”项下供试品溶液, 分别采用不同柱温(25、30、35 ℃)、不同流速(0.9、1.0、1.1 mL·min-1)、不同pH(6.3、6.5、6.7)和不同波长(295、298、301 nm), 其他条件同“2.2”项, 精密量取10 μL, 注入液相色谱仪, 记录色谱图。结果不同柱温条件下美罗培南质量浓度的RSD(n=3)为1.7%, 不同流速条件下美罗培南质量浓度的RSD(n=3)为1.4%, 不同pH条件下美罗培南质量浓度的RSD(n=3)为2.0%, 不同波长条件下美罗培南质量浓度的RSD(n=3)为0.58%, 表明本方法的耐用性良好。
2.4 配伍稳定性考察将6袋腹膜透析液(每袋2 L)分为2组, 每组3袋。第一组(非肝素化组)用10.0 mL灭菌注射用水溶解美罗培南1.0 g后加入腹膜透析液(乳酸盐-G1.5%)中, 为空白对照液; 第二组(肝素化组)除加入美罗培南1.0 g外, 还加入肝素钠注射液1 000单位, 为配伍液。每组均摇晃2 min后, 放入37 ℃恒温箱中, 于0、3、6、9、12、24、30 h时取每袋腹膜透析液各3份样品, 记录外观变化、pH, 并用高效液相色谱法测定美罗培南的含量。
2.4.1 外观变化两组腹膜透析液在0~9 h内颜色均为无色, 第12 h起非肝素化组呈微黄色, 肝素化组亦呈微黄色, 但颜色略深于非肝素化组。整个过程中, 两组均未见颗粒、浑浊、沉淀产生。
2.4.2 pH变化用苯二甲酸盐标准缓冲液(25 ℃, pH 4.01)测定pH, 校正仪器, 然后分别在0、3、6、9、12、24、30 h时取样25 mL, 每份样品测定3次, 取平均值。结果2组腹膜透析液的pH无明显变化, 见表 1。
|
|
表 1 在37 ℃下478.5 mg·L-1美罗培南在肝素化和非肝素化腹膜透析液中的平均pH Table 1 Average pH of 478.5 mg·L-1 meropenem in dialysates solutions with and without heparin stored at 37 ℃ |
每袋腹膜透析液于0、3、6、9、12、24、30 h时各取3份, 按“2.2”项下色谱条件测定美罗培南的含量, 以0 h的含量为100%, 计算相对百分含量, 大于0 h含量的90%被认为是稳定的。结果表明, 非肝素化组和肝素化组中美罗培南的相对百分含量均逐渐下降, 肝素化组中美罗培南的相对百分含量下降更明显。在37 ℃无肝素的腹膜透析液(乳酸盐-G1.5%)中, 478.5 mg·L-1美罗培南在配制后的6 h内是稳定的(相对百分含量大于等于90%); 在37 ℃有肝素的腹膜透析液(乳酸盐-G1.5%)中, 478.5 mg·L-1美罗培南在配制后的3 h内是稳定的(相对百分含量大于等于90%), 结果见表 2。
|
|
表 2 在37 ℃下478.5 mg·L-1美罗培南在肝素化和非肝素化腹膜透析液中相对0 h时的百分含量(%) Table 2 Relative concentration(%, compared to 0 hour)of 478.5 mg·L-1 meropenem in dialysates solutions with and without heparin stored at 37 ℃ |
葡萄糖可脱水形成5-羟甲基糠醛, 5-羟甲基糠醛的聚合物是一种树脂状的有色物质, 导致葡萄糖溶液变色[12], 故推测无肝素组第12 h起变黄的可能原因是腹膜透析液(乳酸盐-G1.5%)含1.5%葡萄糖, 放置在37 ℃恒温箱中, 葡萄糖经脱水形成5-羟甲基糠醛, 腹膜透析液颜色变黄。但肝素化组颜色略深于非肝素化组, 提示肝素钠注射液的加入促进葡萄糖的脱水反应, 生成更多的5-羟甲基糠醛, 故而颜色较非肝素化组略黄。
3.2 美罗培南稳定性测定方法的选择早期主要采用微生物法测定美罗培南的稳定性, 但由于采用微生物法无法区分抗菌药及其降解产物, 且效力的确定主要依赖于指示的微生物, 因此在检测抗菌药的稳定性方面较不可靠。HPLC法分离效能高, 已成为目前考察抗菌药在溶液中配伍稳定性的主要方法[13]。
3.3 流动相的选择对于HPLC测定美罗培南含量的流动相, 中国药典2015年版采用0.1%三乙胺溶液[取三乙胺1.0 mL, 加水900 mL, 用磷酸溶液(1→10)调节pH至5.0, 加水稀释至1 000 mL]-乙腈(93.5:6.5)为流动相, 但三乙胺会增加分析方法的复杂性, 并且用一种不易逆转的方法改变了色谱柱的性质[14]。美国药典30版采用四丁基氢氧化铵作为离子对试剂, 具有强保留性, 难以冲洗, 易缩短柱子的寿命, 且流动相的配制较为烦琐[15]。本文采用乙腈-0.05 mol·L-1磷酸二氢钾(pH 6.5, 8:92)为流动相, 配制简单, 分析时间短, 峰形窄且无拖尾现象。
3.4 波长的选择中国药典2015年版及美国药典30版分别采用220 nm及300 nm作为检测波长。本实验取0.10 mg·mL-1美罗培南对照品溶液在200~400 nm波长范围内扫描, 预设流动相为乙腈-0.05 mol·L-1磷酸二氢钾(pH 6.5±0.1, 8:92), 流速为1.0 mL·min-1, 通过二极管阵列检测器拟合确定, 本实验中美罗培南在298 nm处峰面积最大、峰形最佳、干扰最少, 因此选取298 nm作为检测波长, 灵敏度更高, 测定结果更稳定、可靠, 与文献报道一致[16]。
3.5 腹膜炎患者采用美罗培南间歇给药方案的建议关于美罗培南在37 ℃条件下腹膜透析液中稳定性的文献报道较少。本实验发现, 将1.0 g美罗培南加入非肝素化的1.5%腹膜透析液中, 美罗培南的相对百分含量均逐渐下降, 但在配制后的6 h内是稳定的。肝素化组中美罗培南的相对百分含量较非肝素化组下降更为明显, 配制6 h相对百分含量仅87.61%±5.12%, 表明37 ℃条件下1.0 g美罗培南在肝素化的腹膜透析液(乳酸盐-G1.5%)中稳定性仅能维持3 h, 该结果提示肝素钠注射液促进了美罗培南在腹膜透析液(乳酸盐-G1.5%)中的降解, 具体机制有待进一步的研究。
为确保抗生素吸收进入血液循环, 腹膜透析相关腹膜炎患者采用间歇给药时, 加入抗生素的腹膜透析液至少留腹6 h。因此, 鉴于1.0 g美罗培南加入非肝素化的1.5%腹膜透析液在留腹6 h后才开始降解, 建议可将1.0 g美罗培南加入无肝素化的1.5%腹膜透析液中, 通过腹腔给药的方式治疗腹膜炎。由于1.0 g美罗培南加入肝素化的1.5%腹膜透析液在留腹3 h后就开始降解, 建议腹膜透析相关腹膜炎患者采用间歇给药时, 为更好地发挥美罗培南抗感染作用, 美罗培南加入腹膜透析液后不应再加入肝素钠注射液, 可在其他不含抗菌药的腹膜透析液中加入肝素钠注射液, 以预防腹膜炎时纤维蛋白的凝块增加导致腹透管堵塞造成引流不畅。
3.6 小结本实验建立了一种简便、准确、灵敏的HPLC法用于检测腹膜透析液中美罗培南的含量, 通过模拟临床, 将美罗培南按临床常用剂量加入非肝素化或肝素化的腹膜透析液(乳酸盐-G1.5%)中, 考察美罗培南在非肝素化或肝素化的在37 ℃腹膜透析液(乳酸盐-G1.5%)中性状、含量及pH的变化, 有助于降低患者用药导致的不良反应的风险, 为临床合理、安全、有效用药提供依据。
| [1] |
王牡丹, 黄丽娃, 董芍芍, 等. 腹膜透析感染性腹膜炎预后的临床分析[J]. 中国中西医结合肾病杂志, 2017, 18(3): 251. WANG MD, HUANG LW, DONG SS, et al. Clinical analysis of prognosis in peritoneal dialysis-associated peritonitis[J]. Chin J Integr Tradit West Nephrol, 2017, 18(3): 251. |
| [2] |
BOUDVILLE N, KEMP A, CLAYTON P, et al. Recent peritonitis associates with mortality among patients treated with peritoneal dialysis[J]. J Am Soc Nephrol, 2012, 23(8): 1398. DOI:10.1681/ASN.2011121135 |
| [3] |
李倩, 袁自静, 刘猛, 等. 江宁地区持续性非卧床腹膜透析患者退出原因的分析及对策[J]. 临床肾脏病杂志, 2016, 16(1): 36. LI Q, YUAN ZJ, LIU M, et al. Reasons for withdrawal of patients undergoing continuous ambulatory peritoneal dialysis in Jiangning district and corresponding countermeasures[J]. J Clin Nephrol, 2016, 16(1): 36. |
| [4] |
王成玉, 李秋林, 罗宇珍, 等. 单中心腹膜透析患者退出原因及转归分析[J]. 内科, 2017, 12(3): 415. WANG CY, LI QL, LUO YZ, et al. Analysis of the causes and outcomes of dropout in peritoneal dialysis patients in a single center[J]. Intern Med, 2017, 12(3): 415. |
| [5] |
HSIEH YP, CHANG CC, WANG SC, et al. Predictors for and impact of high peritonitis rate in Taiwanese continuous ambulatory peritoneal dialysis patients[J]. Int Urol Nephrol, 2015, 47(1): 183. DOI:10.1007/s11255-014-0763-5 |
| [6] |
李烈辉, 徐春红. 腹膜透析相关性腹膜炎196例的药物治疗与疗效分析[J]. 中华全科医师杂志, 2017, 16(5): 396. LI LH, XU CH. Antibiotics treatment for peritoneal dialysis-related peritonitis; an analysis of 196 cases[J]. Chin J Gen Pract, 2017, 16(5): 396. |
| [7] |
牛和俊, 胡志军, 陈小元, 等. 30例腹膜透析相关性腹膜炎致病菌及耐药性分析[J]. 安徽医学, 2016, 37(7): 849. NIU HJ, HU ZJ, CHEN XY, et al. Pathogenic bacteria and drug resistance in 30 cases of peritoneal dialysis related peritonitis[J]. Anhui Med J, 2016, 37(7): 849. |
| [8] |
毛雨河, 熊祖应. 腹膜透析相关性腹膜炎给药途径研究进展[J]. 中国血液净化, 2012, 11(12): 682. MAO YH, XIONG ZY. Progress in study on route of peritoneal dialysis related peritonitis[J]. Chin J Blood Purif, 2012, 11(12): 682. DOI:10.3969/j.issn.1671-4091.2012.12.012 |
| [9] |
LI PK, SZETO CC, PIRAINO B, et al. ISPD peritonitis recommendations; 2016 update on prevention and treatment[J]. Perit Dial Int, 2016, 36(5): 481. DOI:10.3747/pdi.2016.00078 |
| [10] |
黄威, 黎丽, 杨挺, 等. 头孢哌酮钠舒巴坦钠不同给药途径在腹膜透析相关性腹膜炎治疗中的疗效观察[J]. 北华大学学报(自然科学版), 2016, 17(4): 511. HUANG W, LI L, YANG T, et al. Observation on the effects of cefoperazone sodium and sulbactam sodium administrated in different routes on the treatment of peritoneal dialysis associated peritonitis[J]. J Beihua Univ(Nat Sci), 2016, 17(4): 511. |
| [11] |
陈香美. 腹膜透析标准操作规程[M]. 北京: 人民军医出版社, 2010, 85. CHEN XM. Standard Operating Procedures for Peritoneal Dialysis[M]. Beijing: People's Military Medical Press, 2010, 85. |
| [12] |
陆燕海. 葡萄糖溶液放置变色现象的探究[J]. 化学教学, 2012(12): 51. LU YH. Investigation of the phenomenon of color change in glucose solution[J]. Educ Chem, 2012(12): 51. DOI:10.3969/j.issn.1005-6629.2012.12.020 |
| [13] |
DEV F, RUTHERFORD P, FAICT D. Intraperitoneal administration of drugs in peritoneal dialysis patients; a review of compatibility and guidance for clinical use[J]. Perit Dial Int, 2009, 29(1): 5. |
| [14] |
苏坦. 三乙胺对色谱柱的影响及解决方案[J]. 中国中医药咨讯, 2010(1): 109. SU T. Influence of triethylamine on chromatographic column and the resolving project[J]. J China Tradit Chin Med Inf, 2010(1): 109. |
| [15] |
MENDEZ AS, STEPPE M, SCHAPOVAL EE. Validation of HPLC and UV spectrophotometric methods for the determination of meropenem in pharmaceutical dosage form[J]. J Pharm Biomed Anal, 2003, 33(5): 947. DOI:10.1016/S0731-7085(03)00366-2 |
| [16] |
陈婷, 黄晓会, 陈霁晖, 等. 老年患者美罗培南血药浓度监测结果分析及药物动力学研究[J]. 中国药师, 2017, 20(3): 402. CHEN T, HUANG XH, CHEN JH, et al. Serum concentration determination and pharmacokinetics of meropenem in Chinese elderly patients by HPLC[J]. China Pharm, 2017, 20(3): 402. |
 2018, Vol. 38
2018, Vol. 38 
