大环内酯类抗生素是一类具有14~16元大环内酯结构的抗菌类药物[1], 对常见的革兰氏阳性菌、部分革兰氏阴性菌、支原体和部分厌氧菌等都有良好的抗菌活性[2-4], 临床上主要用于各种组织和器官感染治疗[5-6]。大环内酯类抗生素的检测分析方法主要有微生物学法、免疫学法和色谱法[7-9]。微生物学法和免疫学法在定性方面快速、简便且特异性强, 但是无法准确定量[7]。从目前的发展看, 生物样品的分析一般首选色谱法, 主要包括高效液相色谱法和高效液相色谱串联质谱, 其定性定量能力准确快速[10-11]。在药代动力学研究中一般要求在复杂基质中进行痕量分析, 对分析方法专属性是一个很大的挑战, 同时分析方法的线性范围特别大, 这就对分析方法又提出了更严格的要求。高效液相色谱法测定含量相对较高且线性范围较窄, 因此选择高效液相色谱串联质谱测定大鼠血浆中大环内酯类抗生素的浓度。为了研究大环内酯类抗生素在体内的代谢情况, 为临床用药提供进一步指导, 笔者建立高效液相色谱串联质谱测定大鼠血浆中大环内酯类抗生素及其代谢物的分析方法。
1 仪器与材料 1.1 仪器Agilent 1260型高效液相色谱系统串联6490三重四极杆质谱(Agilent公司); AG-204电子分析天平(瑞士Mettler Toledo公司); KQ-300DE超声仪(昆山市超声仪器有限公司); TGL-16高速离心机(江苏省金坛正基仪器有限公司); N-EVAP116吹干氮气浓缩仪(Organomation Associates公司); TM-1涡旋混合器(上海兴行实业公司)。
1.2 试剂与对照品甲醇和乙腈(色谱纯, Merck公司); 甲酸、乙酸和乙酸铵(色谱纯, ACS恩科化学); 红霉素、螺旋霉素Ⅰ、新螺旋霉素Ⅰ对照品(Dr. Ehrenstorfer GmbH公司); 脱水红霉素A、红霉素A烯醇醚对照品(TRC公司), 大鼠血浆(无特定病原体级SD大鼠由中国军事医学科学院动物实验中心提供, 腹腔静脉取血后, 用肝素抗凝制备血浆, 待用, 其中肝素与血液的比例是1:10)。
2 方法与结果 2.1 对照品储备液的制备准确称取红霉素及其代谢物脱水红霉素、红霉素A烯醇醚和螺旋霉素Ⅰ及其代谢物新螺旋霉素Ⅰ的对照品各(10.0±0.1)mg, 分别置10 mL量瓶中, 加入5 mL甲醇混匀, 待固体完全溶解后, 再加入甲醇定容至10 mL, 可得1.0 mg·mL-1的大环内酯类抗生素原药及其代谢物的储备液, 并放在-18℃冰箱中保存待用。
2.2 混合对照品工作液的制备分别精密移取5个大环内酯类成分的对照品储备液100 μL至10 mL量瓶中, 用甲醇稀释并定容至刻度, 混匀后可得10 μg·mL-1大环内酯类成分混合对照品储备液, 并放置于4℃冰箱中保存待用。分别精密移取10 μg·mL-1大环内酯类抗生素混合对照品储备液10、20、50、100、200、500、1 000 μL, 分别置10 mL量瓶中, 用甲醇稀释并定容至刻度, 摇匀后得5、10、20、50、100、200、500 ng·mL-1系列混合对照品工作液, 用于当天实验。
2.3 血浆样品预处理准确称取大鼠血浆1 g, 置于10 mL离心管中, 加入乙腈5 mL和氯化钠100 mg, 涡旋1 min, 离心(5 000 r·min-1)5 min, 提取上清液5 mL至第2个50 mL离心管中, 离心残渣用上述方法重复提取2次, 合并上清液, 氮气吹干后, 加入0.025 mol·L-1磷酸盐缓冲液(pH=2.5)5 mL溶解后, 用SCX固相萃取柱净化, 5 mL甲醇、10 mL 0.1 mol·L-1磷酸二氢钾溶液和5 mL水活化萃取柱, 以上溶液上样后, 用5 mL 0.1 mol·L-1磷酸氢二钾淋洗液及5 mL甲醇洗脱, 收集洗脱液, 氮吹干后用1 mL的甲醇复溶, 待测。
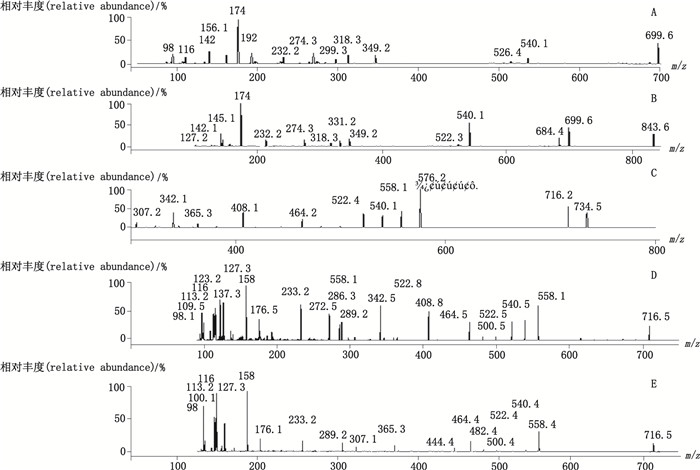
2.4 液相色谱串联质谱条件色谱柱:Hypersil Gold C18色谱柱(100 mm×2.1 mm, 5 μm, Waters公司); 柱温:室温; 进样量:5 μL; 流动相:0.1%甲酸水溶液(A)和乙腈(B), 梯度洗脱程序:0~3 min时90%A→80% A, 3~10 min时80%A→40%A, 10~12 min时40%A→90%A, 12~16 min时90%A; 流速:500 μL·min-1。离子源类型:ESI(+); 电喷雾电压:4.5 kV; 离子源温度:550℃; 雾化气压力:40 V; 辅助气压力:50 V; 气帘气压力:38 V; 碰撞室入口电压:12 V; 碰撞室出口电压:8 V; 碰撞电压、去簇电压、定性离子对、定量离子对、化合物相对分子质量等如表 1所示。图 1为5个大环内酯类成分的二级质谱扫描图。
|
|
表 1 5个大环内酯类成分的质谱条件 Table 1 The mass spetrum conditions of five macrolide antibiotics |
|
A.新螺旋霉素I(neospiramycin I) B.螺旋霉素I(spiramycin I) C.红霉素A(erythromycin A) D.脱水红霉素(anhydroerythromycin A) E.红霉素A烯醇醚(erythromycin A ene alcohol ether) 图 1 5个大环内酯类成分二级质谱扫描图 Figure 1 Two stage mass spectrograms of 5 macrolide components |
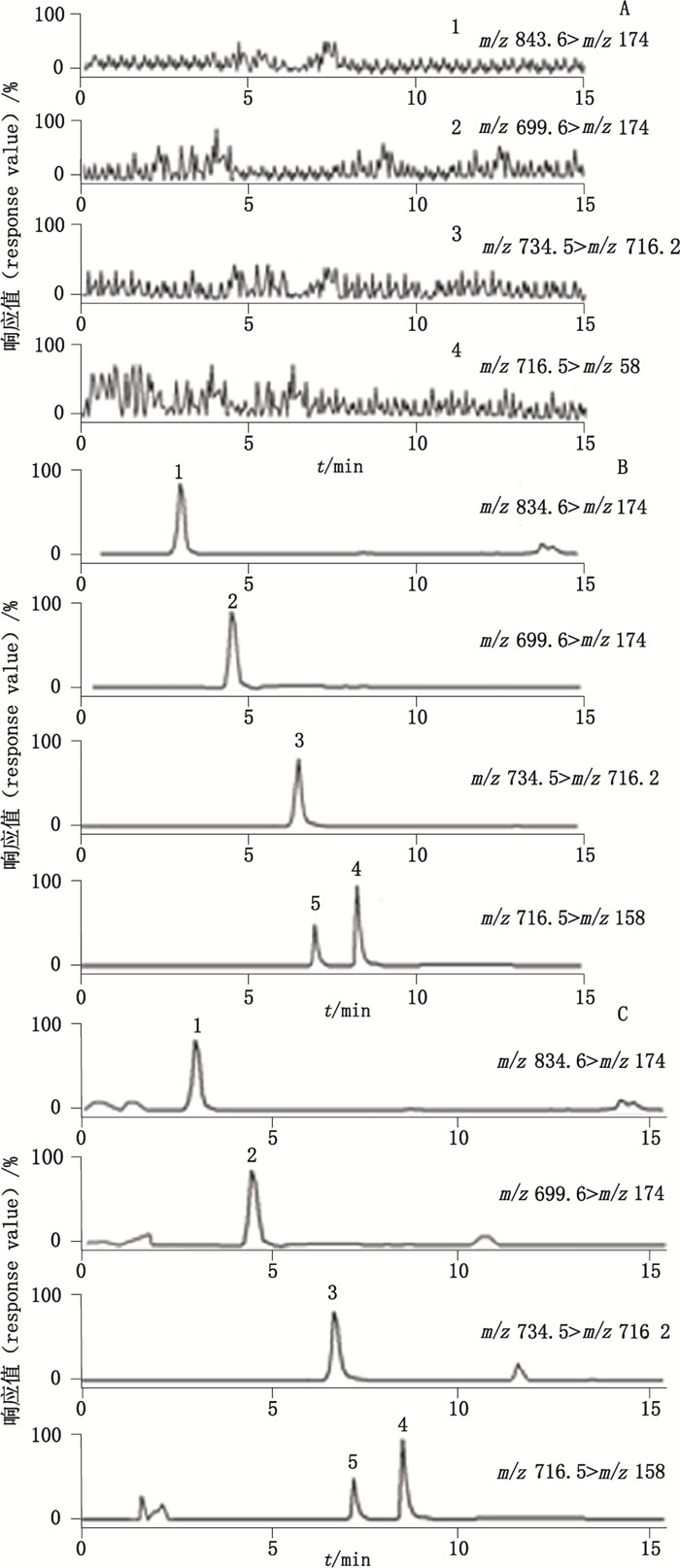
分别量取空白血浆、称取5个大环内酯类成分对照品、量取空白血浆+称取5个大环内酯类成分对照品, 制备3种溶液。制备方法按照"2.3"项下方法处理空白血浆、空白血浆+5个大环内酯类成分对照品, 3种溶液按照"2.4"项下条件进行测定, 记录色谱图, 见图 2。结果表明, 5个大环内酯类成分分离良好, 血浆内源性成分不干扰测定, 专属性好, 适宜定性和定量。
|
1.新螺旋霉素Ⅰ(neospiramycin Ⅰ) 2.螺旋霉素Ⅰ(spiramycin Ⅰ) 3.红霉素A(erythromycin A) 4.脱水红霉素A(anhydroerythromycin A) 5.红霉素烯醇醚A(erythromycin A ene alcohol ether) A.空白血浆(blank plasma) B.对照品(reference substances) C.空白血浆+ 5个大环内酯类成分对照品(blank plasma+ reference substances of five marolide components) 图 2 5个大环内酯类成分提取离子流图 Figure 2 The chromatograms of extracted ion current for five macrolide components |
在液相色谱-质谱条件下, 测定5、10、20、50、100、200、500 ng·mL-1系列混合对照品工作液。以提取离子色谱峰的峰面积(Y)为纵坐标, 质量浓度(X)为横坐标, 建立标准线性方程。结果表明, 5个大环内酯类成分质量浓度在5~500 ng·mL-1范围内r均大于0.999, 线性良好, 该方法的检测下限(S/N=3)在1.4~1.9 μg·kg-1间, 定量下限(S/N=10)在4.5~6.8 μg·kg-1间, 适合痕量分析。大环内酯类抗生素的线性方程、检出下限和定量下限如表 2所示。
|
|
表 2 5个大环内酯类成分及其代谢物的线性方程, 检测下限和定量下限 Table 2 The regression equation, the limit of detection and the limit of quantification for five macrolide components and their metabolites |
按"2.3"项下方法制备低、中、高浓度的5个大环内酯类成分各6份, 按"2.4"项下条件测定, 记录5个大环内酯类成分的峰面积A1; 另取空白血浆样品1 mL, 按照"2.3"项下方法处理样品, 得上清液后再加入相应浓度的5个大环内酯类成分对照品溶液, 混匀, 上机测定, 记录对照品的峰面积A2。计算A2/A1, 即可得提取回收率, 5个大环内酯类成分的提取回收率范围为85.52%~97.54%。取低、中、高浓度的5个大环内酯类成分对照品, 按"2.4"项下条件平行测定6份对照品, 记录峰面积A3。计算A2/A3, 即可得基质效应, 5个大环内酯类成分的基质效应在81.23%~109.3%之间。均符合生物样品分析的要求。
2.5.4 加样回收率试验和精密度试验在空白血浆中加入适量的混合对照品工作液, 使其质量浓度为10、50、200 ng·mL-1 3个水平。每个浓度重复6次实验, 计算各个浓度水平的回收率和精密度。结果显示, 5个大环内酯类成分的平均回收率在84.6%~96.2%间, 精密度在1.6%~2.5%之间, 符合检测需要。5个大环内酯类成分的回收率和精密度结果如表 3所示。
|
|
表 3 5个大环内酯类成分的回收率和精密度(n=6) Table 3 The results of recovery test and precision for five macrolide |
在空白血浆中添加混合对照品工作液, 使其质量浓度为10、50、200 ng·mL-1 3个水平的标准血浆, 分别测定6次低、中、高3个质量浓度的样品, 按"2.3"项下方法处理样品, 进样测定并计算每个浓度峰面积的RSD, 结果RSD在1.0%~2.5%之间, 符合检测需要。
2.5.6 稳定性试验将制好的标准血浆样品溶液放置0、2、4、8、24 h后分别进样, 结果显示红霉素A、螺旋霉素Ⅰ、新螺旋霉素Ⅰ、脱水红霉素A和红霉素A烯醇醚5个大环内酯类成分色谱峰面积的RSD(n=6)分别为1.3%、1.5%、1.6%、1.9%和1.1%。结果显示, 标准血浆样品溶液中的各成分在24 h内稳定性良好。
3 讨论目前对于大环内酯类抗生素体内分析的报道, 多数采用HPLC或HPLC-MS测定血浆或血清中的原药[12-13], 但其部分代谢物仍具有与原药相似的药理活性, 所以单纯测定原药并不能全面评估体内残留药物, 应同时考虑代谢物的存在, 对其代谢物进行含量测定, 这样才能全面评估血中大环内酯类药物及其代谢产物的含量[14-16]。红霉素和螺旋霉素均为临床常用的大环内酯类抗生素, 红霉素的代谢物红霉素A烯醇醚、脱水红霉素以及螺旋霉素Ⅰ(螺旋霉素的主要成分)的代谢物新螺旋霉素Ⅰ均具有药理活性, 因此建立测定血浆中红霉素和螺旋霉素及其代谢物的分析方法对临床及基础研究具有一定的参考意义。
大环内酯类抗生素的结构、理化性质和生物学效应相似, 大多数不具有紫外吸收, 而且其代谢物含量通常较低, 使用紫外检测器很难进行高灵敏度的分析, 因此本实验采用HPLC-MS测定大环内酯类抗生素及其代谢物含量[17-18]。
样品的前处理对后续的测定影响重大。本实验采用有机溶剂对样品直接沉淀, 并用固相萃取柱除去杂质, 浓缩富集, 避免液液萃取操作的烦琐及步骤太多而造成的误差, 便于快速、准确、大量地分析样品。同时比较了甲醇和乙腈除蛋白的效果, 结果显示乙腈比甲醇的效果更明显, 因此选择乙腈提取。另外, 采用单因素分析法考察乙腈的使用量, 对比3、5、10、20、30 mL使用量的提取效率, 结果显示3 mL时提取效率较低, 5~30 mL的提取效率差异较小。为了减少有机溶剂的使用, 降低后续工作量, 综合考虑选择5 mL乙腈为提取溶剂。
流动相中加入了甲酸, 可优化色谱分离, 同时抑制微生物的生长, 增加流动相的使用时长, 减少配制次数, 降低工作量, 利于日常操作。且甲酸容易挥发, 不影响质谱中的检测。
色谱柱选择方面, 分别考察了SCX柱和C18柱的萃取净化效果, 结果显示, C18柱对螺旋霉素及其代谢物的回收率不到50%, SCX柱对5个大环内酯类成分的回收率均在80%以上, 因此选择SCX柱净化样品。
质谱采用电喷雾正离子模式, 5个大环内酯类成分均有良好响应, 可同时观察到各成分的[M+H]+的母离子。在对分子离子进行二次质谱扫描时, 又得到它们的碎片离子, 并且在MRM模式下能够同时监控母离子和子离子, 对5个成分进行准确的定性定量, 如图 1所示。
最终, 本实验建立的HPLC-MS测定大环内酯类抗生素及其代谢物含量的方法, 质量浓度在5~500 ng·mL-1范围内的线性关系良好, 回收率可达84.6%~96.2%, 精密度为1.6%~2.5%, 方法检测下限为1.4~1.9 μg·kg-1, 定量下限为4.5~6.8μg·kg-1。该分析方法简单、快速, 特异性强, 适合血浆中大环内酯类成分的含量分析。
| [1] |
周伟娥, 张元, 李伟青, 等. 动物源性食品中大环内酯类药物前处理及检测方法研究进展[J]. 食品与发酵工业, 2015, 41(12): 241. ZHOU WE, ZHANG Y, LI WQ, et al. Research progress of sample preparation and testing methods on macrolides residues in animal derived foods[J]. Food Ferment Ind, 2015, 41(12): 241. |
| [2] |
ARSIC B, BARBER J, ČIKOS A, et al. 16-Membered macrolide antibiotics:a review[J]. Int J Antimicrob Agents, 2017, 51(3): 283. DOI:10.1016/j.ijantimicag.2017.05.020 |
| [3] |
武文娟, 张国俊, 胡俊祥, 等. 红霉素对支气管扩张症患者呼吸道细菌的影响[J]. 中国现代医学杂志, 2017, 27(17): 119. WU WJ, ZHANG GJ, HU JX, et al. Effect of erythromycin on respiratory tract bacteria in patients with stable bronchiectasis[J]. China J Mod Med, 2017, 27(17): 119. DOI:10.3969/j.issn.1005-8982.2017.17.025 |
| [4] |
林维宣, 陈溪, 张宁, 等. LC-MS/MS测定肠衣中7种大环内酯类抗生素残留量[J]. 食品研究与开发, 2012, 33(9): 123. LIN WX, CHEN X, ZHANG N, et al. Determination of 7 kinds of macrolides antibiotics residues in casing by LC-MS/MS[J]. Food Res Dev, 2012, 33(9): 123. |
| [5] |
王秀宏. 大环内酯类抗生素在小儿支原体肺炎(MPP)感染中的应用观察[J]. 临床医药文献电子杂志, 2017, 4(30): 5901. WANG XH. Application of macrolide antibiotics in children with mycoplasma pneumoniae(MPP)infection[J]. J Clin Med, 2017, 4(30): 5901. |
| [6] |
BENWILL JL, PHILLEY JV, BROWN-ELLIOTT BA, et al. Macrolide susceptible Mycobacterium abscessus lung infections[J]. Am J Respir Crit Care Med, 2016, 193: A3022. |
| [7] |
陈凌云. 人血浆中两种大环内酯类抗生素的UPLC-MS/MS法测定及药代动力学研究[D]. 沈阳: 沈阳药科大学, 2008 CHEN LY. Determination and Pharmacokinetics Studies of Two Macrolide Antibiotics in Human Plasma by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry[D]. Shenyang: Shenyang Pharmaceutical University, 2008 http://cdmd.cnki.com.cn/article/cdmd-10163-2008101012.htm |
| [8] |
CAI HL, WANGF, PENG WX, et al. Quantitative analysis of erythromycylamine in human plasma by liquid chromatography-tandem mass spectrometry and its application in a bioequivalence study of dirithromycin enteric-coated tablets with a special focus on the fragmentation pattern and carryover effect[J]. J Chromatogr B, 2014, 947-948: 156. DOI:10.1016/j.jchromb.2013.12.019 |
| [9] |
GARCIA-MAYOR MA, GALLEGO-PICO A, GARCINUNO RM, et al. Matrix solid-phase dispersion method for the determination of macrolide antibiotics in sheep's milk[J]. Food Chem, 2012, 134(1): 553. DOI:10.1016/j.foodchem.2012.02.120 |
| [10] |
DICKON LC. Performance characterization of a quantitative liquid chromatography-tandem mass spectrometric method for 12 macrolide and lincosamide antibiotics in salmon, shrimp and tilapia[J]. J Chromatogr B, 2014, 967: 203. DOI:10.1016/j.jchromb.2014.07.031 |
| [11] |
JO MR, LEE HJ, LEE TS, et al. Simultaneous determination of macrolide residues in fish and shrimp by liquid chromatography-tandem mass spectrometry[J]. Food Sci Biotechnol, 2011, 20(3): 823. DOI:10.1007/s10068-011-0114-6 |
| [12] |
张娟, 张红, 隋双明, 等. HPLC-UV法用于人血浆中罗红霉素的浓度测定及药代动力学和生物等效性研究[J]. 实用临床医学, 2009, 10(6): 4. ZHANG J, ZHANG H, SUI SM, et al. HPLC-UV method for determination concentration of the roxithromycin in the human plasma and study of pharmacokinetic and bioequivalence[J]. Pract Clin Med, 2009, 10(6): 4. |
| [13] |
张春宝, 何世学, 何芳, 等. HPLC-MS/MS测定人体血浆中克拉霉素浓度的方法及方法学确证[J]. 河北医药, 2010, 32(16): 2170. ZHANG CB, HE SX, HE F, et al. Determination of clarithromycin in human plasma by LC-MS/MS[J]. Hebei Med J, 2010, 32(16): 2170. DOI:10.3969/j.issn.1002-7386.2010.16.010 |
| [14] |
田蕾, 钟大放. HPLC-ECD与HPLC-MS联用测定人尿样中的罗红霉素及其代谢物[J]. 中国药学杂志, 1999, 34(5): 318. TIAN L, ZHONG DF. Determination of roxithromycin and its metabolites in human urine by HPLC-ECD and HPLC-MS[J]. Chin Pharm J, 1999, 34(5): 318. |
| [15] |
BERTHO G, LADAM P, GHARBI-BENAROUS J, et al. Solution conformation of methylated macrolide antibiotics roxithromycin and erythromycin using NMR and molecular modelling.Ribosome-bound conformation determined by TRNOE and formation of cytochrome P450-metabolite complex[J]. Int J Biol Macromol, 1988, 22(2): 103. |
| [16] |
ZHOU W, LING Y, LIU T, et al. Simultaneous determination of 16 macrolide antibiotics and 4 metabolites in milk by using quick, easy, cheap, effective, rugged, and safe extraction(QuEChERS)and high performance liquid chromatography tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1061: 411. |
| [17] |
BAUMANN M, WEISS K, MALETZKI D, et al. Aquatic toxicity of the macrolide antibiotic clarithromycin and its metabolites[J]. Chemosphere, 2015, 120: 192. DOI:10.1016/j.chemosphere.2014.05.089 |
| [18] |
周伟娥. 动物源性食品中大环内酯类抗生素及其代谢物测定方法的研究[D]. 南宁: 广西中医药大学, 2016 ZHOU WE. Determination of Macrolide Antibiotics and Their Metabolites in Animal Derived Foods[D]. Nanning: Guangxi University of Chinese Medicine, 2016 |
 2018, Vol. 38
2018, Vol. 38 