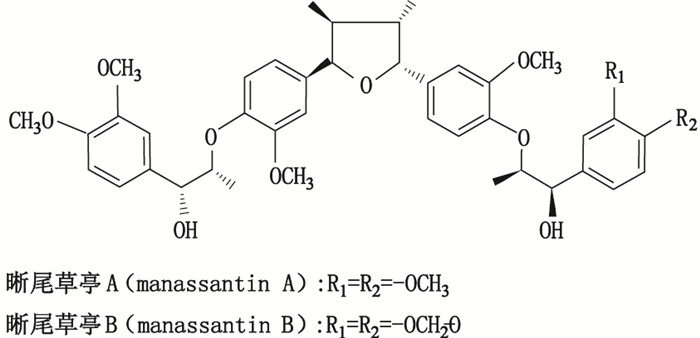
三白草属植物多分布于东亚和北美, 有三白草Saururus chinensis (Lour.) Baill.和美洲三白草Saururus cernuus L. 2种[1]。我国有三白草S. chinensis 1种, 分布于黄河流域及其以南各省, 主要以地上部分入药, 传统上主要用于治疗水肿、淋沥涩痛及湿疹等[2-3]。蜥尾草亭(manassantin) A(MA)和B(MB)是三白草属植物中2个特征性的双新木脂素类化合物(图 1), 1983年由Rao等[4]首次从S. cernuus中分离得到。研究表明, MA和MB具有显著的抗癌活性[5-6], 但由于MA和MB立体构型复杂, 化学合成难度较大[7], 目前, MA和MB的制备主要以三白草属植物为原料经分离纯化而得, 故原植物中MA和MB的含量对其提取分离影响较大, 然而迄今尚未见三白草属植物中MA和MB的含量测定方法的报道。因此, 本研究先从三白草根中分离纯化了MA和MB单体, 并进行了结构确证和纯度分析; 继而建立了三白草中MA和MB的含量测定方法, 并对三白草不同部位的MA和MB进行含量比较, 以期为靶向性地高效分离及制备MA和MB提供参考。
|
图 1 蜥尾草亭A和B的化学结构 Figure 1 The chemical structures of manassantin A and manassantin B |
Waters公司高效液相色谱仪(WatersTM 600泵, Waters 2998 PDA检测器, Empower 2.0色谱工作站), 半制备色谱柱为Phenomenex® Luna C18 100 A(250 mm×10 mm, 5 μm); Sartorius公司CP225D型十万分之一电子天平; 岛津公司LC-20AT高效液相色谱仪; Bruker公司AVANCE III-500核磁共振仪; Waters公司液相色谱质谱联用仪(Acquity UPLC-Micro Q-TOF质谱仪); 济南博纳生物技术有限公司C18反相中压柱(3.5 cm×40 cm)及SKR-10色谱填料(30 μm×100 Ǻ, 批号B20151020)。
甲醇和乙腈为色谱纯(默克公司); 蒸馏水(屈臣氏); 其余试剂均为分析纯, 购自天津市致远化学试剂有限公司; 默克公司柱色谱硅胶(0.015~0.040 mm)及高效薄层色谱硅胶板60 F254(20 cm×20 cm)。
三白草根购自安徽三义堂中药饮片有限公司, 经广东药科大学药用植物与生药学教研室张宏意博士鉴定为三白草根; 三白草全株采自广东药科大学药用植物园(23°03'29.65N, 113°24'34.74″E), 经广东药科大学药用植物与生药学教研室张宏意博士鉴定为三白草属植物三白草Saururus chinensis (Lour.) Baill.。
2 方法与结果 2.1 MA和MB的分离制备取三白草根2 kg, 粉碎成粗粉, 以20 L甲醇-二氯甲烷(1:1)冷浸提取2次, 每次7 d, 合并提取液, 减压浓缩, 得浸膏约150 g。将浸膏与硅藻土以约1:1拌样后上硅胶色谱柱, 先以500 mL环己烷-二氯甲烷(80:40;80:60;80:80;60:80;40:80;0:100)进行梯度洗脱, 再以500 mL二氯甲烷-甲醇(80:10;80:40;80:80;0:100)进行梯度洗脱。洗脱过程用薄层色谱(TLC)跟踪检查, 合并相似流分, TLC展开系统为环己烷-二氯甲烷-甲醇(40:50:5), 显色剂为5%(体积分数)硫酸乙醇溶液。取硅胶柱色谱流分经LC-MS分析精确相对分子质量, 对疑似目标物部位采用C18反相中压柱进行进一步纯化, 以甲醇-乙腈-水(45:25:30)进行洗脱; 最后利用半制备型高效液相色谱仪(Waters公司高效液相色谱仪)对C18反相中压柱分离的疑似目标物部位进行分离纯化, 流动相为甲醇-乙腈-水(45:25:30), 流速3.0 mL·min-1, 检测波长为280 nm, 得到相对分子质量相符的MA(112.2 mg)和MB(90.5 mg)。
2.2 MA和MB的结构确定MA为白色粉末, 纯度为97.0%, 分子式C42H52O11, m/z 777.352 2([M+FA-H]-)。1H-NMR (500 MHz, CDCl3):δ 0.72 (6H, d, J=4.0 Hz, H-9, 9'), 1.16 (6H, d, J=4.6 Hz, H-9″, 9″'), 2.30 (2H, s, H-8, 8'), 3.88 (12H, d, J=5.3 Hz, -OCH3×4), 3.92 (6H, s, -OCH3×2), 4.12 (2H, m, H-8″, 8″'), 4.64 (2H, d, J=7.5 Hz, H-7″, 7″'), 5.46 (2H, d, J=4.6 Hz, H-7, 7'), 6.83-7.00 (12H, m, Ar-H); 13C-NMR (125 MHz, CDCl3):δ 15.02 (C-9, 9'), 17.17 (C-9″, 9″'), 44.36 (C-8, 8'), 56.00, 56.03 (OCH3), 78.54 (C-7″, 7″'), 84.20 (C-7, 7'), 84.49 (C-8″, 8″'), 110.24, 110.27 (C-5, 5'), 111.03 (C-2, 2'), 118.85 (C-6, 6', C-6″, 6″'), 120.13 (C-5″, 5″'), 132.74, 136.63 (C-1, 1', 1″, 1″'), 146.61 (C-3, 3', 3″, 3″'), 149.01, 149.16, 150.73 (C-4, 4', 4″, 4″')。以上波谱数据与已知化合物MA的谱图数据[7-8]一致, 确认为蜥尾草亭A(manassantin A)。
MB为白色粉末, 纯度为97.5%, 分子式C41H48O11, m/z 761.330 3([M+FA-H]-)。1H-NMR (500 MHz, CDCl3):δ 0.72 (6H, dd, J=1.6、1.8 Hz, H-9, 9'), 1.16 (6H, t, J=6.6、6.9 Hz, H-9″, 9″'), 2.30 (2H, m, H-8, 8'), 3.86 (6H, d, J=7.3 Hz, -OCH3×2), 3.90 (6H, d, J=3.3 Hz, -OCH3×2), 4.12 (2H, m, H-8″, 8″'), 4.63 (2H, d, J=8.4 Hz, H-7″, 7″'), 5.47 (2H, d, J=6.0 Hz, H-7, 7'), 5.94 (2H, s, -OCH2O-), 6.77-7.00 (12H, m, Ar-H); 13C-NMR (125 MHz, CDCl3):δ 14.97 (C-9, 9'), 16.99, 17.12 (C-9″, 9″'), 44.27 (C-8, 8'), 55.94, 55.98 (OCH3), 78.46 (C-7″, 7″'), 84.00, 84.08 (C-7, 7'), 83.47 (C-8″, 8″'), 101.11 (C-OCH2O-), 107.64, 108.17 (C-5, 5'), 110.14, 110.20, 110.95 (C-2, 2'), 118.73, 118.77 (C-6, 6'), 118.81, 118.93 (C-6″, 6″'), 120.08, 121.16 (C-5″, 5″'), 132.68, 134.08, 136.55, 136.63 (C-1, 1', 1″, 1″'), 146.53, 146.40, 147.45, 147.82 (C-3, 3', 3″, 3″'), 148.93, 149.09, 150.64 (C-4, 4', 4″, 4″')。以上波谱数据与已知化合物MB的谱图数据[5, 7]一致, 确认为蜥尾草亭B(manassantin B)。
2.3 HPLC测定三白草中的MA和MB 2.3.1 对照品储备液的配制精密称取"2.1"项下分离所得的MA 1.02 mg和MB 1.03 mg, 分别置于10 mL量瓶中, 以甲醇溶解并定容, 得到对照品储备液, 4℃下保存, 备用。
2.3.2 供试品溶液的配制挖取三白草全草, 用蒸馏水洗净后将其花序、叶、茎以及根分别剪下, 微波干燥, 备用。取三白草不同部位的样品各0.5 g, 分别加入甲醇-二氯甲烷(1:1)25 mL, 超声(360 W, 25 kHz)提取30 min, 静置1 h后, 再次超声提取30 min, 静置2 h。12 000 r·min-1离心10 min, 取上清液, 即为供试品溶液。
2.3.3 色谱条件采用岛津公司LC-20AT高效液相色谱仪, Kromasil C18色谱柱(250 mm×4.6 mm, 5 μm), 柱温25℃, 流动相A为甲醇-乙腈溶液(1:1), 流动相B为水, 梯度洗脱程序(0~4 min, 40%A→70%A; 4~25 min, 70%A→80%A; 25~28 min, 80%A→40%A), 流速1 mL·min-1, 检测波长280 nm, 进样量10 μL。
2.3.4 线性关系考察取计算量的MA、MB对照品储备液进行混合, 用甲醇稀释得到质量浓度均为0.05、0.03、0.01、0.005、0.002和0.001 mg·mL-1的系列混合对照品溶液; 按"2.3.3"项下条件进行分析, 每个浓度平行测定3次, 以对照品质量浓度(X)和平均峰面积(Y)进行线性回归分析, 绘制标准曲线, 分别得到MA及MB回归方程:
Y=12 648 154.59X+1 602.96 r=0.999 2
Y=11 186 143.05X-1 185.70 r=0.999 9
结果表明MA和MB的质量浓度均在0.001~0.051 mg·mL-1的范围内线性关系良好。
2.3.5 精密度试验取同一浓度混合对照品溶液, 按"2.3.3"项下条件连续进样6针, MA和MB峰面积的RSD结果分别为1.8%和1.5%, 表明仪器精密度良好。
2.3.6 稳定性试验取同一三白草叶供试品溶液, 分别于0、3、6、9、12及24 h进样, 平行测定3次, 取平均峰面积, 比较不同时间点所测MA和MB的平均峰面积, 结果显示三白草叶供试品溶液在24 h内稳定性良好, RSD分别为1.3%和1.5%。
2.3.7 重复性试验取同一份三白草根样品约0.5 g共6份, 精密称定, 分别按"2.3.2"项下方法制备供试品溶液, 以"2.3.3"项下条件进行测定, 结果6份三白草根中MA和MB平均含量分别为39.75 μg·mL-1和29.99 μg·mL-1, RSD分别为0.49%和1.2%, 表明此方法重复性良好。
2.3.8 加样回收试验精密称取已测知含量的三白草根9份, 每份0.1 g, 分别加入高、中、低3个浓度的混合对照品溶液各3份, 按"2.3.2"项下方法制备供试溶液, 以"2.3.3"项中的色谱条件进行测定, 计算平均回收率。MA和MB的平均加样回收率分别为99.4%、101.6%, RSD均小于2%, 如表 1所示, 表明本研究的测定方法回收率良好。
|
|
表 1 三白草中的MA和MB加样回收试验结果 Table 1 Results of recovery test of MA and MB in Saururus chinensis |
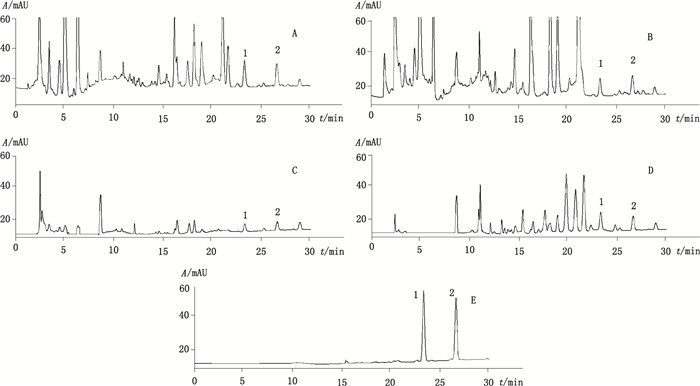
取3批三白草不同部位的样品各6份, 分别按"2.3.2"项下方法制备供试品溶液, 以"2.3.3"项下色谱条件进样测定, 典型的色谱图如图 2所示。将每份样品所测MA和MB的峰面积代入相应的回归方程, 计算MA和MB在三白草不同部位的含量, 测定结果见表 2。
|
1.蜥尾草亭A (manassantin A) 2.蜥尾草亭B(manassantin B) A.花序(inflorescence) B.叶(leaves) C.茎(stems) D.根(rhizomes) E.混合对照品(mixed reference substances) 图 2 三白草不同部位中蜥尾草亭A和B的高效液相色谱图 Figure 2 HPLC chromatograms of manassantins A and manassantins B in different parts of Saururus chinensis |
|
|
表 2 蜥尾草亭A和B在三白草不同部位中的平均百分含量(%, n=6) Table 2 Content of manassantins A and manassantins B in different parts of Saururus chinensis |
研究表明MA和MB具有显著的生物活性如抗肿瘤、抗炎[9]等。目前, 关于三白草其他活性成分如三白草酮、槲皮素、里卡灵A等的含量测定已有相关报道[10], Lee等[11]亦测定了MB在大鼠血浆中的代谢情况, 但三白草中MA和MB的含量测定尚未见报道。本实验建立了植物样本中的MA和MB的含量测定方法, 方法学考察结果表明其准确可靠, 为基于MA和MB评价三白草属植物资源奠定了基础。
同时, 尽管MA和MB具有良好的生物活性, 但由于其化学结构含有较多的手性原子, 导致化学合成困难, 而对其进行结构修饰也未能达到较好的效果[12], 故增加MA和MB的天然产物来源仍是目前亟待研究的重要课题。有研究表明, 植物次生代谢产物的累积存在组织特异性, 不同部位的活性成分含量可能有显著性差异[13-19]。王晓燕等[19]曾采用HPLC法比较了三白草不同部位中三白草酮的含量。在此实验过程中, 本文采用所建立的HPLC含量测定方法, 对三白草不同部位的MA和MB含量进行了比较, 发现三白草不同部位所含MA和MB差异较大, 其中花序中的MA和MB含量最多, 其次是叶和根。然而, 花序的采集往往受到季节的限制, 且其生物量总体较小, 而三白草叶和根中MA和MB的含量较高, 是制备MA和MB较好的选择。
| [1] |
梁汉兴. 论三白草科的系统演化和地理分布[J]. 云南植物研究, 1995, 17(3): 255. LIANG HX. On the evolution and distribution of Saururaceae[J]. Acta Bot Yunnan, 1995, 17(3): 255. |
| [2] |
中华人民共和国药典2015年版. 一部[S]. 2015: 12 ChP 2015. Vol Ⅰ[S]. 2015: 12 |
| [3] |
马林, 吴丰, 陈若芸. 三白草科植物化学及生物活性研究进展[J]. 中国中药杂志, 2003, 28(3): 196. MA L, WU F, CHEN RY. Advance of chemical constituents and bioactivity of Saururuaceae plants[J]. China J Chin Mater Med, 2003, 28(3): 196. |
| [4] |
RAO KV, ALVAREZ FM. Manassantins A/B and saucerneol:novel biologically active lignoids from Saururus cernuus[J]. Tetrahedron Lett, 1983, 24(45): 4947. DOI:10.1016/S0040-4039(01)99818-1 |
| [5] |
HODGES TW, HOSSAIN CF, KIM YP, et al. Molecular-targeted antitumor agents:the Saururus cernuus dineolignans manassantin B and 4-demethyl manassantin B are potent inhibitors of hypoxia-activated HIF-1[J]. J Nat Prod, 2004, 67(5): 767. DOI:10.1021/np030514m |
| [6] |
LIU Z, LU H, LIU R, et al. The dineolignan from Saururus chinensis, manassantin B, inhibits tumor-induced angiogenesis via down regulation of matrix metalloproteinases 9 in human endothelial cells[J]. Oncol Rep, 2014, 32(2): 659. DOI:10.3892/or.2014.3244 |
| [7] |
HANESSIAN S, REDDY GJ, CHAHAL N. Total synthesis and stereochemical confirmation of manassantin A, B, and B1[J]. Org Lett, 2006, 8(24): 5477. DOI:10.1021/ol0621710 |
| [8] |
SEO CS, LEE WH, CHUNG HW, et al. Manassantin A and B from Saururus chinensis inhibiting cellular melanin production[J]. Phytother Res, 2009, 23(11): 1531. DOI:10.1002/ptr.v23:11 |
| [9] |
LU Y, HWANG SL, SON JK, et al. Manassantin B isolated from Saururus chinensis inhibits cyclooxygenase-2-dependent prostaglandin D2 generation by blocking Fyn-mediated nuclear factor-kappaB and mitogen activated protein kinase pathways in bone marrow derived-mast cells[J]. Biol Pharm Bull, 2013, 36(8): 1370. DOI:10.1248/bpb.b13-00146 |
| [10] |
CHEN HJ, LI X, CHEN JW, et al. Simultaneous determination of eleven bioactive compounds in Saururus chinensis from different harvesting seasons by HPLC-DAD[J]. J Pharm Biomed Anal, 2010, 51(5): 1142. DOI:10.1016/j.jpba.2009.11.004 |
| [11] |
LEE JY, SONG JH, YOON IS, et al. Determination of manassantin B in rat plasma using a high performance liquid chromatography with fluorescence detection and its quantitative application to pharmacokinetic study[J]. J Chromatogr B, 2016, 1011: 121. DOI:10.1016/j.jchromb.2015.12.058 |
| [12] |
来芳芳, 刘晓宇, 牛非, 等. 新型HIF-1抑制剂三白脂素-8衍生物LXY6099的抗肿瘤作用[J]. 药学学报, 2014, 49(5): 622. LAI FF, LIU XY, NIU F, et al. A novel HIF-1 inhibitor-manassantin A derivative LXY6099 inhibits tumor growth[J]. Acta Pharm Sin, 2014, 49(5): 622. |
| [13] |
沈涛, 张霁, 赵艳丽, 等. 红花龙胆不同药用部位UV-Vis和UPLC指纹图谱研究及资源评价[J]. 中草药, 2016, 47(2): 309. SHEN T, ZHANG J, ZHAO YL, et al. UV-Vis and UPLC fingerprint analysis in various medicinal parts of Gentiana rhodantha and resource evaluation[J]. Chin Tradit Herb Drugs, 2016, 47(2): 309. DOI:10.7501/j.issn.0253-2670.2016.02.021 |
| [14] |
严辉, 段金廒, 尚尔鑫, 等. 当归不同部位入药功效取向差异的化学物质基础与药性关联性研究[J]. 中草药, 2014, 45(21): 3208. YAN H, DUAN JA, SHANG EX, et al. Study on chemical materials and drug nature association of efficacy orientation of different parts from Angelicae Sinensis Radix[J]. Chin Tradit Herb Drugs, 2014, 45(21): 3208. DOI:10.7501/j.issn.0253-2670.2014.21.029 |
| [15] |
赵婷婷, 魏华, 陈两绵, 等. 桑不同药用部位HPLC指纹图谱比较研究[J]. 中国药学杂志, 2017, 52(7): 560. ZHAO TT, WEI H, CHEN LM, et al. HPLC fingerprints of different medicinal parts of Morus alba L[J]. Chin Pharm J, 2017, 52(7): 560. |
| [16] |
HAN F, MA GQ, YANG M, et al. Chemical composition and antioxidant activities of essential oils from different parts of the oregano[J]. J Zhejiang Univ (Sci B), 2017, 18(1): 79. DOI:10.1631/jzus.B1600377 |
| [17] |
李静, 魏玉海, 秦雪梅, 等. 基于NMR代谢组学技术的当归不同部位化学成分比较[J]. 中草药, 2017, 48(7): 1409. LI J, WEI YH, QIN XM, et al. Chemical comparison of different parts of Angelicae Sinensis Radix based on NMR metabolomics[J]. Chin Tradit Herb Drugs, 2017, 48(7): 1409. |
| [18] |
周永峰, 李瑞煜, 张定堃, 等. 基于UPLC-Q-TOF/MS的五味子不同部位化学成分研究[J]. 中草药, 2017, 48(6): 1087. ZHOU YF, LI RY, ZHANG DK, et al. Chemical constituents in different parts of Schisandrae Fructus based on UPLC-Q-TOF/MS[J]. Chin Tradit Herb Drugs, 2017, 48(6): 1087. |
| [19] |
王晓燕, 黄霞, 王海波, 等. HPLC测定三白草不同药用部位三白草酮的含量[J]. 药物分析杂志, 2015, 35(8): 1505. WANG XY, HUANG X, WANG HB, et al. Determination of the content of sauchinone from different medicament portions in Saururus chinensis (Lour.) Baill.by HPLC[J]. Chin J Pharm Anal, 2015, 35(8): 1505. |
 2018, Vol. 38
2018, Vol. 38 
