2. 南京中医药大学附属中西医结合医院, 南京 210061;
3. 江苏卫生健康职业学院, 南京 211800;
4. 南京中医药大学, 南京 210023;
5. 南京海昌中药集团有限公司, 南京 210061
2. Nanjing Integrated Traditional Chinese and Western Medicine Hospital, Nanjing 210061, China;
3. Jiangsu Health Vocational College, Nanjing 211800, China;
4. Nanjing University of Chinese Medicine, Nanjing 210023, China;
5. Nanjing Haichang Chinese Medicine Corporation, Nanjing 210061, China
牛蒡子为菊科植物牛蒡(Arctium lappa L.)的干燥成熟果实, 始载于《本草图经》, 又称为恶实、大力子、蝙蝠刺等, 国内各个地区也有不同的叫法。牛蒡子味辛、苦, 性寒, 归肺、胃二经, 具有疏散风热、解毒透疹、利咽消肿等功效[1], 主产于吉林、辽宁、黑龙江、浙江等地, 以东北三省产量最大, 称作"关力子"。牛蒡子主要含牛蒡苷、牛蒡苷元等木脂素类成分及绿原酸、3, 5-二咖啡酰奎宁酸等酚酸类成分[2-3]。牛蒡苷元具有抗炎、抗病毒活性[4], 抗肿瘤活性强于牛蒡苷[5-6]; 绿原酸、隐绿原酸是互为同分异构体的单咖啡酰奎宁酸, 绿原酸为牛蒡子清热解毒的主要活性成分, 具有利胆、抗菌、抗病毒、降压、增高白血球及兴奋中枢神经系统等多种药理作用[7], 3, 5-二咖啡酰奎宁酸、3, 4-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸是互为同分异构体的二咖啡酰奎宁酸, 具有不同程度的抗氧化、抗肿瘤活性[8-9]。前期研究发现, 牛蒡子炒制之后量变成分较多, 质变成分较少[10]; 牛蒡子还含有脂肪油类成分, 含量高达26.1%, 使得牛蒡子生品性滑利, 有导泻滑肠作用, 研究表明牛蒡子炒制之后脂肪油含量下降, 可缓和其寒滑之性, 免伤脾胃, 故临床常用其炒品[11]。
2015年版《中华人民共和国药典》炒牛蒡子饮片附于牛蒡子项下, 对其只有简单的炮制方法和性状描述, 只以HPLC法只测定了牛蒡苷的含量, 不能有效控制其质量。近年来, 国内外专家对不同产地炒牛蒡子进行了质量评价研究[12-14], 但研究内容多为牛蒡苷的含量测定, 难以全面反映牛蒡子质量。为了全面控制炒牛蒡子的质量, 本文建立了同时测定炒牛蒡子中绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷和牛蒡苷元7个成分的HPLC方法, 具有简便可行, 准确、快速的特点, 可为测定炒牛蒡子中酚酸类及木脂素类成分提供方法学参考。
1 仪器与试药Shimadzu LC-20AB高效液相色谱系统(岛津公司, 包括在线脱气机、Prominence SIL-20A自动进样器、SPD-M20A二极管阵列检测器、CTO-20A柱温箱)。KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司); BP121S电子分析天平(梅特勒-托雷多公司)。YMC-Pack-ODS-A C18色谱柱(250 mm×4.6 mm, 5 μm, 以十八烷基硅烷键合硅胶为填料)(YMC Co. Ltd, Japan)。
对照品绿原酸(批号110753-201314, 纯度96.2%)购自中国食品药品检定研究院, 牛蒡苷(批号150901, 纯度100%)购自天津市科曼思特医药科技发展有限公司, 隐绿原酸(批号150728, 纯度98%)、3, 5-二咖啡酰奎宁酸(批号151028, 纯度98%)、3, 4-二咖啡酰奎宁酸(批号150726, 纯度:98%)、4, 5-二咖啡酰奎宁酸(批号150624, 纯度:98%)均购自南京森贝伽生物科技有限公司。牛蒡苷元由本实验室自制, HPLC法确定纯度大于98%。实验中不同产地炒牛蒡子样品购自中药饮片企业, 共12个产地(山东、东北、吉林、湖南、河北、安徽、江苏、四川、陕西、甘肃、广东、湖北), 经南京海源中药饮片有限公司丁斐中药师鉴定, 为菊科植物牛蒡Arctium lappa L.的干燥成熟果实。
2 方法与结果 2.1 色谱条件采用YMC-Pack-ODS-A C18(250 mm×4.6 mm, 5 μm)色谱柱; 以流动相0.1%甲酸水溶液(A)-乙腈(B)梯度洗脱(0~20 min, 5%B→15%B; 20~75 min, 15%B→35%B; 75~90 min, 35%B→ 50%B), 流速1.0 mL·min-1, 柱温35℃, 检测波长:286 nm, 进样量10 μL。混合对照品及炒牛蒡子样品的色谱图见图 1。
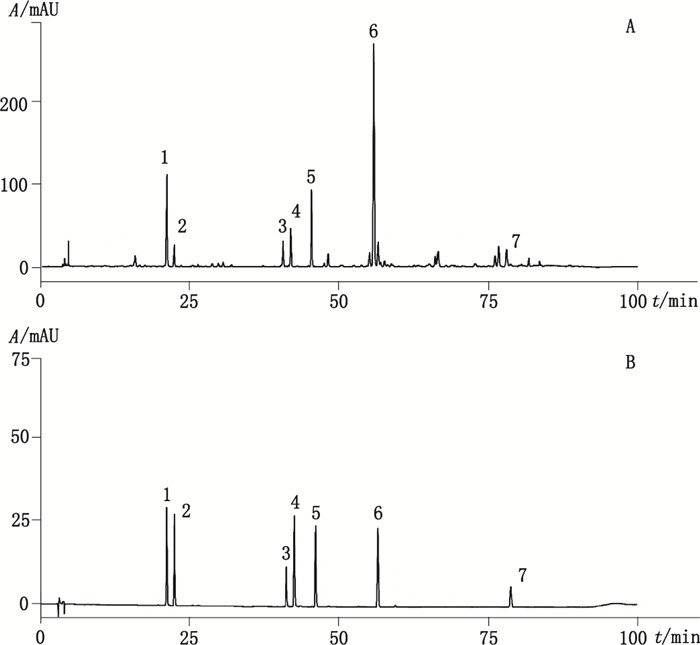
|
1.绿原酸(chlorogenic acid) 2.隐绿原酸(cryptochlorogenic acid) 3. 3, 4-二咖啡酰奎宁酸(3, 4-dicaffeoylquinic acid) 4. 3, 5-二咖啡酰奎宁酸(3, 5-dicaffeoylquinic acid) 5. 4, 5-二咖啡酰奎宁酸(4, 5-dicaffeoylquinic acid) 6.牛蒡苷(arctiin) 7.牛蒡苷元(arctigenin) 图 1 炒牛蒡子样品(A)与混合对照品(B) HPLC色谱图 Figure 1 HPLC chromatograms of processed Fructus Arctii (A) and reference substances (B) |
分别取待测成分的对照品适量, 精密称定, 加甲醇溶解, 配制成质量浓度分别为绿原酸200.80 μg·mL-1, 隐绿原酸89.20μg·mL-1, 3, 4-二咖啡酰奎宁酸122.00 μg·mL-1, 3, 5-二咖啡酰奎宁酸513.00 μg·mL-1, 4, 5-二咖啡酰奎宁酸274.00 μg·mL-1, 牛蒡苷1428.00 μg·mL-1, 牛蒡苷元205.20 μg·mL-1的混合对照品溶液, 冷藏(4℃), 备用。
2.3 供试品溶液的制备取炒牛蒡子粉(60目)1.0 g, 精密称定, 置100 mL锥形瓶中, 精密加入70%乙醇溶液60 mL, 超声(功率200 W, 频率40 kHz)提取30 min, 取出称量, 用70%乙醇补足减失的量, 静置后滤过, 取续滤液即得。
2.4 线性关系考察精密吸取混合对照品储备液一定体积, 按倍数关系稀释成5种不同质量浓度的溶液, 按上述色谱条件测定峰面积, 以峰面积(Y)对分析物浓度(X)作线性回归, 求回归方程及线性相关系数, 结果见表 1。
|
|
表 1 回归方程及线性范围 Table 1 The regression equations and linear ranges |
精密吸取"2.2"项下的混合对照品溶液10 μL, 按照"2.1"项下色谱条件连续进样6次, 结果显示:绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷、牛蒡苷元峰面积的RSD分别为0.65%、0.15%、0.58%、0.54%、0.59%、0.61%、0.87%, 表明仪器的精密度良好。
2.6 稳定性试验取同一供试品溶液, 分别在0、2、4、8、12、24 h进样测定, 记录绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷、牛蒡苷元的峰面积, 计算峰面积的RSD分别为0.62%、0.67%、0.54%、0.58%、0.55%、0.55%、0.59%, 表明供试品溶液24 h内稳定。
2.7 重复性试验精密称取山东炒牛蒡子样品粉末1.0 g, 共6份, 分到按照"2.3"项下方法制备供试品溶液, 以" 2. 1"项下的色谱条件进样测定。结果绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷、牛蒡苷元平均含量分别为4.50、0.75、3.34、2.89、4.78、64.55、16.21 mg·g-1, RSD分别为1.9%、1.2%、1.0%、1.1%、1.3%、1.4%、0.67%, 表明方法的重复性良好。
2.8 回收率试验精密称定山东炒牛蒡子样品0.5 g, 共6份, 精密加入对照品适量(与0.5 g炒牛蒡子中各成分量相当), 按"2.3"项下方法制备供试溶液, 在上述色谱条件下进样分析, 计算回收率。结果绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷、牛蒡苷元的的平均回收率分别为100.8%、99.8%、99.4%、100.6%、94.3%、96.8%、98.6%, RSD分别为1.1%、2.1%、1.9%、2.6%、2.2%、1.3%、0.76%, 表明方法的回收率良好。
2.9 样品含量测定精密称取12个不同产地炒牛蒡子样品粉末约1.0 g, 按照"2. 3"项下方法制备供试品溶液, 以"2.1"项下色谱条件进样测定, 按"2.4"项下回归方程计算绿原酸、隐绿原酸、3, 4-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、牛蒡苷、牛蒡苷元的含量, 结果见表 2、图 2。
|
|
表 2 炒牛蒡子中7个活性成分的含量(mg·g-1, n=3) Table 2 Contents of the seven active constituents in processed Fructus Arctii. |
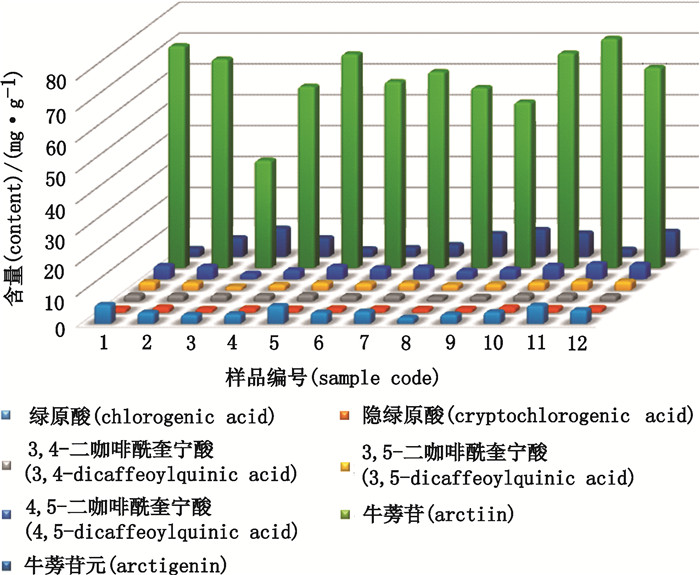
|
图 2 不同产地牛蒡子中主要活性成分含量 Figure 2 Contents of bioactive components in Fructus Arctii from different habitats |
本研究在优选供试品溶液的提取条件时, 采用不同的提取方法(超声提取、索氏提取、回流提取)、提取溶剂(30%、50%、70%乙醇溶液以及30%、50%、70%甲醇溶液)、提取时间(30、45、60、90、120 min)、溶剂倍量(20倍、40倍、60倍、80倍)制备供试品溶液, 通过进样分析比较, 最终确定的最佳提取条件为60倍量的70%乙醇溶液超声提取30 min。
此外, 本实验通过考察甲醇-水溶液、甲醇-0.1%甲酸水溶液、甲醇-0.2%甲酸水溶液、乙腈-水溶液、乙腈-0.1%甲酸水溶液、乙腈-0.2%甲酸水溶液等流动相洗脱系统, 综合比较高效液相色谱图的基线噪声、拖尾程度、分离度等因素, 最终选择乙腈-0.1%甲酸水溶液系统作为流动相。在此条件下, 供试品溶液出峰较多, 能够使所测色谱峰的形状和各峰的分离度较好, 杂质峰较少, 且基线较为平稳。实验同时对供试品溶液进行全波长扫描, 根据扫描结果确定286 nm作为测定的检测波长。
现代研究认为, 单纯选用1种或2种成分作为评价饮片质量优劣的指标, 已经不能满足中药饮片质量控制的需要, 本文采用HPLC法对12个产地炒牛蒡子中7个成分的含量进行了测定, 从表 2、图 2中7个成分的含量来看, 各个产地牛蒡苷的含量最高, 牛蒡苷、牛蒡苷元含量稍有差异, 酚酸类成分含量相当, 其中山东、安徽、广东炒牛蒡子中7个活性成分的含量均较高, 该含量测定方法简便, 结果准确, 可为制定更加科学合理的炒牛蒡子饮片质量标准, 并控制炒牛蒡子饮片质量提供科学依据。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 72 ChP 2015. VolⅠ[S]. 2015: 72 |
| [2] |
LIU QD, QIN KM, SHEN BJ, et al. Analysis of Fructus Arctii from different regions of China by HPLC coupled with chemometrics methods[J]. Acta Chromatogr, 2015, 27(4): 697. DOI:10.1556/AChrom.27.2015.4.8 |
| [3] |
齐艳明, 柏玲, 张文治. 牛蒡子化学成分研究[J]. 齐齐哈尔大学学报(自然科学版), 2012, 28(2): 19. QI YM, BAI L, ZHANG WZ. Study of chemical constituents from Arctiumlappa L[J]. J Qiqihar Univ(Nat Sci Ed), 2012, 28(2): 19. |
| [4] |
MIN KC, JANG YP, KIM YC, et al. Arctigenin, a phenylpropanoid dibenzylbutyrolactone lignan, inhibits MAP kinases and AP-1 activation via potent MKK inhibition:the role in TNF-α inhibition[J]. Int Immunopharmacol, 2004, 4(10-11): 1419. DOI:10.1016/j.intimp.2004.06.011 |
| [5] |
TAKASAKI M, KONOSHIMA T, KOMATSU K, et al. Anti-tumor-promoting activity of lignans from the aerial part of Saussurea medusa[J]. Cancer Lett, 2000, 158(1): 53. DOI:10.1016/S0304-3835(00)00499-7 |
| [6] |
MATSUMOTO T, HOSONO K, YAMADA H. Antiproliferative and apoptotic effects of butyrolactonelignans from Arctium lappa on leukemic cells[J]. Planta Med, 2006, 72(3): 276. DOI:10.1055/s-2005-916174 |
| [7] |
吴卫华, 康桢, 欧阳冬生, 等. 绿原酸的药理学研究进展[J]. 天然产物研究与开发, 2006, 18(4): 691. WU WH, KANG Z, OUYANG DS, et al. Progress in the pharmacology of chlorogenic acid[J]. Nat Prod Res Dev, 2006, 18(4): 691. |
| [8] |
MISHIMA S, INOH Y, NARITA Y, et al. Identification of caffeoylquinic acid derivatives from Brazilian propolis as constituents involved in induction of granulocytic differentiation of HL-60 cells[J]. Bioorg Med Chem, 2005, 13(20): 5814. DOI:10.1016/j.bmc.2005.05.044 |
| [9] |
JIN YK, CHO JY, MA YK, et al. Dicaffeoylquinic acid derivatives and flavonoid glucosides from glasswort (Salicornia herbacea L.) and their antioxidative activities[J]. Food Chem, 2011, 125(1): 55. DOI:10.1016/j.foodchem.2010.08.035 |
| [10] |
QIN KM, WANG B, LI WD, et al. Quality assessment of raw and processed Arctium lappa L.through multicomponent quantification chromatographic fingerprint and related chemometric analysis[J]. J Sep Sci, 2015, 38(9): 1491. DOI:10.1002/jssc.v38.9 |
| [11] |
王程田, 张学杰, 李法曾, 等. 牛蒡籽油中脂肪酸成分的气相色谱质谱联用分析[J]. 植物资源与环境学报, 2002, 11(4): 58. WANG CT, ZHANG XJ, LI FZ, et al. Analysis of fatty acid in Arctium lappa L.seed oil by GC-MS[J]. J Plant Resour Environ, 2002, 11(4): 58. |
| [12] |
许亮, 窦德强, 康廷国, 等. 炒牛蒡子质量标准研究[J]. 中成药, 2010, 32(4): 622. XU L, DOU DQ, KANG TG, et al. Study on quality standard of processed Fructus Arctii[J]. Chin Tradit Pat Med, 2010, 32(4): 622. |
| [13] |
康凯, 窦德强, 许亮, 等. 牛蒡子炮制前后HPLC指纹图谱及牛蒡苷含量比较[J]. 中国现代中药, 2009, 11(10): 22. KANG K, DOU DQ, XU L, et al. The comparison of HPLC fingerprints and arctiin content between crude and processing Fructus Arctii[J]. Mod Chin Med, 2009, 11(10): 22. DOI:10.3969/j.issn.1673-4890.2009.10.008 |
| [14] |
朱文荣, 李松. 炒牛蒡子配方颗粒的HPLC指纹图谱研究[J]. 现代药物与临床, 2014, 29(2): 158. ZHU WR, LI S. HPLC fingerprint analysis of stir-fried Arctii Fructus formula granules[J]. Drug Clin, 2014, 29(2): 158. |
 2018, Vol. 38
2018, Vol. 38 
