2. 广西-东盟食品药品安全检验检测中心, 南宁 530021;
3. 中国食品药品检定研究院, 北京 100050
2. Guangxi-ASEAN Center for Food and Drug Safety Control, Nanning 530021, China;
3. National Institutes for Food and Drug Control, Beijing 100050, China
玉叶金花为茜草科植物玉叶金花Mussaenda pubescens Ait. f.的干燥根和茎, 为广西传统壮药, 壮药名为勾北豪[1], 具有清热利湿、解毒消肿的功效, 常用于中暑、感冒、支气管炎、扁桃体炎、咽喉炎、肾炎水肿、肠炎、子宫出血、毒蛇咬伤等症。玉叶金花中主要含有单萜、三萜皂苷、环烯醚萜苷、黄酮及挥发油等类成分[2-3]。新绿原酸(5-咖啡酰基奎宁酸)、隐绿原酸(4-咖啡酰基奎宁酸)、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸及4, 5-O-二咖啡酰基奎宁酸是本课题组利用高分辨质谱从玉叶金花中分析得到的5个活性成分。药理研究表明, 环烯醚萜苷类、咖啡酰基奎宁酸类成分具有良好的抗炎、抗氧化、抗菌、抗病毒等作用[4-7], 与玉叶金花的药理活性[8-9]相一致。目前, 已有报道对玉叶金花中的单一类成分(玉叶金花苷酸甲酯、mussaendoside G)或总皂苷成分进行定量分析[10-12], 但应用HPLC法对玉叶金花中所含的环烯醚萜苷类和咖啡酰基奎宁酸类成分同时进行测定还未见报道。玉叶金花现行质量标准仅有简单的性状及理化鉴别项, 没有含量测定项, 因此, 为控制药材质量, 本研究采用HPLC法对广西不同产地玉叶金花药材中的山栀苷甲酯、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、新绿原酸、绿原酸、隐绿原酸、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸及4, 5-O-二咖啡酰基奎宁酸9个成分的含量进行测定, 为建立科学、完整的玉叶金花药材质量标准提供依据。
1 仪器和材料 1.1 仪器高分辨液相色谱-质谱联用仪(Impact Ⅱ, 布鲁克公司); 2695高效液相色谱仪(沃特世公司); XP205型电子天平(1/10万, 梅特勒公司); Milli-Q超纯水机(Millipore公司); KQ-500E型医用数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药山栀苷甲酯(批号111873-201103)、绿原酸(批号110753-201415)、8-O-乙酰山栀苷甲酯(批号111872-201102)、3, 5-O-二咖啡酰基奎宁酸(批号111782-201405)、4, 5-O-二咖啡酰基奎宁酸(批号111894-201102)购自中国食品药品检定研究院; 新绿原酸(批号MUST-16021806)、隐绿原酸(批号MUST-16022403)、3, 4-O-二咖啡酰基奎宁酸(批号MUST-15081411)购自成都曼思特生物科技有限公司, 玉叶金花苷酸甲酯(批号BW5145)购自上海远慕生物科技有限公司, HPLC-DAD(面积归一化法)检测纯度均大于98.0%。甲醇、乙腈和磷酸为色谱纯(Fisher公司), 试验用水为超纯水。
1.3 药材药材为广西各产地采集, 采集时间为2015年3月至2016年8月, 每批样品均压制成相应的腊叶标本, 标本经广西中医研究院方鼎研究员及黄云峰副研究员鉴定为玉叶金花Mussaenda pubescens Ait. f.的根和茎。
2 方法与结果 2.1 对照品储备液及混合对照品溶液的制备精密称取对照品新绿原酸9.52 mg, 置5 mL量瓶中, 加甲醇定容至刻度, 得质量浓度为1.892 mg·mL-1的储备液; 精密称取对照品山栀苷甲酯9.77 mg, 绿原酸100.7 mg, 隐绿原酸111.7 mg, 8-O-乙酰山栀苷甲酯103.6 mg, 3, 4-O-二咖啡酰基奎宁酸110.1 mg, 3, 5-O-二咖啡酰基奎宁酸107.1 mg, 4, 5-O-二咖啡酰基奎宁酸101.9 mg, 分别置10 mL量瓶中, 加甲醇溶解并定容至刻度, 得相对应质量浓度分别为9.604、9.687、11.07、9.935、10.90、9.853、9.589 mg·mL-1的储备液; 精密称取对照品玉叶金花苷酸甲酯183.4 mg, 置20 mL量瓶中, 加甲醇溶解并定容至刻度, 得质量浓度为9.170 mg·mL-1的储备液。分别量取上述对照品储备液适量, 置同一10 mL量瓶中, 配制成含新绿原酸0.037 84 mg·mL-1, 山栀苷甲酯0.096 04 mg·mL-1, 绿原酸0.009 687 mg·mL-1, 隐绿原酸0.036 90 mg·mL-1, 8-O-乙酰山栀苷甲酯0.049 68 mg·mL-1, 3, 4-O-二咖啡酰基奎宁酸0.054 50 mg·mL-1, 3, 5-O-二咖啡酰基奎宁酸0.049 26 mg·mL-1, 4, 5-O-二咖啡酰基奎宁酸0.095 89 mg·mL-1, 玉叶金花苷酸甲酯0.045 85 mg·mL-1的混合对照品溶液。
2.2 供试品溶液的制备取本品粉末(过3号筛)约0.5 g, 精密称定, 置具塞锥形瓶中, 精密加入50%甲醇20 mL, 称量, 超声处理(功率320 W, 频率40 kHz)30 min, 取出, 放冷, 再称量, 用50%甲醇补足减失的量, 摇匀, 滤过, 取续滤液, 即得。
2.3 色谱条件采用CAPCELL MGⅡ C18色谱柱(4.6 mm×250 mm, 5 μm), 以乙腈(A)-0.1%磷酸水溶液(B)为流动相, 梯度洗脱(0~15 min, 93%B; 15~50 min, 93%B→81% B; 50~80 min, 81%B), 流速1.0 mL·min-1, 检测波长254 nm, 柱温35℃, 进样量10 μL。
2.4 系统适用性试验分别精密吸取"2.1"项下混合对照品溶液、"2.2"项下供试品溶液各10 μL, 按"2.3"项下色谱条件测定, 记录色谱图。新绿原酸、山栀苷甲酯、绿原酸、隐绿原酸、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸及4, 5-O-二咖啡酰基奎宁酸9个化学成分的保留时间分别为14.87、23.75、28.46、30.34、36.26、46.06、58.37、61.25和69.43 min, 本实验条件下所测的9个成分与相邻色谱峰的分离度均大于1.5, 与其他组分分离完全, 拖尾因子在0.95~1.05之间, 理论塔板数大于10 000, 色谱系统适用性试验符合含量测定要求, 色谱图见图 1。
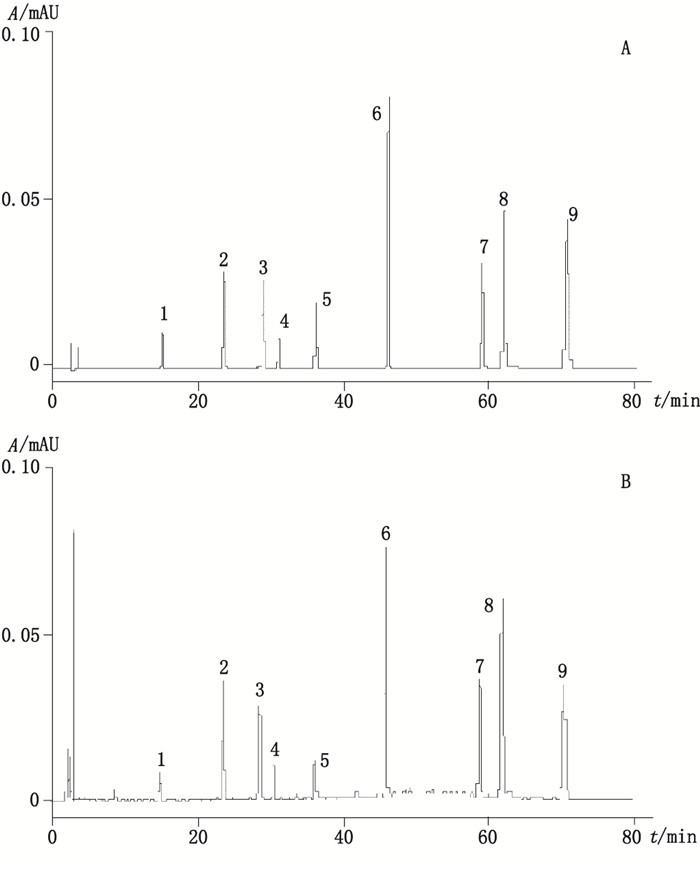
|
1.新绿原酸(neochlorogenic acid) 2.山栀苷甲酯(shanzhiside methyl ester) 3.绿原酸(chlorogenic acid) 4.隐绿原酸(cyrptochlorogenic acid) 5.玉叶金花苷酸甲酯(mussaenoside) 6. 8-O-乙酰山栀苷甲酯(8-O-acetyl shanzhiside methyl ester) 7. 3, 4-O-二咖啡酰基奎宁酸(3, 4-O-dicaffeoylquinic acid) 8. 3, 5-O-二咖啡酰基奎宁酸(3, 5-O-dicaffeoylquinic acid) 9. 4, 5-O-二咖啡酰基奎宁酸(4, 5-O-dicaffeoylquinic acid) 图 1 混合对照品(A)及玉叶金花提取物(B)的HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference substances (A)and the extract of Mussaenda pubescens Ait. f. (B) |
精密吸取"2.1"项下对照品储备液各0.02、0.02、0.02、0.10、1.00 mL, 分别置250、50、10、10、10 mL量瓶中, 加甲醇定容至刻度, 摇匀, 制成一系列浓度的混合对照品溶液。按照"2.3"项下色谱条件, 进行测定, 以各对照品质量浓度(X, μg·mL-1)为横坐标, 峰面积Y为纵坐标, 进行线性回归, 各成分回归方程和线性范围见表 1。结果表明, 9个成分在测定范围内线性关系良好。
|
|
表 1 各被测成分的标准曲线方程、线性范围和相关系数 Table 1 Regression equations, correlation coefficients, linear ranges of the investigated components |
将"2.1"项下的混合对照品溶液稀释成一系列浓度的溶液, 按照"2.3"项下色谱条件依次进样, 测定峰面积。当信噪比为3时, 测得新绿原酸、山栀苷甲酯、绿原酸、隐绿原酸、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸、4, 5-O-二咖啡酰基奎宁酸的检测下限分别为1.165、1.787、0.973、1.088、1.265、1.538、0.945、0.994和1.315 ng; 当信噪比为10时, 测得上述9个成分的定量下限分别为3.882、5.956、3.243、3.628、4.216、5.128、3.149、3.312和4.383 ng。
2.7 仪器精密度试验精密吸取供试品溶液10 μL, 依"2.3"项下色谱条件进行测定, 连续进样6次, 记录峰面积, 计算新绿原酸、山栀苷甲酯、绿原酸、隐绿原酸、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸、4, 5-O-二咖啡酰基奎宁酸峰面积的RSD(n=6)分别为1.1%、0.46%、1.4%、1.5%、1.9%、0.74%、0.58%、1.1%、0.61%, 表明仪器精密度良好。
2.8 重复性考察取8号样品粉末6份, 按"2.2"项下方法制备供试品溶液, 按"2.3"项下色谱条件测定, 记录峰面积, 计算含量。结果新绿原酸、山栀苷甲酯、绿原酸、隐绿原酸、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸、4, 5-O-二咖啡酰基奎宁酸含量(n=6)分别为0.59、3.70、1.60、0.69、0.87、6.59、2.01、3.37、2.64 mg·g-1, 其RSD分别为0.97%、1.0%、2.0%、2.9%、1.3%、1.2%、0.80%、3.6%、1.3%, 表明重复性良好。
2.9 供试品溶液稳定性试验取同一份供试品溶液(8号样品), 分别于配制后0、5、10、15、20、25 h进样测定, 结果新绿原酸、山栀苷甲酯、绿原酸、隐绿原酸、玉叶金花苷酸甲酯、8-O-乙酰山栀苷甲酯、3, 4-O-二咖啡酰基奎宁酸、3, 5-O-二咖啡酰基奎宁酸、4, 5-O-二咖啡酰基奎宁酸峰面积的RSD(n=6)分别为1.5%、1.1%、2.0%、1.7%、1.5%、0.86%、0.68%、2.3%、0.58%, 表明供试品溶液在25 h内稳定。
2.10 加样回收率试验取已知含量的8号样品粉末9份, 每份约0.25 g, 精密称定, 按重复性结果计算出来的9个被测成分的含量分别加入3个水平(50%、100%、150%)的对照品量各3份, 按"2.2"项下方法平行制备供试溶液, 进样分析, 计算回收率, 结果9个被测成分的平均加样回收率及RSD结果如表 2所示。
|
|
表 2 加样回收率(n=3) Table 2 Recoveries of the nine components |
分别取广西区不同产地玉叶金花药材, 按"2.2"项下方法制备供试品溶液, 再按"2.3"项下色谱条件进行测定, 用外标法计算样品含量。结果见表 3。
|
|
表 3 玉叶金花中9种成分含量测定结果(mg·g-1) Table 3 Contents of nine components in Mussaenda pubescens Ait. f |
环烯醚萜苷类成分为壮药玉叶金花中重要活性成分, 本课题组首次分析得到玉叶金花中富含以咖啡酰基奎宁酸为代表的有机酸类成分, 并实现了6个咖啡酰基奎宁酸类成分与3个环烯醚萜苷类成分的基线分离, 建立了含量测定的方法, 为完善玉叶金花药材质量标准提供依据。
3.2 供试品溶液配制方法的选择通过比较不同的提取方法(超声、回流)、提取溶剂(30%甲醇、50%甲醇、70%甲醇、甲醇、50%乙醇水溶液)、溶剂用量(5、10、20、50 mL)、提取时间(15、30、45、60 min), 结果表明采用20 mL甲醇超声提取30 min效果最佳。
3.3 含量测定条件的选择本研究采用DAD检测器进行全波长扫描(190~400 nm), 结果3个环烯醚萜苷类的最大吸收波长均为237 nm, 6个咖啡酰基奎宁酸类成分的最大吸收波长均为328 nm, 综合考虑2类成分的紫外吸收, 最终选择254 nm作为测定波长。在流动相系统的选择中, 分别对比了甲醇-水、甲醇-0.1%磷酸水、乙腈-0.1%磷酸水、乙腈-0.4%甲酸水, 结果表明, 只有使用酸水系统时才能使6个咖啡酰基奎宁酸类成分得到基线分离, 而乙腈-0.1%磷酸水系统在其中的分离效果最好, 因此采用该系统对供试品溶液进行梯度洗脱。
3.4 含量测定结果分析玉叶金花样品中均可检出9个被测成分, 但由于各样品间生长环境的不同, 9种成分的含量相差较大, 考虑到同类化学成分间可能存在的相互转化, 在制定含量测定指标时, 可考虑采用同一类成分含量的总和来评价。
3.5 小结玉叶金花作为广西区内传统的壮药, 不仅广泛用于民间凉茶的制作, 更是许多清热类中成药的君药, 如玉叶清火片、玉叶解毒胶囊等。本实验建立了HPLC同时测定玉叶金花药材中9个成分含量的方法。该方法简便、快速、准确, 重复性好, 可以为进一步提高玉叶金花药材的质量控制标准提供科学依据。
| [1] |
广西壮族自治区食品药品监督管理局. 广西壮族自治区壮药质量标准. 第一卷[S]. 南宁: 广西科学技术出版社, 2008: 71 Guangxi Food and Drug Administration. Guangxi Standard for Zhuang Medica. VolⅠ[S]. Nanning: Guangxi Science and Technology Press, 2008: 71 |
| [2] |
唐德智. 玉叶金花研究进展[J]. 解放军药学学报, 2016, 32(2): 170. TANG DZ. Research progress of Mussaenda pubescens[J]. Pharm J Chin PLA, 2016, 32(2): 170. |
| [3] |
李嘉, 卢覃培, 张颖. 玉叶金花属植物化学成分及药理作用研究进展[J]. 中国民族民间医药杂志, 2016, 25(15): 39. LI J, LU QP, ZHANG Y. Research progress in chemical constituents and pharmacological effects of Mussaenda L[J]. Chin J Ethnomed Ethnopharm, 2016, 25(15): 39. |
| [4] |
黄雄, 黄嬛. 中药环烯醚萜成分的提取分离和药理作用研究[J]. 嘉兴学院学报, 2009, 21(3): 70. HUANG X, HUANG H. Research progress in extraction separation and pharmacological effect of the TCM iridoid glycoside[J]. J Jiaxing Univ, 2009, 21(3): 70. |
| [5] |
李祖晟, 朱志安. 二咖啡酰基奎宁酸药理实验研究进展[J]. 医学综述, 2004, 10(4): 249. LI ZS, ZHU ZA. Research progress in pharmacological experiment of di-caffeyl quinine acid[J]. Med Recapit, 2004, 10(4): 249. |
| [6] |
朱乃亮, 彭平, 赵丽敏, 等. 植物中常见咖啡酰基奎宁酸类化合物研究进展[C]//. 中华中医药学会中药化学分会第八届学术年会论文集, 2013: 192 ZHU NL, PENG P, ZHAO LM, et al. Progress in the Study of Common Caffeic Acid Compounds in Plants[C]//. Proceedings of the Chinese Academy of TCM Annual Meeting, 2013: 192 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZHZY201308001029.htm |
| [7] |
赵昱, 赵军, 李湘萍, 等. 咖啡酰奎尼酸类化合物研究进展[J]. 中国中药杂志, 2006, 31(11): 869. ZHAO Y, ZHAO J, LI XP, et al. Advances in caffeoylquinic acid research[J]. China J Chin Mater Med, 2006, 31(11): 869. DOI:10.3321/j.issn:1001-5302.2006.11.001 |
| [8] |
潘利明, 林励, 胡旭光. 玉叶金花提取物的抗炎抑菌作用[J]. 中国实验方剂学杂志, 2012, 18(23): 248. PAN LM, LIN L, HU XG. Studies on anti-inflammatory and antibacterial activities of aqueous extract from Mussaenda pubescens[J]. Chin J Exp Tradit Med Form, 2012, 18(23): 248. |
| [9] |
潘利明, 林励. 玉叶金花水提物不同萃取部位的抗炎活性研究[J]. 广东药学院学报, 2013, 29(5): 530. PAN LM, LIN L. Study on the anti-inflammatory activities of different extracted portions from aqueous extract of Mussaenda pubescens[J]. J Guangdong Pharm Univ, 2013, 29(5): 530. |
| [10] |
潘利明, 林励. HPLC法测定玉叶金花中玉叶金花苷酸甲酯的含量[J]. 云南中医中药杂志, 2013, 34(11): 62. PAN LM, LIN L. Determination of glucoside acid methyl ester content in Mussaenda pubescens by HPLC[J]. Yunnan J Tradit Chin Med Mater Med, 2013, 34(11): 62. |
| [11] |
李嘉, 张颖, 姜平川, 等. 广西不同产地壮药玉叶金花中Mussaendoside G的含量测定[J]. 中国现代应用药学, 2014, 31(2): 1478. LI J, ZHANG Y, JIANG PC, et al. Determination of mussaendoside G in Mussaenda pubescens in different areas of Guangxi Province by HPLC[J]. Chin J Mod Appl Pharm, 2014, 31(2): 1478. |
| [12] |
于虹敏, 卢雪花, 王英豪, 等. 玉叶金花总三萜类成分含量测定方法建立[J]. 辽宁中医药大学学报, 2015, 17(2): 40. YU HM, LU XH, WANG YH, et al. Establishment of determination method of total triterpenoids in Mussaenda pubescens[J]. J Liaoning Univ TCM, 2015, 17(2): 40. |
 2018, Vol. 38
2018, Vol. 38 
