2. 四川大学华西药学院生药学教研室, 成都 610041;
3. 昆明医科大学药学院暨云南省天然药物药理重点实验室, 昆明 650500
2. Department of Pharmacognosy, West China School of Pharmacy, Sichuan University, Chengdu 610041, China;
3. School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming 650500, China
西红花苷是西红花和栀子共有活性成分, 由于最先于西红花中发现, 故命名为西红花苷, 主要包括西红花苷-1、西红花苷-2、西红花苷-3、西红花苷-4和顺式-西红花苷-1等[1-2], 这类天然产物苷元相同, 均为西红花酸, 两端连接不同数量葡萄糖而形成不同结构西红花苷, 衍生成一系列极性不同的西红花苷衍生物(图 1)。其中西红花苷-1是西红花苷中含量最高的化合物, 约占70%~80%[3-4]。国内外学者对西红花苷的药理活性进行了广泛的研究, 结果显示这类成分具有抗氧化[5], 抗癌[6-7], 保护神经[8], 抗肝炎[9]及防治心血管疾病[10-11]等作用。栀子为茜草科植物栀子(Gardenia jasminoides Ellis)的干燥成熟果实, 广泛用作传统中药和天然食用色素, 传统中医认为其性寒味苦, 无毒, 主归心、肺、三焦经, 具有泻火除烦、清热利尿和凉血解毒之功效[12]。近30年来, 国内外学者对栀子化学成分和药理活性方面进行了深入研究, 结果显示, 栀子中西红花苷含量较高[3, 13]。另一方面, 西红花为鸢尾科植物西红花(Crocus sativus L.)的干燥柱头, 具有活血化瘀、凉血解毒、解郁安神等功效[14], 并含大量西红花苷[4]。前期研究显示, 随着葡萄糖数量增加, 极性增强, 西红花苷稳定性降低, 不同结构西红花苷分离纯化难度较高[15]。本文主要对栀子与西红花药材中西红花苷单体的分离纯化进行概述, 并对该类化合物分析检测及构效关系进行总结, 以利于栀子和西红花药材中西红花苷类化合物分离纯化及分析工作的开展, 并为2味药材质量研究及药理活性研究提供参考。
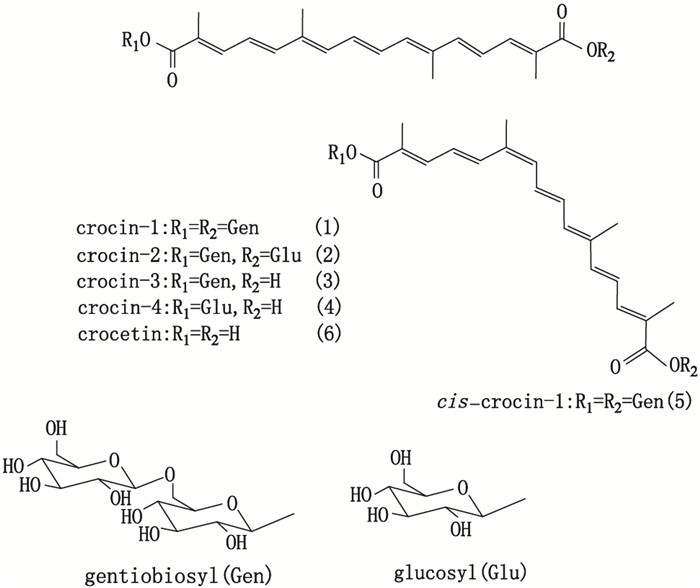
|
图 1 西红花苷和西红花酸结构 Figure 1 Structures of crocins and crocetin |
自20世纪90年代, 国内外学者主要采用硅胶柱层析[16]、制备液相[17]和高速逆流[18-19]等色谱技术对中药栀子和西红花中西红花苷类分离纯化进行深入研究。
1.1 柱层析法 1.1.1 硅胶柱层析法(silica gel column chromatography, SGCC法)常压SGCC法是天然产物分离纯化最常用的技术, 所需设备简单, 成本低, 分离范围广, 处理量大。其原理是依据化合物在硅胶上吸附能力的不同而获得分离。一般情况下, 采用不同种类及浓度有机溶剂进行洗脱, 极性小、吸附能力弱者先被洗脱, 极性强、吸附能力强者后被洗脱, 从而使混合物各成分得到纯化。Chen等[13, 15]采用SGCC法对栀子果实中西红花苷类进行分离:将栀子药材(40 kg)粉碎成粗粉, 加入40%乙醇渗漉, 乙醇部位浓缩, 用乙酸乙酯萃取, 醋酸乙酯部位浸膏采用硅胶柱层析, 用二氯甲烷-甲醇(3%、5%、7%、10%)依次洗脱, 甲醇-二氯甲烷(3%)部位结晶得到西红花酸(40 mg)。水相部位浸膏采用大孔吸附树脂HPD-100分离, 乙醇(0、25%、60%)依次洗脱, 乙醇(60%)部位采用硅胶柱层析, 醋酸乙酯(5%、10%、15%、20%)-[甲醇-水(16:13)]依次洗脱, 醋酸乙酯-[甲醇-水(16:13)](5%)部位采用制备型ODS柱纯化, 得到西红花苷-3(3 g)。采用类似方法, 在甲醇-水(16:13)-醋酸乙酯(10%、15%、20%)部位分别得到化合物西红花苷-2(1.5 g), 顺式-西红花苷-1(200 mg)和西红花苷-1(3 g)。该法仪器设备简单, 成本低, 分离效果好, 制备量大, 但需进行反复柱层析才能获得较高纯度单体, 而且西红花苷极性大, SGCC法为正相色谱法, 故不可逆吸附高, 回收率低。此外, 该法对实验者操作技能要求稍高, 实验重现性相对较低。
1.1.2 制备液相色谱法(preparative liquid chromatography, PLC法)自20世纪60年代发展至今, PLC法作为1种快速高效分离技术, 已被广泛用于有机化合物的制备和纯化, 特别是在天然药物化学分离工作中越来越发挥着重要的作用[20]。该技术原理是通过高负载、高分离度制备柱来实现高纯度化合物分离和纯化[21]。分离过程具有样品不易变性, 获得单体纯度高, 回收率高及纯化周期短的特点, 特别适合大极性化合物和难分离物质的纯化。目前, PLC法不仅在实验室化合物分离纯化中广泛应用, 在工业规模化生产中, 该技术也成为分离纯化天然产物及化学合成产物的有效技术手段[19]。Calsteren等[22]采用RP-HPLC法对西红花苷进行纯化:将西红花粉末用50%乙醇提取, 浸膏采用Sephadex LH-20 (5 cm×45 cm)柱分离, 然后采用PLC法进行纯化, 收集得到西红花苷-1和西红花苷-2纯品。Choi等[23]采用半制备液相色谱法对西红花苷进行分离:10 g干燥栀子果实依次用二氯甲烷、甲醇提取, 甲醇部位浸膏浓缩, 再溶于水过滤, 滤液采用C18柱(25 mm×100 mm, 5 μm)分离, 先用50%甲醇洗脱, 然后采用50%甲醇至100%甲醇梯度洗脱, 得到西红花苷-1(7 mg)。Zhang等[24]采用PLC法对西红花苷进行分离:将西红花(30 g)依次用石油醚、乙醚和70%甲醇提取, 70%甲醇部位浸膏浓缩, 分别采用C18柱(600 mm×15 mm, 700 mm×8 mm)进行纯化, 甲醇水梯度洗脱, 得到西红花苷-1(1.2 g)、西红花苷-2(0.6 g)和西红花苷-3(0.24 g)。HPLC分析结果显示, 西红花苷-1、西红花苷-2和西红花苷-3的纯度分别为99.04%、97.40%、96.70%。Koulakiotis等[25]采用半制备液相色谱法对西红花苷类进行分离:色谱柱为RP-C18柱(25 mm×10 mm, 5 μm), 乙腈水梯度洗脱, 分离得到西红花苷-1、西红花苷-2、西红花苷-3的纯度均大于98%。以上方法分离速度快, 不可逆吸附低, 重现性好, 获得化合物纯度较高, 最终可同时制备西红花苷-1、西红花苷-2和西红花苷-3, 但该技术制备量相对较小, 并且有机化学试剂消耗量大。
此外, 大孔吸附树脂是一类不含交换基团, 具有大孔网状结构和较大表面积的高分子吸附树脂, 具有比表面积大和吸附容量大等优点[26]。目前, 该材料在天然药物化学成分分离纯化中应用广泛, 而大孔吸附树脂技术与PLC法联用, 可使分离纯化过程更加快速、高效。Feng等[16]采用大孔吸附树脂技术联合反相中压制备色谱同时分离栀子果实中的西红花苷-1和栀子苷:将栀子果实(1.0 kg)用40%甲醇水提取, 浸膏浓缩, 采用LX-60大孔吸附树脂初步纯化后, 西红花苷-1和栀子苷的纯度分别达到29.6%和83.4%, 经反相中压色谱二次纯化, 西红花苷-1纯度达到60.8%。与传统单一分离工艺相比, 大孔吸附树脂与PLC法联用, 使西红花苷分离工作更为高效, 并且大孔吸附树脂再生容易, 环境友好, 成本低。
1.2 制备薄层色谱法(preparative thin layer chromatography, PTLC法)PTLC法为薄层色谱在有机化合物分离制备中的1种有用手段, 通常用于10 mg级有机化合物分离纯化。PTLC法的色谱板厚度通常为0.5~2 mm, 因此比分析型薄层色谱法样品处理量显著提高, 该法操作简便, 设备简单, 分离速度快, 常用于硅胶柱层析分离效果不佳的化合物纯化工作中。Iborra等[27]采用PTLC法对西红花中西红花苷-1进行分离:以甲醇-水-乙腈(7:2:1)为展开剂, 固定相为氧化铝150F254, 制备型薄层板厚度1.5 mm, 展开比移值(Rf)为0.13, 分离得到西红花苷-1 (纯度70%)。Pfister等[28]采用PTLC法对栀子西红花苷-1进行分离:将栀子果实依次用乙醚, 70%乙醇分别提取, 然后采用制备硅胶薄层板进行分离, 以醋酸乙酯-异丙醇-水(56:34:10)为展开剂, 展开后呈现6个薄层色谱带, 比移值在0.1~0.6之间, 将主色谱带洗脱浓缩, 以吡啶-醋酸酐(2:1)为反应物, 4-(二甲氨基)吡啶为催化剂, 进行乙酰化反应, 采用制备硅胶薄层板纯化, 分别采用甲苯-醋酸乙酯(3:7)和正己烷-醋酸乙酯-甲醇(3:1:1)展开, 分离得到全乙酰化西红花苷-1, 比移值为0.35。采用类似方法还可分离获得西红花酸、西红花苷-3及顺式-西红花苷-1。以上方法步骤多, 技术要求高, 西红花苷制备量较小, 但与PLC法相比, PTLC法仪器要求低, 装置简单, 操作方便。
1.3 高速逆流色谱法(high-speed counter current chromatography, HSCCC法)HSCCC法是1种连续高效液-液分配色谱技术, 其原理是利用不相溶两相在螺旋管中作高速行星式运动, 使被分离化合物在两相间多次分配, 从而实现短时间内对混合物质高效分离[29]。作为1种液液分配色谱, 不需要任何固体载体或支撑物, 相对于其他常用色谱技术来说, 不会产生吸附剂所导致的吸附耗损, 样品变性, 样品峰拖尾及不易回收等问题[30-31]。Liang等[17]采用HSCCC法分离纯化栀子中西红花苷-1:将干燥栀子用乙醇(80%)超声提取, 水相部位浸膏依次用石油醚、醋酸乙酯、正丁醇萃取, 醋酸乙酯-正丁醇-水(1:4:5)为流动相, 分离获得西红花苷-1, 纯度为97.1%。Wang等[18]采用HSCCC法从栀子果实中分离纯化不同结构西红花苷:将栀子粉末用乙醇(60%)提取浓缩, 采用HPD-100大孔吸附树脂柱层析, 40%~60%乙醇洗脱, 洗脱液减压浓缩后, 再进一步用制备型HSCCC法分离, 溶剂系统为正己烷-醋酸乙酯-正丁醇-水(1:2:1:5), 检测波长为440 nm, 得到西红花苷-1(246.2 mg)、西红花苷-2(34.2 mg)、西红花苷-3(24.4 mg)及西红花苷-4(24.7 mg); UPLC法测定分离化合物单体纯度, 测得纯度分别为94.1%、96.3%、94.1%及98.9%。该法可一次性分离纯化出4种不同结构西红花苷, 缩短了纯化时间, 为西红花苷类化合物大量制备提供了工艺基础。总体上, HSCCC法与传统柱层析法相比, 仪器操作简单, 对样品前处理要求低, 栀子粗提物即可进行制备分离。由于HSCCC法不需要固相载体, 消除了西红花苷在固相载体上不可逆吸附及降解造成的损失, 因此回收率高。此外, 采用HSCCC法分离西红花苷, 还具有分离效率高, 化合物纯度高, 费用低, 制备量大等优点。同时, 采用HSCCC法从栀子中可同时纯化出不同结构西红花苷单体。然而, 该方法在西红花苷纯化应用实践中却存在有机溶剂消耗量大, 且较难优化出合适溶剂体系的缺点。
1.4 其他方法Lautenschlager等[32]报道, 采用二氯甲烷对西红花(50 g)进行脱脂, 然后采用20%乙醇提取, 浓缩, 溶解于水, 采用高速离心色谱法(FCPC)进行分离, 用水-乙醇-醋酸乙酯-已烷(7:4:8:1)溶剂系统的上层作为流动相, 下层为固定相, 得到西红花苷-1(95 mg), 纯度为94%。此外, 本课题组还通过酶的去糖基化制备西红花酸, 该法省时, 省力, 流程短, 成本低。
综上所述, 西红花苷分离纯化技术均为天然产物分离纯化的常用手段, 研究者可依据具体实验条件和研究目的, 选择采用合适技术进行西红花苷分离制备(表 1)。以上研究表明, SGCC法所需仪器简单价廉, 样品处理量较大, 适合西红花苷-1这1个单体的大量制备; 而PLC法和HSCCC法由于理论塔板数高, 分离度大, 适合多个西红花苷的同时分离纯化。由于固定相装填密度均匀, PLC法和HSCCC法重现性优于前2种技术, 所以对实验人员技能要求相对较低; 而硅胶柱层析和PLC法需要研究者有一定实践经验才能获得良好分离效率。以上方法均消耗大量有机化学试剂, 故研究者在今后的西红花苷分离制备中, 还需探索如何减少有毒化学试剂的使用, 以减少研究工作对环境的污染。
|
|
表 1 西红花苷不同分离纯化技术比较 Table 1 Comparison of various separation and purification techniques of crocins |
西红花苷最大吸收波长为440 nm左右, 采用分光光度法进行分析的灵敏度高。然而, 由于栀子和西红花中各西红花苷衍生物数量多, 因此近30年来, 国内外学者采用不同色谱联用技术对栀子和西红花中包括西红花苷在内的多种有效成分进行分析检测。目前, 栀子和西红花药材中西红花苷单体分析检测主要采用高效液相色谱法[33]、液质联用技术[34]和毛细管电泳法[35]等。
2.1 高效液相色谱紫外可见分光光度法 2.1.1 常规分析高效液相色谱法(high performance liquid chromatography, HPLC法)是药物分析中常用的柱色谱分离分析技术, 具有分离效率高, 选择性好且分析速度快等优点。随着分析科学技术发展, HPLC法已广泛用于栀子和西红花药材中西红花苷的分析测定。何常明等[36]采用HPLC-DAD法对西红花中西红花苷进行检测:色谱柱为C18柱, 乙腈水梯度洗脱, 检测波长440 nm。结果显示, 西红花苷-1质量浓度在5.2~165 μg·mL-1, 西红花苷-2质量浓度在2.7~85 μg·mL-1范围均呈良好线性关系, 相关系数均大于0.999, 平均回收率分别为102.5%和98.2%。付小敏等[37]采用HPLC-DAD法测定栀子药材中西红花苷-1含量:色谱柱为C18柱, 乙腈-0.2%磷酸溶液梯度洗脱, 检测波长440 nm。结果显示, 不同产地18批栀子药材中西红花苷-1含量差异较大, 西红花苷-1含量为0.2%~1.06%。以上研究由单一成分向多种成分检测方向发展, 并且随着对西红花和栀子药材中各种化学成分研究的深入, 可实现多种成分同时检测。
以上研究表明, 由于各西红花苷化合物极性相差较大, 在HPLC法分析中一般能获得良好分离及检测, 能满足栀子和西红花中西红花苷化合物鉴定及含量测定。随着对西红花和栀子药材中各种化学成分的深入研究, 研究者还开发出栀子中多成分同时检测技术。如徐燕等[38]采用多波长HPLC法同时测定栀子中3类有效成分中9个成分(栀子苷、西红花酸、3种西红花苷等)的含量:色谱柱为C18柱, 检测器为二极管阵列检测器, 0.3%甲酸和甲醇-乙腈(9:1)梯度洗脱; 根据栀子中各成分的不同光谱特性, 在3个紫外-可见检测波长下, 同时测定其中3类成分; 在检测波长440 nm测定西红花酸及3种西红花苷, 结果显示:西红花苷-1和西红花苷-2质量浓度在1.0~100 μg·mL-1范围内线性关系良好, 西红花苷-3质量浓度在0.5~50 μg·mL-1范围内线性关系良好; 西红花苷-1、西红花苷-2及西红花苷-3相关系数均大于0.999, 平均回收率分别为99.2%、101.2%及98.8%。Li等[4]采用HPLC-UV法对西红花中5个成分进行定量分析:色谱柱为反相C18柱, 甲醇-1%醋酸梯度洗脱, 检测波长分别为200~600 nm或420 nm, 结果显示, 西红花苷-1, 西红花苷-2, 西红花苷-3、西红花苷-4及西红花酸线性范围良好, 相关系数均大于0.999, 日内和日间RSD均小于11%。Chen等[3]采用HPLC-UV法同时检测栀子中栀子苷、西红花苷-1、西红花苷-2、西红花苷-3及顺式-西红花苷-1:色谱柱为C18柱, 乙腈-水梯度洗脱, 检测波长分别为238 nm和440 nm; 由于结果稳定, 重现性好, 此法适用于栀子药材内西红花苷含量测定。以上方法可实现药材中包括西红花苷在内的多个成分同时分析测定, 效率显著提高, 分离度、准确度和精密度均符合要求。
2.1.2 体内分析西红花苷药理功效广泛, 近15年来, 也有部分文献报道西红花苷在体内吸收、分布、代谢及排泄机制。杜鹏等[39]将西红花苷-1灌胃给予大鼠, 采用HPLC-UV法测定西红花苷-1含量, 结果在血液和尿中未检测出西红花苷-1, 但检测出西红花酸, 并推测西红花苷是水解成西红花酸后被吸收入血。唐琳等[40]采用HPLC法检测家兔血浆中西红花苷-1:家兔静脉注射西红花苷-1后, 血浆中能检测到西红花苷-1, 其血药浓度-时间曲线符合二室模型, 结果显示西红花苷-1质量浓度在0.86~27.54 mg· L-1范围线性良好。Asai等[41]采用西红花总苷灌胃给予小鼠, 采用HPLC法对西红花苷代谢物进行检测:反相C18柱, 0.1%醋酸铵溶液和0.1%醋酸铵醇溶液梯度洗脱, 结果显示西红花苷在小鼠肠道内被水解成西红花酸吸收入血, 在体内又被转化成西红花酸葡萄糖醛酸代谢物, 并推测这种体内代谢物可能是西红花酸和西红花苷在体内发挥疗效的活性分子形式。Xi等[42]采用大鼠口服西红花苷, HPLC法对西红花苷代谢物进行检测:流动相为甲醇-水-醋酸(55:44.5:0.5), 结果在血浆中未检测出西红花苷, 而检测出低浓度西红花酸, 同时西红花苷大量出现在排泄物和肠道中。此外, 西红花苷通过不同肠段时浓度减少, 且在结肠时减少量较大, 故而推测肠道为西红花苷水解的1个部位。此外, 张颖等[43]采用大鼠口服西红花苷-1后, HPLC法检测血浆中西红花苷-1含量:结果与Asai等在小鼠中获得的结果相似, 西红花苷-1口服给药后以代谢物西红花酸的形式快速吸收入血。朱俊博等[44]将西红花苷-1以肌肉注射给大鼠后, 采用HPLC法测定大鼠血浆中西红花苷-1含量:以乙腈-甲醇-0.5%冰醋酸溶液(15:20:50)为流动相等度洗脱, 结果显示, 西红花苷-1肌肉注射后血浆吸收快, 分布广泛。Umigai等[45]研究健康成年人口服西红花酸的药代动力学, 结果显示, 西红花酸比其他类胡萝卜素吸收更快。Zhang等[46]研究大鼠口服西红花苷和西红花酸, 采用UPLC-MS/MS对血浆中两者含量进行测定, 发现西红花苷在胃肠道内很快水解成西红花酸。
体内代谢物分析测定研究结果(表 2)表明, 西红花苷在肠道内被水解成西红花酸吸收入血, 在体内可能被转化成西红花酸葡萄糖醛酸代谢物。由于西红花酸及其二相代谢产物极性有较大差异, 并且各结构西红花苷均代谢为西红花酸1个化合物, 化合物种类减少, 故而HPLC法足以满足此类分析任务。但需注意, 由于体内样本中西红花酸含量较低, 如何在样品前处理中保留并富集目标化合物, 是该领域研究人员必须面对的技术难点。
|
|
表 2 西红花苷体内分析 Table 2 In vivo determination of crocins |
随着质谱技术的发展, 液相色谱-质谱(LC-MS)联用技术越来越成熟。LC-MS以液相色谱为分离系统, MS法为检测系统, LC法与MS法技术互为补充, 将LS法对复杂样品的高效分离能力与MS对有机化合物定性鉴定的优势结合起来, 样品检测时不需要进行烦琐和复杂的前处理, 高效快速, 灵敏度高, 尤其对于含量较少且无法获得足够样品量进行核磁共振鉴定的情况, 采用LC-MS联用技术即可实现混合物各成分的同时分离与鉴定。Carmona等[47]采用高效液相色谱-电喷雾离子化质谱联用(HPLC-ESI-MS)法对西红花中15种西红花苷进行鉴定分析:MS条件为干燥气温度350℃, 毛细管电压2.5 kV, 毛细管温度195℃。Ding等[48]通过HPLC-ESI-MS法建立了不同产地栀子化学指纹图谱并对有效成分进行分析:MS条件为干燥气温度350℃, 干燥气流速8.0 L·min-1, 雾化气压206.9 kPa, 扫描范围50~1 000;结果m/z 975[M-H]-离子和m/z 999[M+Na]+离子为西红花苷-1分子离子峰, m/z 813[M-H]-离子和m/z 837[M+Na]+离子为西红花苷-2分子离子峰。Wu等[49-50]采用HPLC-DAD-ESI-MS法对栀子中8种有效成分进行分析:MS条件为电喷雾离子源负离子模式, 毛细管电压3.5 kV, 离子源温度135℃, 锥孔电压110 V, 碎片电压110 V; 结果显示m/z 975[M-H]-离子和m/z 859[M+HCOO]-离子分别为西红花苷-1和西红花苷-2分子离子峰。Bergonzi和Cai等[51-52]采用类似方法对栀子中西红花苷类化合物进行鉴定:结果m/z 975[M-H]-离子为西红花苷-1分子离子峰。此外, Verma等[53]采用LC-MS-MS法对西红花中西红花苷-1和西红花苷-2等有效成分进行分析:结果显示, m/z 975→651和m/z 813→652分别为西红花苷-1和西红花苷-2碎片离子峰。
另一方面, Masi等[54]采用质子转移反应-飞行时间-质谱(PTR-TOF-MS)联用技术和HPLC法对意大利和伊朗两地西红花中西红花苷类单体进行含量测定。MS条件:质子转移反应以H3O+为反应物, 漂移电压600 V, 温度110℃, 压力0.225 kPa; 通过PTR-TOF-MS发出的信号强度以及HPLC分析; 结果显示, 意大利西红花中西红花苷(尤其反式-西红花苷-3和西红花苷-4)含量较高。该法具有较大的质量分析范围, 能提供较高质量分辨率和高质量精度数据, 前体离子选择性好。以上方法灵敏度高, 重现性和选择性好, 可应用到栀子和西红花药材中西红花苷类成分鉴定。
2.3 毛细管电泳法毛细管电泳(capillary electrophoresis, CE)是20世纪80年代以来新兴的一种分析技术, 具有高效、快速、简便, 样品用量少及分析对象广等优点, 被用于天然产物的分析检测[55-56]。CE以弹性石英毛细管为分离通道, 高压直流电场为驱动力, 根据组分的淌度和分配系数的差异进行分离[57]。Zougagh等[35]采用非水毛细管电泳法(nonaqueous capillary electrophoresis, NACE)对西红花苷类进行质量控制:用石英毛细管(75 μm, 有效长度40 cm)作为分离通道, 背景电解质溶液为50 mmol·L-1硼酸甲醇溶液-硼砂和甲醇(1:3), 运行电压16 kV, 运行温度20℃, 检测波长435 nm, 压力进样3.5 kPa, 8 s, 对西红花中4种西红花苷单体进行检测; 结果显示, 西红花苷类化合物出峰时间比用HPLC稍早, 此法具有快速灵敏, 易操作, 分辨率高等优点, 对西红花中西红花苷化合物分析效率优于HPLC, 但分离能力稍弱, 重现性差, 对样品前处理要求较高。表 3为以上各类代表性西红花苷分析方法总结。
|
|
表 3 代表性西红花苷分析方法 Table 3 Representative methods for analysis of crocins |
母核相同的同类药物, 取代基的变化会导致药理活性显著改变。西红花苷母核均为西红花酸, 各西红花苷差异仅为母核(苷元)两端连接葡萄糖基数量不同。研究显示, 西红花苷结构中糖数量多少可引起西红花苷药理活性显著变化。Sugiura等[58]研究西红花苷在阻止由乙醇引起的大脑海马区域LTP抑制作用的效果:结果显示西红花苷-1抑制活性强于西红花苷-2。Abe等[59]对西红花苷拮抗由乙醇引起大鼠的海马神经元NMDA(N-甲基-D-天冬氨酸)受体介导抑制作用进行研究:结果显示, 西红花苷-1比西红花酸二葡萄糖酯更能显著阻断NMDA的抑制反应。Escribano等[60]对西红花苷肿瘤细胞生长的抑制作用进行研究:结果显示, 西红花苷-1对肿瘤细胞生长有抑制作用, 而西红花酸不显示对肿瘤细胞生长的任何抑制作用。Papandreou等[61]对西红花苷对β-淀粉样聚合的抑制活性进行研究:将反式-西红花苷-4(西红花酸两端分别连接2个葡萄糖基)和二甲基西红花酸(西红花酸两端分别连接1个甲基)对抑制β-淀粉样原纤维的生成进行比较, 研究发现反式-西红花苷-4在相对更低的浓度下就能抑制β-淀粉样原纤维生成。此外, 也有相反的研究报告, Xuan等[62]就西红花苷对眼睛血流增加和视网膜功能恢复进行研究:结果显示, 西红花苷-1和西红花苷-2对眼睛血流增加及视网膜功能恢复低于西红花苷-3、西红花苷-4和西红花酸, 西红花苷葡萄糖可能会影响药物与受体的结合, 影响药效功能的发挥。以上研究显示, 随着西红花苷上葡萄糖基数量增加, 西红花苷的活性也逐渐增强, 显示西红花苷较为明显的结构-功效关系。西红花苷构效关系研究结果见表 4。
|
|
表 4 西红花苷构效关系 Table 4 The structure-activity relationship of crocins |
本文概述近30年来栀子和西红花中西红花苷分离纯化、分析测定及构效关系研究进展。国内外学者采用各种色谱技术对栀子和西红花中西红花苷类化合物进行分离纯化, 文献显示, 采用SGCC法能获得较大量西红花苷纯品, 但此类技术回收率稍低, 需反复进行柱层析。随着分离技术的进步, 一次能同时分离出数个不同结构化合物的PLC法及HSCCC法在西红花分离纯化中的优势逐渐显示出来。目前, HPLC法仍广泛应用于栀子和西红花中西红花苷类成分的分析检测, 结果显示, 该法在西红花苷分析检测方面选择性好, 灵敏度高且分析速度快, 而LC-MS法则可实现栀子和西红花中西红花苷类化学成分简便快速的结构鉴定, 该法对于快速、准确地从复杂样品中测定低含量西红花苷具有重要意义。不同结构西红花苷构效关系的研究结果显示, 随着母核两端连接糖数量增加, 活性也逐渐增强, 显示这类化合物活性的发挥与结构中糖数量存在相关性。综上, 尽管目前各国学者对西红花苷分离纯化、分析测定及构效关系进行了广泛的研究, 但如何利用现代化学和生物学出现的前沿技术, 对西红花苷进行更深入的研究, 将是今后研究的方向。
| [1] |
PHAM TQ, CORMIER F, FARNWORTH E, et al. Antioxidant properties of crocin from Gardenia jasminoides Ellis and study of the reactions of crocin with linoleic acid and crocin with oxygen[J]. J Agric Food Chem, 2000, 48(5): 1455. DOI:10.1021/jf991263j |
| [2] |
刘怡, 陈磊, 张留记. 不同产地栀子皮和栀子仁中有效成分的含量比较[J]. 中药新药与临床药理, 2012, 23(1): 81. LIU Y, CHEN L, ZHANG LJ. Study on effective constituent contents in different positions of Gardenia jasminoides from different producing places[J]. Tradit Chin Drug Res Pharmacol, 2012, 23(1): 81. |
| [3] |
CHEN Y, ZHANG H, LI YX, et al. Crocin and geniposide profiles and radical scavenging activity of gardenia fruits (Gardenia jasminoides Ellis) from different cultivars and at the various stages of maturation[J]. Fitoterapia, 2010, 81(4): 269. DOI:10.1016/j.fitote.2009.09.011 |
| [4] |
LI N, LIN G, KWAN YW, et al. Simultaneous quantification of five major biologically active ingredients of saffron by high-performance liquid chromatography[J]. J Chromatogr A, 1999, 849(2): 349. DOI:10.1016/S0021-9673(99)00600-7 |
| [5] |
OCHIAI T, OHNO S, SOEDA S, et al. Crocin prevents the death of rat pheochromyctoma (PC-12) cells by its stronger antioxidant effects than those of alpha-tocopherol[J]. Neurosci Lett, 2004, 362(1): 61. DOI:10.1016/j.neulet.2004.02.067 |
| [6] |
ABDULLAEV FI. Cancer chemopreventive and tumoricidal properties of saffron (Crocus sativus L.)[J]. Exp Biol Med(Maywood), 2002, 227(1): 20. DOI:10.1177/153537020222700104 |
| [7] |
AUNG HH, WANG CZ, NI M, et al. Crocin from Crocus sativus possesses significant anti-proliferation effects on human colorectal cancer cells[J]. Exp Oncol, 2007, 29(3): 175. |
| [8] |
MEHRI S, ABNOUS K, MOUSAVI SH, et al. Neuroprotective effect of crocin on acrylamide-induced cytotoxicity in PC12 cells[J]. Cell Mol Neurobiol, 2012, 32(2): 227. DOI:10.1007/s10571-011-9752-8 |
| [9] |
HOSSEINZADEH H, YOUNESI HM. Antinociceptive and anti-inflammatory effects of Crocus sativus L.stigma and petal extracts in mice[J]. BMC Pharmacol, 2002, 2(1): 1. DOI:10.1186/1471-2210-2-1 |
| [10] |
SHEN XC, QIAN ZY. Effects of crocetin on antioxidant enzymatic activities in cardiac hypertrophy induced by norepinephrine in rats[J]. Pharmazie, 2006, 61(4): 348. |
| [11] |
HE SY, QIAN ZY, TANG FT, et al. Effect of crocin on experimental atherosclerosis in quails and its mechanisms[J]. Life Sci, 2005, 77(8): 907. DOI:10.1016/j.lfs.2005.02.006 |
| [12] |
中华人民共和国药典2015年版. 一部[S]. 2015: 248 ChP 2015. Vol Ⅰ[S]. 2015: 248 |
| [13] |
CHEN Y, ZHANG H, TIAN X, et al. Antioxidant potential of crocins and ethanol extracts of Gardenia jasminoides Ellis and Crocus sativus L.:a relationship investigation between antioxidant activity and crocin contents[J]. Food Chem, 2008, 109(3): 484. DOI:10.1016/j.foodchem.2007.09.080 |
| [14] |
中华人民共和国药典2015年版. 一部[S]. 2015: 129 ChP 2015. Vol Ⅰ[S]. 2015: 129 |
| [15] |
CHEN Y, CAI L, ZHAO C, et al. Spectroscopic, stability and radical-scavenging properties of a novel pigment from gardenia[J]. Food Chem, 2008, 109(2): 269. DOI:10.1016/j.foodchem.2007.10.023 |
| [16] |
CHOI SJ, KIM MJ, HEO HJ, et al. Ameliorating effect of Gardenia jasminoides extract on amyloid beta peptide-induced neuronal cell deficit[J]. Mol Cells, 2007, 24(1): 113. |
| [17] |
FENG JY, HE XH, ZHOU S, et al. Preparative separation of crocins and geniposide simultaneously from gardenia fruits using macroporous resin and reversed-phase chromatography[J]. J Sep Sci, 2014, 37(3): 314. DOI:10.1002/jssc.v37.3 |
| [18] |
LIANG ZK, YANG M, XU ZS, et al. Isolation and purification of geniposide, crocin-1, and geniposidic acid from the fruit of Gardenia jasminoides Ellis by high-speed counter-current chromatography[J]. Sep Sci Technol, 2014, 49(9): 1427. DOI:10.1080/01496395.2013.879179 |
| [19] |
WANG YR, CHEN Y, DENG L, et al. Systematic separation and purification of iridoid glycosides and crocetin derivatives from Gardenia jasminoides Ellis by high-speed counter-current chromatography[J]. Phytochem Anal, 2015, 1283(1): 202. |
| [20] |
陈鸳谊, 李行诺, 张翠萍, 等. 高效制备液相色谱在天然产物分离中的应用[J]. 药学进展, 2010, 34(8): 337. CHEN YY, LI XN, ZHANG CP, et al. Application of high performance preparative chromatography to the separation of natural products[J]. Prog Pharm Sci, 2010, 34(8): 337. |
| [21] |
KATTI A, GUIOCHON G. Optimization of sample size and sample volume in preparative liquid chromatography[J]. Anal Chem, 1989, 61(9): 982. DOI:10.1021/ac00184a013 |
| [22] |
CALSTEREN MV, BISSONNETTE M, CORMIER F, et al. Spectroscopic characterization of crocetin derivatives from Crocus sativus and Gardenia jasminoides[J]. J Agric Food Chem, 1997, 45(4): 1055. DOI:10.1021/jf9603487 |
| [23] |
CHOI HJ, PARK YS, KIM MG, et al. Isolation and characterization of the major colorant in gardenia fruit[J]. Dyes Pigments, 2001, 49(1): 15. DOI:10.1016/S0143-7208(01)00007-9 |
| [24] |
ZHANG H, ZENG YH, YAN F, et al. Semi-preparative isolation of crocins from saffron (Crocus sativus L.)[J]. Chromatographia, 2004, 59(11-12): 691. |
| [25] |
KOULAKIOTIS NS, GIKAS E, IATROU G, et al. Quantitation of crocins and picrocrocin in saffron by HPLC:application to quality control and phytochemical differentiation from other Crocus taxa[J]. Planta Med, 2015, 81(7): 606. DOI:10.1055/s-00000058 |
| [26] |
王一敏, 任晓蕾. 大孔树脂的应用研究[J]. 中医药信息, 2008, 25(4): 2. WANG YM, REN XL. Applcation study of macroporous resin[J]. Inf Tradit Chin Med, 2008, 25(4): 2. |
| [27] |
IBORRA JL, CASTELLAR MR, CANOVAS M, et al. TLC preparative purification of picrocrocin, HTCC and crocin from saffron[J]. J Food Sci, 1992, 57(3): 714. DOI:10.1111/jfds.1992.57.issue-3 |
| [28] |
PFISTER S, MEYER P, STECK A, et al. Isolation and structure elucidation of carotenoid-glycosyl esters in gardenia fruits (Gardenia jasminoides Ellis) and saffron (Crocus sativus Linne)[J]. J Agric Food Chem, 1996, 44(9): 2612. DOI:10.1021/jf950713e |
| [29] |
ITO Y. Recent advances in counter-current chromatography[J]. J Chromatogr A, 1991, 538(1): 3. DOI:10.1016/S0021-9673(01)91617-6 |
| [30] |
LI L, LIU CM, LIU ZQ, et al. Isolation and purification of phenylethanoid glycosides from plant extract of plantago asiatica by high performance centrifugal partition chromatography[J]. Chin Chem Lett, 2008, 19(11): 1349. DOI:10.1016/j.cclet.2008.09.002 |
| [31] |
JUBERT C, BAILEY G. Isolation of chlorophylls a and b from spinach by counter-current chromatography[J]. J Chromatogr A, 2007, 1140(1): 95. |
| [32] |
LAUTENSCHLAGER M, LECHTENBERG M, SENDKER J, et al. Effective isolation protocol for secondary metabolites from saffron:semi-preparative scale preparation of crocin-1 and trans-crocetin[J]. Fitoterapia, 2014, 92: 290. DOI:10.1016/j.fitote.2013.11.014 |
| [33] |
HE ML, CHENG XW, CHEN JK, et al. Simultaneous determination of five major biologically active ingredients in different parts of Gardenia jasminoides fruits by HPLC with diode-array detection[J]. Chromatographia, 2006, 64(11-12): 713. DOI:10.1365/s10337-006-0099-0 |
| [34] |
LECH KJ, WITOWSKA-JAROSZ J, JAROSZ M. Saffron yellow:characterization of carotenoids by high performance liquid chromatography with electrospray mass spectrometric detection[J]. J Mass Spectrom, 2009, 44(12): 1661. |
| [35] |
ZOUGAGH M, SIMONET BM, RIOS A, et al. Use of non-aqueous capillary electrophoresis for the quality control of commercial saffron samples[J]. J Chromatogr A, 2005, 1085(2): 293. DOI:10.1016/j.chroma.2005.06.041 |
| [36] |
何常明, 谢晓梅, 何美莲, 等. 西红花中西红花苷-1和西红花苷-2含量测定方法的建立[J]. 药物分析杂志, 2006, 26(9): 1270. HE CM, XIE XM, HE ML, et al. Establishment of determination method for crocin-I and crocin-Ⅱin Crocus sativus L[J]. Chin J Pharm Anal, 2006, 26(9): 1270. |
| [37] |
付小梅, 彭水梅, 刘倩, 等. HPLC法同时测定栀子类药材中10个主要有效成分的含量[J]. 药物分析杂志, 2014, 34(4): 615. FU XM, PENG SM, LIU Q, et al. Quantitative analysis of ten compounds in fruits of Gardenia by HPLC[J]. Chin J Pharm Anal, 2014, 34(4): 615. |
| [38] |
徐燕, 曹进, 王义明, 等. 多波长高效液相色谱法同时测定栀子中的三类成分[J]. 药学学报, 2003, 38(7): 3091. XU Y, CAO J, WANG YM, et al. Simultaneous determination of 3 kinds of components in Gardenia by high-performance liquid chromatography under different UV-vis wavelength[J]. Acta Pharm Sin, 2003, 38(7): 3091. |
| [39] |
杜鹏, 钱之玉. 西红花苷-1大鼠吸收及排泄的研究[J]. 中国新药杂志, 2004, 13(9): 801. DU P, QIAN ZY. Studies on the absorption and excretion of crocin-1 in rats[J]. Chin J New Drugs, 2004, 13(9): 801. |
| [40] |
唐琳, 颜钫, 徐莺. RP-HPLC法测定家兔血浆中西红花苷-1浓度及其药代动力学研究[J]. 药学学报, 2004, 39(10): 854. TANG L, YAN F, XU Y, et al. Determination of crocin-1 in rabbit plasma and the pharmacokinetics by RP-HPLC[J]. Acta Pharm Sin, 2004, 39(10): 854. DOI:10.3321/j.issn:0513-4870.2004.10.019 |
| [41] |
ASAI A, NAKANO T, NAGAO A, et al. Orally administered crocetin and crocins are absorbed into blood plasma as crocetin and its glucuronide conjugates in mice[J]. J Agric Food Chem, 2005, 53(18): 7302. DOI:10.1021/jf0509355 |
| [42] |
XI L, QIAN ZY, DU P, et al. Pharmacokinetic properties of crocin (crocetin digentiobiose ester) following oral administration in rats[J]. Phytomedicine, 2007, 14(9): 633. DOI:10.1016/j.phymed.2006.11.028 |
| [43] |
张颖, 刘建勋, 林力, 等. 大鼠口服西红花苷-1后吸收入血成分及药动学[J]. 中国药学杂志, 2012, 47(2): 136. ZHANG Y, LIU JX, LIN L, et al. Pharmacokinetics of crocin-1 after oral administration in rats[J]. Chin Pharm J, 2012, 47(2): 136. |
| [44] |
朱俊博, 史彦斌, 李向阳. 西红花苷-1经大鼠肌肉注射的体内药动学研究[J]. 中成药, 2014, 36(9): 1983. ZHU JB, SHI YB, LI XY. Pharmacokinetics of crocin-1 administered by intramuscular injection in rats[J]. Chin Tradit Pat Med, 2014, 36(9): 1983. |
| [45] |
UMIGAI N, MURAKAMI K, ULIT MV, et al. The pharmacokinetic profile of crocetin in healthy adult human volunteers after a single oral administration[J]. Phytomedicine, 2011, 18(7): 575. DOI:10.1016/j.phymed.2010.10.019 |
| [46] |
ZHANG Y, FEI F, ZHEN L, et al. Sensitive analysis and simultaneous assessment of pharmacokinetic properties of crocin and crocetin after oral administration in rats[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1044-1045: 1. DOI:10.1016/j.jchromb.2016.12.003 |
| [47] |
CARMONA M, ZALACAIN A, NOVELLA JL, et al. Crocetin esters, picrocrocin and its related compounds present in Crocus sativus stigmas and Gardenia jasminoides fruits.Tentative identification of seven new compounds by LC-ESI-MS[J]. J Agric Food Chem, 2006, 54(3): 973. DOI:10.1021/jf052297w |
| [48] |
DING Y, XIANG LY, ZHANG T, et al. Chemical fingerprint analysis of Gardenia jasminoides fruit by high-performance liquid chromatography[J]. J Food Drug Anal, 2010, 18(3): 180. |
| [49] |
WU XY, ZHOU Y, YIN F, et al. Quality control and producing areas differentiation of Gardeniae Fructus for eight bioactive constituents by HPLC-DAD-ESI-MS[J]. Phytomedicine, 2014, 21(4): 551. DOI:10.1016/j.phymed.2013.10.002 |
| [50] |
YIN FZ, WU XY, LI L, et al. Quality control of Gardeniae Fructus by HPLC-PDA fingerprint coupled with chemometric methods[J]. J Chromatogr Sci, 2015, 53(10): 1685. DOI:10.1093/chromsci/bmv072 |
| [51] |
CAI SX, ZHANG R, GUO Y, et al. Optimization of ultrasound-assisted extraction of gardenia fruit oil with bioactive components and their identification and quantification by HPLC-DAD/ESI-MS(2)[J]. Food Funct, 2015, 6(7): 2194. DOI:10.1039/C5FO00205B |
| [52] |
BERGONZI MC, RIGHESCHI C, ISACCHI B, et al. Identification and quantification of constituents of Gardenia jasminoides Ellis (Zhizi) by HPLC-DAD-ESI-MS[J]. Food Chem, 2012, 134(2): 1199. DOI:10.1016/j.foodchem.2012.02.157 |
| [53] |
VERMA RS, MIDDHA D. Analysis of saffron (Crocus sativus L.stigma) components by LC-MS-MS[J]. Chromatographia, 2010, 71(1): 117. |
| [54] |
MASI E, TAITI C, HEIMLER D, et al. PTR-TOF-MS and HPLC analysis in the characterization of saffron (Crocus sativus L.) from Italy and Iran[J]. Food Chem, 2016, 192: 75. DOI:10.1016/j.foodchem.2015.06.090 |
| [55] |
CHEN XJ, ZHAO J, WANG YT, et al. CE and CEC analysis of phytochemicals in herbal medicines[J]. Electrophoresis, 2012, 33(1): 168. DOI:10.1002/elps.201100347 |
| [56] |
关瑾, 刘芷含, 丁爽, 等. 色谱法在质子泵抑制剂药物对映体分离分析中的应用进展[J]. 药物分析杂志, 2014, 34(7): 1143. GUAN J, LIU ZH, DING S, et al. Application advances of chromatography in separation and determination of PPIs enantiomers[J]. Chin J Pharm Anal, 2014, 34(7): 1143. |
| [57] |
罗国安, 王义明. 毛细管电泳的原理及应用[J]. 色谱, 1995, 13(6): 437. LUO GA, WANG YM. Priciples and applications of capillary electrophoresis[J]. Chin J Chromatogr, 1995, 13(6): 437. |
| [58] |
SUGIURA M, SHOYAMA Y, SAITO H, et al. Crocin (crocetin di-gentiobiose ester) prevents the inhibitory effect of ethanol on long-term potentiation in the dentate gyrus in vivo[J]. J Pharmacol Exp Ther, 1994, 271(2): 703. |
| [59] |
ABE K, SUGIUA M, SHOYAMA Y, et al. Crocin antagonizes ethanol inhibition of NMDA receptor-mediated responses in rat hippocampal neurons[J]. Brain Res, 1998, 787(1): 132. DOI:10.1016/S0006-8993(97)01505-9 |
| [60] |
ESCRIBANO J, ALONSO GL, FERNANDEZ JA, et al. Crocin, safranal and picocrocin from saffron (Crocus sativus L.) inhibit the growth of human cancer cells in vitro[J]. Cancer Lett, 1996, 100(1-2): 23. DOI:10.1016/0304-3835(95)04067-6 |
| [61] |
PAPANDREOU MA, KANAKIS CD, POLISSIOU MG, et al. Inhibitory activity on amyloid-beta aggregation and antioxidant properties of Crocus sativus stigmas extract and its crocin constituents[J]. J Agric Food Chem, 2006, 54(23): 8762. DOI:10.1021/jf061932a |
| [62] |
XUAN B, ZHOU YH, LI N, et al. Effects of crocin analogs on ocular blood flow and retinal function[J]. J Ocul Pharmacol Ther, 1999, 15(2): 143. DOI:10.1089/jop.1999.15.143 |
 2018, Vol. 38
2018, Vol. 38 
