2. ChP-Waters联合开放实验室, 北京 100061;
3. 北京市药品检验所, 北京 102206
2. ChP-Waters Joint Open Laboratory, Beijing 100061, China;
3. Beijing Institute of Drug Control, Beijing 102206, China
阿托伐他汀钙是新一代他汀类降血脂药, 其降低胆固醇和调节血脂的效果优于辛伐他汀、普伐他汀、氟伐他汀和洛伐他汀。欧洲药典(EP)7.1版[1]、美国药典(USP)38版[2]等主要国外药典收载了阿托伐他汀钙或制剂的相关标准, 我国自阿托伐他汀国产化以来, 只在2003年发布了国家标准阿托伐他汀钙(WS1-(X-127)-2003Z)及阿托伐他汀钙片(WS1-(X-106)-2003Z), 距今已有14年, 此后随着其他仿制药的出现, 陆续颁布了各企业注册标准, 但一直未制定统一的国家标准进行质量控制。
在前期研究过程中发现, 现有国内产品质量标准、EP 7.1和USP 38的有关物质检查方法, 均存在分析时间过长, 有关物质种类检测不全且分离度不好等问题。经文献检索, 虽然涉及阿托伐他汀钙杂质及含量检测的相关文章已有数篇[3-15], 但未能解决上述问题。鉴于此, 首先, 通过对国内外阿托伐他汀钙及制剂生产工艺、质量标准进行调研, 同时, 参考EP 7.1和USP 38中有关物质检查色谱系统和杂质控制情况, 分析得出阿托伐他汀钙及制剂中可能存在的有关物质;然后, 选用灵敏度和分离度更高, 分析速度更快的新技术UPLC, 建立了检测阿托伐他汀钙及其相关7个杂质(见图 1)的方法;随后, 为兼顾检查方法应用的普遍性, 将UPLC法合理转换为HPLC法。试验证明, UPLC法和转换后的HPLC法均能准确有效地控制本品及其制剂的有关物质, 测定结果基本一致, 但前者在检测时间、分离度和灵敏度方面优势明显。
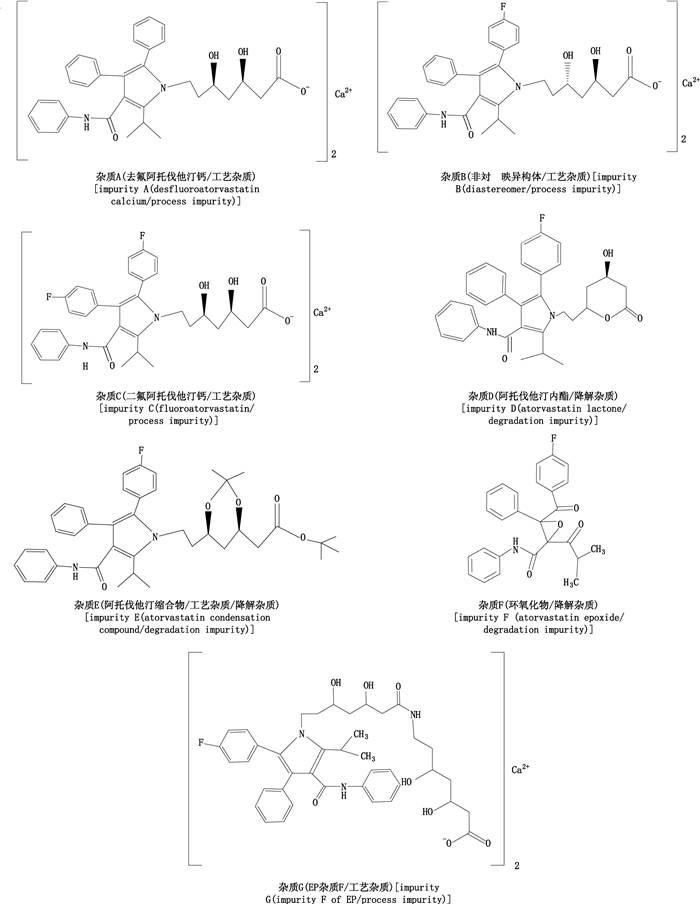
|
图 1 阿托伐他汀钙及其制剂中的7个杂质 Figure 1 Seven impurities in atorvastatin calcium and its preparation |
Waters ACQUITY H-Class UPLC;Waters Alliance HPLC;梅特勒公司BP210十万分之一天平。
1.2 试药阿托伐他汀钙对照品(中国食品药品检定研究院, 含量95.3%);阿托伐他汀钙原料药、阿托伐他汀钙胶囊、阿托伐他汀钙片均为国内相关企业提供;杂质A对照品(含量91.0%)、杂质B对照品(含量79.45%)、杂质C对照品(含量93.1%)、杂质D对照品(含量99.1%)及杂质E对照品(含量99.7%)均为北京嘉林药业提供, 杂质F对照品(含量90.0%)由大连辉瑞公司提供;乙腈、N, N-二甲基甲酰胺(DMF)均为Merck公司色谱纯, 四氢呋喃(不含稳定剂)为Merck公司HPLC专用, 水为超纯水, 其他试剂均为分析纯。
2 方法与结果 2.1 色谱条件UPLC:采用Waters Acquity BEH Shield RP18色谱柱(2.1 mm×150 mm, 1.7 μm), 流动相A为20 mmol·L-1醋酸铵溶液(用冰醋酸调节pH为4.0), 流动相B为乙腈-四氢呋喃(95:5), 梯度洗脱程序见表 1, 流速0.4 mL·min-1, 检测波长254 nm(各杂质在244 nm吸光度强, 但是254 nm基线平稳, 信噪比优于244 nm, 因此采用254 nm作为检测波长), 柱温35 ℃, 进样量2 μL;HPLC:采用Waters Symetry Shield RP18色谱柱(4.6 mm×250 mm, 5 μm), 流动相组成、柱温及检测波长同UPLC, 梯度洗脱程序见表 1, 流速为1.5 mL·min-1, 进样量20 μL。
|
|
表 1 梯度洗脱程序(UPLC/HPLC) Table 1 UPLC/HPLC gradient elution program |
取杂质A、B、C、D、E、F的对照品各适量, 精密称定, 用DMF溶解并定量稀释制成每1 mL中约含杂质A、B、C、D、E、F各25 μg的混合溶液, 作为对照品储备液;精密量取对照品储备液适量, 用DMF定量稀释制成每1 mL中分别含2 μg的混合溶液, 即得。
2.2.2 供试品溶液(1)精密称取本品10 mg, 加DMF适量, 超声使阿托伐他汀钙溶解, 用DMF定量稀释制成每1 mL中约含阿托伐他汀钙1 mg的溶液, 即得。
2.2.3 供试品溶液(2)精密称取阿托伐他汀钙25 mg和空白辅料380 mg(共12份), 置25 mL量瓶中, 分别精密量取“2.2.1”项下制备的对照品储备液1.5、2、3、5 mL(各3份), 加DMF适量, 超声使溶解, 用DMF稀释至刻度, 摇匀, 即得。
2.3 系统适用性试验取杂质A、B、C、D、E、F及阿托伐他汀钙的对照品适量, 精密称定, 加DMF超声使溶解并稀释制成每1 mL中约含A、B、C、D、E、F及阿托伐他汀钙各50 μg的混合溶液, 作为系统适用性溶液;照“2.1”项下色谱条件, 精密量取系统适用性溶液, 分别注入UPLC仪和HPLC仪, 记录色谱图, 见图 2。由图可见, 除保留时间不同外, 两方法系统适用性溶液中非对映异构体(杂质B)与阿托伐他汀的色谱峰均能达到基线分离, 能满足有关物质测定要求。
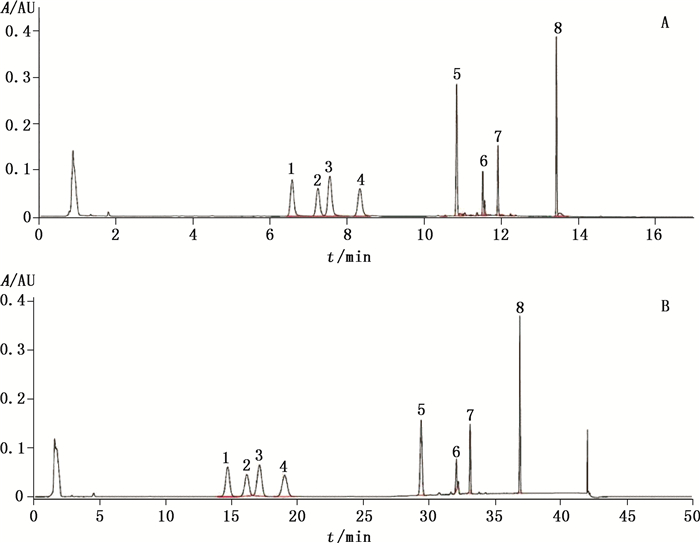
|
1.杂质A(impurity A) 2.杂质B(impurity B) 3.阿托伐他汀(atorvastatin) 4.杂质C(impurity C) 5.杂质D(impurity D) 6.杂质F的降解产物(degradation product of impurity F) 7.杂质F(impurity F) 8.杂质E(impurity E) 图 2 UPLC(A)、HPLC(B)系统适用性色谱图 Figure 2 System suitability chromatograms by UPLC(A) and HPLC(B) |
取阿托伐他汀钙25 mg(6份), 分别置25 mL量瓶中, 进行如下试验: ①酸破坏加2.5 mol·L-1盐酸溶液2 mL, 摇匀, 室温中放置2 h后, 以2.5 mol·L-1的氢氧化钠溶液2 mL中和;②碱破坏加2.5 mol·L-1氢氧化钠溶液2 mL, 室温放置2 h, 以2.5 mol·L-1盐酸溶液2 mL中和;③高温破坏105 ℃恒温烘箱中放置8.5 h;④氧化破坏加30%双氧水溶液1.5 mL, 室温放置18 h;⑤光照破坏置4 500 lx (254 nm和365 nm)强光下照射23 h;⑥未破坏。再分别向量瓶中加入DMF使溶解并稀释至刻度, 摇匀, 即得供试溶液①、②、③、④、⑤和⑥。按“2.1”项下UPLC和HPLC色谱条件进样测定, 两方法物料平衡基本一致, 各杂质峰之间以及与阿托伐他汀主峰分离度良好, 结果见表 2。其中, 两方法测定的氧化破坏和光照破坏结果差异略大, 分析原因, 可能与本品对氧化和光照较为敏感, 而HPLC分析时间较长, 破坏程度更大有关。
|
|
表 2 HPLC与UPLC强制破坏试验物料平衡比较 Table 2 Comparison of mass balance between HPLC and UPLC |
UPLC方法:取“2.2.2”项下配制的供试品溶液(1), 避光4 ℃放置5 h, 在第0、1、2、3、4、5 h时分别测定, 并记录色谱图, 主峰面积几乎无变化;杂质A、D、E均变化不明显, RSD均小于1%;其他杂质峰面积的绝对值变化小, 对结果的影响可忽略不计;杂质F不稳定, 故供试品溶液(1)应临用新制。HPLC方法:取供试品溶液(1), 避光4 ℃放置15 h, 情况与UPLC基本一致。
2.6 杂质线性及校正因子精密称取阿托伐他汀钙和各杂质对照品适量, 分别加DMF溶解并稀释制成0.08、0.16、0.24、0.4、0.8、2、4和8 µg·mL-1的系列浓度的混合溶液。照“2.1”项下色谱条件测定, 记录色谱图, 以浓度对峰面积进行线性回归, UPLC方法和HPLC方法, 阿托伐他汀钙以及除杂质F外的其他杂质的线性关系良好, 相关系数(r)大于0.999, 符合有关物质检查要求;杂质F不稳定, 分解成数个峰, 将峰面积相加后计算, 线性符合要求。以主成分与各杂质线性斜率的比值计算校正因子, 各杂质校正因子均在0.9~1.1之间。
2.7 检测下限UPLC方法:对“2.6”项下获得的阿托伐他汀钙和各杂质质量浓度为0.08 μg·mL-1的混合溶液的色谱图进行分析, 杂质A、B、阿托伐他汀和杂质C的信噪比约为3, 杂质D、E和F信噪比约为10;检测下限为0.08 μg·mL-1。HPLC方法:对“2.6”项下获得的阿托伐他汀钙和各杂质质量浓度为0.16 μg·mL-1的混合溶液的色谱图进行分析, 杂质A、B、阿托伐他汀和杂质C的信噪比约为3, 杂质D、E和F信噪比约为10;检测下限为0.16 μg·mL-1, 约为UPLC的2倍。
2.8 回收率试验分别取“2.2.1”项下的对照品溶液和“2.2.3”项下供试品溶液(2), 按“2.1”项下色谱条件测定, 结果见表 3。UPLC方法:杂质A、B、C、D和E的平均回收率在99.0%~107.0%之间, RSD小于10%, 符合要求;杂质F平均回收率偏高, 达到130%。HPLC方法:杂质A、B、C、D和E的平均回收率在94.0%~102.0%之间, RSD小于10%, 符合要求;杂质F平均回收率偏低, 仅为87.7%。
|
|
表 3 杂质A~F回收率试验结果 Table 3 The results of recovery test for impurities A-F |
按照“2.1”项下UPLC方法和HPLC方法的色谱条件, 对阿托伐他汀钙5个企业10批样品、阿托伐他汀钙片剂4个企业14批样品以及阿托伐他汀钙胶囊1个企业6批样品, 按加校正因子的主成分外标法进行有关物质测定, 2种方法测定结果基本一致。随机选各企业样品1批测定结果见表 4。
|
|
表 4 UPLC和HPLC方法对样品进行有关物质测定结果(%) Table 4 The results of the test for related substances by UPLC/HPLC |
考察不同品牌C18色谱柱(UPLC: Fortis、Phenomenex、Waters;HPLC: Waters、Phenomenex、Cappcel)、柱温(30、35、40 ℃)、流速(UPLC: 0.38、0.40、0.42 mL·min-1;HPLC: 1.4、1.5、1.6 mL·min-1)、梯度初始比例(UPLC: 61:39;58:42;55:45。HPLC: 60:40;58:42;56:44)、流动相pH(3.8、4.0、4.2)以及流动相中四氢呋喃不同比例(4%、5%、6%)等。结果:不同品牌C18色谱柱影响最大, 主峰保留时间差别明显, 如不使用推荐色谱柱, 可造成其他未知杂质分离不够, 被隐藏而不能被检测的问题;不同梯度洗脱初始比例对方法存在一定影响;其他参数的微小变化基本不影响。
3.2 杂质F(环氧化物)测定的特殊性UPLC方法:杂质F回收率偏高。分析原因可能为: ①杂质F对照品溶液不稳定, 在4 ℃避光放置仍会分解, 杂质F色谱峰附近可以检出多个色谱峰, 由于响应值可能不同, 加和计算回收率存在误差;②阿托伐他汀钙结构中含羰基、羟基等易氧化基团, 在溶液制备过程中也会分解出少量氧化产物。由于“2.8”项下回收率试验中的对照品溶液浓度仅为2 μg·mL-1, 阿托伐他汀钙产生少量分解物即影响回收率结果。HPLC方法:杂质回收率偏低。结论与UPLC相反, 分析原因, 杂质F不稳定, HPLC方法试验时间过长, 杂质F更多的分解, 在加和计算时, 部分分解的峰未被加入。综上, 建议在实际测定过程中避光操作, 供试品溶液和对照品溶液均要临用新配。
3.3 杂质G的确定杂质G为工艺杂质, 在拟定方法中相对阿托伐他汀峰保留时间的0.5左右, 经实验室高分辨质谱确证其为EP 8.0标准中所列出的杂质F, “2.9”项样品测定结果显示拟定方法可准确测定其含量。
3.4 杂质含量的情况“2.9”项样品测定结果显示, 各企业产品含有已知杂质种类略有不同, 但主要为杂质D和F, 部分企业产品含有杂质A和G, 几乎不含有杂质B、C、E;同一企业产品检出杂质种类一致, 但各杂质含量与放置时间明显相关, 如片剂, 有3批样品在检验时恰过有效期, 杂质总量为同企业产品中最高, 达到1%左右, 但结果符合各自质量标准有关物质限度规定。
3.5 现有国家标准有关物质检查方法的不足在进行前期研究时, 实验室取阿托伐他汀钙样品, 照现有国家标准阿托伐他汀钙(WS1-(X-127)-2003Z)有关物质的检测方法试验, 记录色谱图(见图 3)。阿托伐他汀保留时间约为12.5 min, 整个测定时间约为38 min, 此方法杂质B峰与主成分峰、杂质E峰和杂质F峰无法分离。可见, 此方法存在有关物质种类检测不全, 分离度不好等缺陷, 不能进行有效的质量控制。
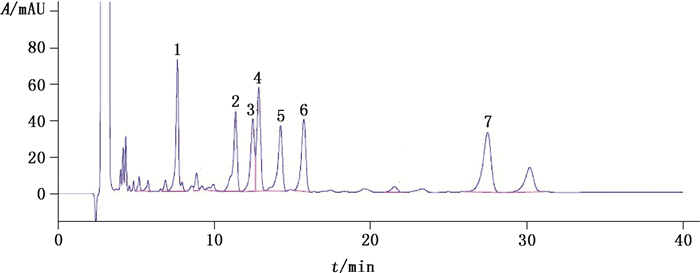
|
1.杂质G(impurity G) 2.杂质A(impurity A) 3.杂质B(impurity B)4.阿托伐他汀(atorvastatin) 5.杂质C(impurity C) 6.杂质D(impurity D) 7.杂质E+杂质F(impurity E+impurity F) 图 3 阿托伐他汀钙(WS1-(X-127)-2003Z)有关物质色谱图 Figure 3 Chromatogram of related substances in atorvastatin calcium(WS1-(X-127)-2003Z) |
UPLC方法能够快速、准确地确定杂质种类和含量等信息, 弥补了现有标准用时长, 杂质种类归属不明, 分离不完全等问题。同时, 在UPLC大量试验数据的基础上, 采用软件转换, 并结合分离度情况对参数进行调整后, 确立了HPLC方法(方法转换细节可参考文献“超高效液相色谱与液相色谱方法转换与验证”[16]及其他相关文献[17-18])。HPLC方法虽然在分离度、灵敏度、检测时长等方面均与UPLC方法存在差距, 但与现有国家标准中的HPLC方法比较, 已能较好地归属和分离各杂质。
因此, 在经过大量试验证明UPLC方法和HPLC方法间能够转化, 且结果无显著差异时, 建议在建立标准时可以2种方法并存。这样既鼓励了新技术在药品标准中的应用, 也有利于药品质量的提高和药品检测分析水平的进步。
3.7 在含量测定中的应用UPLC方法和HPLC方法中, 采用相同的色谱条件, 从系统适用性图谱可知, 阿托伐他汀在梯度第一阶段即出峰, 因此可以采用流动相初始比例进行等度洗脱, 且主峰之后的微量杂质不影响含量测定结果, 故不需采用梯度洗脱, 这样可以大大缩短分析时间, 提高效率。
| [1] |
EP 7. 1[S]. 2011: 1598
|
| [2] |
USP 38-NF 33[S]. 2016: 2314
|
| [3] |
张明颖, 孙国祥. HPLC法测定阿托伐他汀钙3种中间体的含量和有关物质[J]. 中国药房, 2013, 24(1): 83. ZHANG MY, SUN GX. Content determination and related substances of 3 kinds of intermediates of atorvastatin calcium by HPLC[J]. China Pharm, 2013, 24(1): 83. DOI:10.6039/j.issn.1001-0408.2013.01.30 |
| [4] |
李文莉, 钟庆元, 文庆. HPLC法测定阿托伐他汀钙胶囊的含量及有关物质[J]. 药物分析杂志, 2007, 27(2): 267. LI WL, ZHONG QY, WEN Q. HPLC determination of the content of atorvastatin calcium capsules and its related substances[J]. Chin J Pharm Anal, 2007, 27(2): 267. |
| [5] |
张晓峰, 侯晓清, 邓凤霞, 等. HPLC法测定阿托伐他汀钙有关物质[J]. 药物分析杂志, 2014, 34(8): 1504. ZHANG XF, HOU XQ, DENG FX, et al. Determination of related substances in atorvastatin calcium by HPLC[J]. Chin J Pharm Anal, 2014, 34(8): 1504. |
| [6] |
汪钦标, 杨成钰. HPLC法测定阿托伐他汀钠含量及有关物质[J]. 轻工科技, 2012(3): 124. WANG QB, YANG CY. Content determination and related substances of atorvastatin by HPLC[J]. Light Ind Sci Technol, 2012(3): 124. |
| [7] |
张亚平, 杨淑莲, 陈芬儿. HPLC法检测阿托伐他汀钙有关物质的含量及光学纯度[J]. 药物分析杂志, 2010, 30(12): 2311. ZHANG YP, YANG SL, CHEN FE. HPLC determination of related substances and enantiomeric purity of atorvastatin calcium[J]. Chin J Pharm Anal, 2010, 30(12): 2311. |
| [8] |
蒋厦, 沈卫阳. RP-HPLC法测定阿托伐他汀钙片的有关物质[J]. 海峡药学, 2013, 25(8): 60. JIANG X, SHEN WY. Determination of the related substances in atorvastatin calcium tablets by RP-HPLC[J]. Strait Pharm J, 2013, 25(8): 60. |
| [9] |
王正林, 应俊, 林圣超, 等. 阿托伐他汀钙的合成研究进展[J]. 中国现代应用药学, 2011, 28(5): 423. WANG ZL, YING J, LIN SC, et al. Progress in synthesis of atorvastatin calcium[J]. Chin J Mod Appl Pharm, 2011, 28(5): 423. |
| [10] |
王文清, 汪秋兰, 谢斌, 等. 高效液相色谱法测定阿托伐他汀钙中的有关物质[J]. 中国医院药学杂志, 2013, 33(19): 1648. WANG WQ, WANG QL, XIE B, et al. Determination of related substances in atorvastatin calcium by HPLC[J]. Chin J Hosp Pharm, 2013, 33(19): 1648. |
| [11] |
熊苗苗, 汪秋兰, 谢斌, 等. 高效液相梯度洗脱法测定阿托伐他汀钙片有关物质[J]. 医药导报, 2013, 32(5): 656. XIONG MM, WANG QL, XIE B, et al. Determination of related substances in atorvastatin calcium by HPLC[J]. Her Med, 2013, 32(5): 656. |
| [12] |
张学燕, 田晓彤, 张轶华. HPLC法测定阿托伐他汀钙片中的有关物质[J]. 中国药房, 2014, 25(28): 2673. ZHANG XY, TIAN XT, ZHANG YH. Determination of related substances in atorvastatin calcium tablets by HPLC[J]. China Pharm, 2014, 25(28): 2673. DOI:10.6039/j.issn.1001-0408.2014.28.28 |
| [13] |
GUPTA LK. Spectroscopic characterization and quantitative determination of atorvastatin calcium impurities by novel HPLC method[J]. Spectrochim Acta Part A Mol Biomol Spectrosc, 2012, 97(6): 495. |
| [14] |
PETKOVSKA R, CORNETT C, DIMITROVSKA A. Development and validation of rapid resolution RP-HPLC method for simultaneous determination of atorvastatin and related compounds by use of chemometrics[J]. Anal Lett, 2008, 41(6): 992. DOI:10.1080/00032710801978566 |
| [15] |
NIGOVIĆ B, DAMIĆ M, INJAC R, et al. Analysis of atorvastatin and related substances by MEKC[J]. Chromatographia, 2009, 69(11-12): 1299. DOI:10.1365/s10337-009-1049-4 |
| [16] |
高青, 刘颖, 宋彬彬, 等. 超高效液相色谱与高效液相色谱方法转换及验证[J]. 药物分析杂志, 2016, 36(7): 1279. GAO Q, LIU Y, SONG BB, et al. Method conversion and validation between HPLC and UPLC[J]. Chin J Pharm Anal, 2016, 36(7): 1279. |
| [17] |
马双成. 药品检测新技术:从HPLC到UHPLC[M]. 北京: 人民卫生出版社, 2012. MA SC. Drug Testing Technologies:From HPLC to UHPLC[M]. Beijing: People's Medical Publishing House, 2012. |
| [18] |
NEUE ND, MCCABE D, RAMESH V, et al. Transfer of HPLC procedure to suitable columns of reduced dimensions and partical size[J]. Pharmacopeial Forum, 2009, 35(6): 1623. |
 2018, Vol. 38
2018, Vol. 38 
