2. 陕西省食品药品监督检验研究院, 西安 710065
2. Shaanxi Institute for Food and Drug Control, Xi'an 710065, China
莨菪浸膏片由三分三浸膏或颠茄浸膏加适量辅料制成, 其主要化学成分包括阿托品、东莨菪碱、山莨菪碱、樟柳碱等莨菪烷类生物碱[1]。莨菪浸膏片为外周抗胆碱药, 能够解除平滑肌痉挛, 增加心肌血流量, 扩张冠状动脉, 改善血液流态、流速、流量, 增加组织供氧量。因此常用于治疗冠心病以及胃、十二指肠、胆、肾等绞痛[2]。
目前莨菪浸膏片含量测定的成分较为单一, 其采用的方法主要有酸性染料比色法[3]、高效液相色谱法[3-4]、区带毛细管电泳法[5]、核磁共振法[6]等。其中酸性染料比色法提取分离过程烦琐, 结果重复性较差, 而且只能测定总碱含量, 不能准确测定各生物碱的含量;区带毛细管电泳法以盐酸小檗碱为内标, 测定了样品中莨菪烷类生物碱的含量, 但该方法检测灵敏度和准确度较低, 仪器设备普及率低, 且需多种对照品, 检验检测成本较高;高效液相色谱法操作简单, 检测灵敏度高, 但以往文献报道均采用外标法对其中1个或几个莨菪烷类生物碱的含量进行测定, 该方法亦需多种对照品, 增加了检验检测成本;而核磁共振法虽能测定未知成分, 精密度高, 适用于科学研究, 但测定成分单一, 仪器设备普及率极低, 结果的分析较为复杂, 增加了检验检测的时间与成本, 因此该方法不能得到广泛普及。
阿托品、东莨菪碱、山莨菪碱均为莨菪烷类生物碱, 结构类似, 因此, 本研究对比以往文献及药品标准[7-14], 采用一测多评法同时测定了3个生物碱含量。研究中建立了高效液相色谱梯度洗脱的方法, 以硫酸阿托品作为内参物, 分别计算阿托品、东莨菪碱、山莨菪碱的相对校正因子, 测定了莨菪浸膏片中3个莨菪烷类生物碱的含量。该方法操作简单, 结果准确, 方法灵敏度高, 应用范围广。此外, 由于采用了一测多评的方法, 既实现了多指标成分同时测定, 又减少了对照品的使用, 显著降低了检验检测成本, 为莨菪浸膏片的质量控制及药品标准的提高提供了科学数据。
1 仪器与试药 1.1 仪器SHIMADZU LC-3D高效液相色谱仪, Empower工作站;Phenomenex Gemini-NX C18色谱柱(4.6 mm×250 mm, 5 μm);METTLER TOLEDO XPE105电子分析天平(精度为0.01 mg);长沙湘仪离心机仪器有限公司TG16-WS台式高速离心机;昆山市超声仪器有限公司KQ-500型数控超声波清洗器。
1.2 试药莨菪浸膏片(厂家A, 批号1509559;厂家B, 批号151004、151005、151006);对照品硫酸阿托品(批号100040-201312, 纯度97.2%)、氢溴酸东莨菪碱(批号100049-201310, 纯度99.6%)、氢溴酸山莨菪碱(批号100051-201607, 纯度99.3%)均购自中国食品药品检定研究院;甲醇为色谱纯(默克股份两合公司), 水为超纯水(北京同泰联科技发展有限公司TTL-30C型超纯水器制备), 其他试剂均为分析纯(国药化学集团有限公司)。
2 方法与结果 2.1 色谱条件色谱柱: Phenomenex C18(4.6 mm×250 mm, 5 μm);流动相:甲醇(A)-0.05%磷酸水溶液(B), 梯度洗脱程序见表 1;检测波长: 218 nm;流速: 1.0 mL·min-1;柱温: 30 ℃;进样量: 50 μL。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution program |
精密称取硫酸阿托品、氢溴酸东莨菪碱、氢溴酸山莨菪碱的对照品适量, 加水溶解并定量稀释制成每1 mL中约含硫酸阿托品0.6 mg, 氢溴酸东莨菪碱0.3 mg, 氢溴酸山莨菪碱0.3 mg的混合溶液, 即得。
2.2.2 混合对照品溶液精密量取混合对照品储备液适量, 加水定量稀释制成每1 mL中约含硫酸阿托品60 μg, 氢溴酸东莨菪碱30 μg, 氢溴酸山莨菪碱30 μg的混合溶液, 即得。
2.2.3 供试品溶液取本品20片, 研细, 精密称取适量(约相当于总碱量0.24 mg), 置具塞离心管中, 精密加入0.05 mol·L-1硫酸溶液5.0 mL, 密塞, 精密称定, 置热水浴中超声(功率500 W, 频率40 kHz)提取30 min, 放冷, 再精密称定, 用0.05 mol·L-1硫酸溶液补足减失的量, 离心(12 000 r·min-1, 10 min), 取上清液, 滤过, 即得。
2.3 方法学考察 2.3.1 系统适用性考察精密吸取混合对照品溶液与供试品溶液各50 µL, 按上述色谱条件注入液相色谱仪。结果显示, 阿托品、东莨菪碱、山莨菪碱三者分离良好, 相邻色谱峰间分离度均大于1.5, 样品测定无干扰。混合对照品溶液及供试品溶液色谱图见图 1。
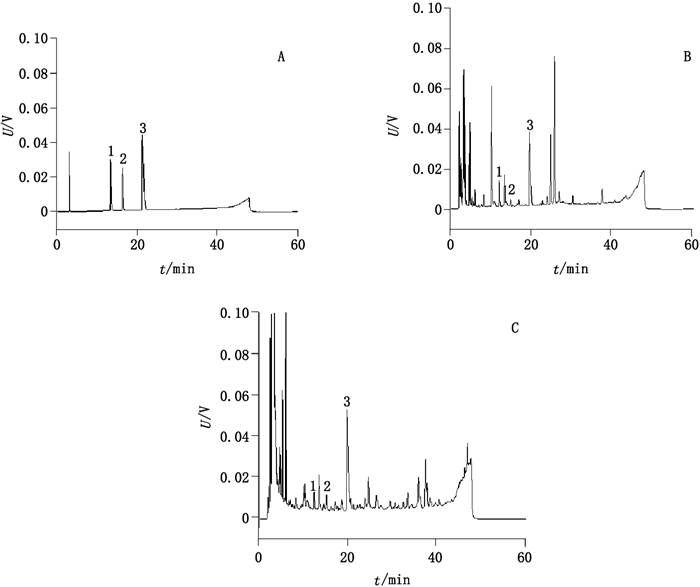
|
1.东莨菪碱(scopolamine) 2.山莨菪碱(anisodamine) 3.阿托品(atropine) 图 1 混合对照品(A)、厂家A样品(B)及厂家B样品(C)色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A), sample from manufacturer A(B)and sample from manufacturer B(C) |
分别取混合对照品储备液适量, 按一定比例稀释配制成7个浓度的系列混合对照品溶液。精密吸取上述系列浓度混合对照品溶液各50 µL注入高效液相色谱仪, 以质量浓度X为横坐标, 峰面积Y为纵坐标绘制标准曲线, 进行线性回归, 所得结果见表 2。
|
|
表 2 3种生物碱的回归方程、相关系数(r)及线性范围 Table 2 Regression equations, correlation coefficient(r)and linearity ranges of 3 alkaloids |
精密量取“2.2.2”项下的混合对照品溶液, 逐步定量稀释, 进样分析;分别以信噪比3和10为检测下限和定量下限, 确定阿托品、东莨菪碱、山莨菪碱的检测下限分别为0.038 1、0.026 7、0.004 0 μg·mL-1, 定量下限分别为0.127 0、0.088 9、0.013 2 μg·mL-1。
2.3.4 精密度试验精密吸取“2.2.2”项下混合对照品溶液50 μL, 连续进样6次, 记录峰面积, 阿托品、东莨菪碱、山莨菪碱峰面积的RSD分别为0.05%、0.13%、0.14%, 结果表明仪器精密度良好。
2.3.5 稳定性试验精密吸取同一供试品溶液(样品批号151004)50 μL, 分别在配制后0、2、4、8、10、12、24 h进样测定峰面积, 阿托品、东莨菪碱、山莨菪碱峰面积的RSD分别为0.99%、1.2%、1.6%, 结果表明供试品溶液在24 h内稳定。
2.3.6 重复性试验取同一批样品(批号151004)按“2.2.3”项下方法平行制备6份供试品溶液, 按“2.1”项下色谱条件进样测定, 计算阿托品、东莨菪碱、山莨菪碱含量平均值分别为26.008、1.119、0.822 µg·片-1, RSD分别为2.6%、2.9%、2.7%, 表明该方法重复性良好。
2.3.7 加样回收率试验精密称取9份样品(批号151004)适量(约相当于总碱量0.12 mg), 置具塞离心管中, 分别按低(80%)、中(100%)、高(120%)3个水平精密加入混合对照品溶液各3份, 按“2.2.3”项下方法制备供试溶液, 按“2.1”项下色谱条件进样测定, 计算加样回收率。结果阿托品、东莨菪碱、山莨菪碱的平均加样回收率分别为95.7%、93.6%、94.9%, RSD分别为1.7%、1.5%、1.6%。
2.4 相对校正因子的考察 2.4.1 相对校正因子的计算首先以硫酸阿托品为内参物计算阿托品的相对校正因子, 硫酸阿托品的相对分子质量为676.82, 阿托品的相对分子质量为289.37, 由于硫酸阿托品是两分子的阿托品与硫酸结合, 因此将阿托品的相对分子质量乘以2除以硫酸阿托品的相对分子质量, 为阿托品的相对校正因子即0.8551。根据《中华人民共和国药典》2015年版四部ⅤD高效液相色谱法指导意见, 采用加校正因子主成分对照法计算其他对照品的相对校正因子。如, 氢溴酸东莨菪碱的相对校正因子计算公式为f硫酸阿托品/氢溴酸东莨菪碱=(A硫酸阿托品/C硫酸阿托品)/(A氢溴酸东莨菪碱/C氢溴酸东莨菪碱), f硫酸阿托品/东莨菪碱=f硫酸阿托品/氢溴酸东莨菪碱·0.855 1, 而C样品中东莨菪碱=(f硫酸阿托品/东莨菪碱·A样品中东莨菪碱)/(A硫酸阿托品/C硫酸阿托品)。
同理可得, 可以以硫酸阿托品作为内参物来计算其他主成分含量, f硫酸阿托品/山莨菪碱=f硫酸阿托品/氢溴酸山莨菪碱·0.855 1;而C样品中山莨菪碱=(f硫酸阿托品/山莨菪碱·A样品中山莨菪碱)/(A硫酸阿托品/C硫酸阿托品)。
同理可得, 可以以硫酸阿托品作为内参物来计算其他主成分含量, C东莨菪碱=(f硫酸阿托品/东莨菪碱·A东莨菪碱)/(A硫酸阿托品/C硫酸阿托品);C山莨菪碱=(f硫酸阿托品/山莨菪碱·A山莨菪碱)/(A硫酸阿托品/C硫酸阿托品)。
分别精密吸取“2.3.2”项下的系列浓度混合对照品溶液各50 µL, 按“2.1”项下的色谱条件进样分析, 记录峰面积, 计算相对校正因子的平均值, 结果分别为f硫酸阿托品/阿托品=0.855 1, f硫酸阿托品/东莨菪碱=0.950 3, f硫酸阿托品/山莨菪碱=0.760 5。
2.4.2 相对校正因子的重现性考察 2.4.2.1 不同仪器、不同色谱柱对相对校正因子的影响本研究分别考察SHIMADZU LC-30AD和Agilent 1260高效液相色谱仪, Phenomenex Gemini-NX C18 110A(250 mm×4.6 mm, 5 μm)、GL Sciences Inc C18(250 mm×4.6 mm, 5 μm)、Thermo ODS C18(250 mm×4.6 mm, 5 μm)色谱柱对相对校正子的影响。结果表明, 相对校正因子在不同色谱柱条件下基本一致, 结果见表 3。
|
|
表 3 不同仪器、不同色谱柱条件的相对校正因子 Table 3 Relative correction factors in different instruments and columns |
本研究分别考察了在不同仪器、不同色谱柱条件下各待测组分色谱峰与阿托品色谱峰的相对保留时间, 对各待测组分进行定位考察, 结果(表 4)表明, 各组分相对保留时间波动较大, 不能采用相对保留时间对色谱峰进行定位。因此, 可将上述3个对照品(可用供鉴别对照品代替)制成混合对照品溶液, 采用混合对照品溶液进行待测组分峰的定位。
|
|
表 4 不同仪器、不同色谱柱条件下各组分相对保留时间 Table 4 Relative retention time determined by different instruments and columns |
按“2.2.2”项下方法制备供试品溶液, 精密吸取混合对照品溶液与供试品溶液各50 µL, 按上述色谱条件分别注入高效液相色谱仪进行测定。分别采用外标法(ESM)和一测多评(QAMS)法计算各组分含量并进行比较, 结果显示2种方法所得结果基本一致, 见表 5。
|
|
表 5 一测多评法与外标法莨菪浸膏片中3个生物碱的含量(n=5) Table 5 Content of Hyoscyamus extract tablets determined by QAMS and ESM |
研究中分别采用乙醇和0.05 mol·L-1的硫酸溶液在热水浴中超声提取。具体方法见供试品溶液制备项下。结果显示:样品在0.05 mol·L-1的硫酸溶液中热水浴超声提取30 min, 其中生物碱即可溶解完全, 杂质较少。该方法提取方便, 操作简单, 重复性好。而乙醇提取引入其他脂溶性杂质较多, 且提取率低。
3.2 流动相的考察研究中分别采用3种流动相进行洗脱。流动相1为甲醇-0.02 mol·L-1磷酸氢二钠(加入0.02%三乙胺、0.3%四氢呋喃, 磷酸调pH至5.0)(25:75);流动相2为0.01 mol·L-1的四甲基氯化铵溶液(磷酸调pH至2.2)-甲醇(80:20)等度洗脱;流动相3为甲醇(A)-0.05%磷酸水溶液(B)进行梯度洗脱(洗脱程序见表 1)。结果显示, 混合对照品溶液在不同流动相条件下均能得到较好的分离, 但样品成分复杂, 前2种流动相为等度洗脱, 30 min内均无法完全分离。采用流动相3进行梯度洗脱(即本文选择的流动相组成及梯度洗脱程序), 样品中的色谱峰可达到完全分离。
4 结论本研究采用一测多评法分别测定4批莨菪浸膏片中阿托品、东莨菪碱、山莨菪碱的含量, 对该方法进行方法学考察, 并将其与外标法进行比较, 两者含量测定结果基本一致, 总生物碱含量符合要求。此外, 据文献报道, 莨菪浸膏片中还含有较多樟柳碱, 因此本研究起初计划测定其中阿托品、东莨菪碱、山莨菪碱、樟柳碱4个生物碱的含量, 但结果未检出樟柳碱。经分析, 可能存在以下几种原因:第一, 由于原料为中药, 其原料的采收季节及产地的不同可能会导致化学成分发生改变;第二, 此药品来源有2种, 分别为颠茄和三分三, 并且中药中同名异物现象较多;第三, 野生与人工种植的中药亦存在差别, 以上原因都有可能导致樟柳碱未检出, 但其具体原因还需进一步研究。综上所述, 以上结果表明该方法准确、可靠, 重现性好, 具有可行性和科学性, 与以往文献及标准中的方法相比, 操作简单, 准确度高, 减少了对照品的使用, 降低检验检测成本的同时提高了检测检验效率, 为莨菪浸膏片质量标准的研究提供了理论依据。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志.第67卷[M]. 北京: 科学出版社, 1978, 24. Editorial Board of Flora of China, Chinese Academy of Sciences. Flora of China. Vol 67[M]. Beijing: Science Press, 1978, 24. |
| [2] |
国家中医药管理局《中华本草》编委会. 中华本草.第19卷[M]. 上海: 上海科学技术出版社, 1999, 238. Chinese Herbalism Editorial Board, State Administration of Traditional Chinese Medicine. Chinese Herbalism. Vol 19[M]. Shanghai: Shanghai Science and Technology Publishers, 1999, 238. |
| [3] |
吴少平, 柳小秦, 罗晶, 等. 莨菪浸膏片质量标准研究[J]. 药物分析杂志, 2008, 28(8): 1319. WU SP, LIU XQ, LUO J, et al. Study on quality standard of Hyoscyamus extract tablets[J]. Chin J Pharm Anal, 2008, 28(8): 1319. |
| [4] |
庞谤, 杨欣, 孙文基. 高效液相色谱法测定莨菪浸膏片中阿托品的含量[J]. 药物分析杂志, 2008, 28(3): 414. PANG B, YANG X, SUN WJ. Determination of atropine in Hyoscyamus extract tablets by HPLC[J]. Chin J Pharm Anal, 2008, 28(3): 414. |
| [5] |
李霞, 罗晶, 柳小秦. 区带毛细管电泳法分离测定莨菪浸膏片中莨菪烷类生物碱[J]. 药物分析杂志, 2008, 28(1): 121. LI X, LUO J, LIU XQ. Separation and determination of tropane alkaloids in Hyoscyamus extract tablets by capillary zone electrophoresis[J]. Chin J Pharm Anal, 2008, 28(1): 121. |
| [6] |
张才煜, 吴建敏, 李憬, 等. 核磁共振法定量测定氢溴酸东莨菪碱的绝对含量[J]. 药物分析杂志, 2012, 32(2): 327. ZHANG CY, WU JM, LI J, et al. Quantitative nuclear magnetic resonance determination of the absolute content of scopolamine hydrobromide[J]. Chin J Pharm Anal, 2012, 32(2): 327. |
| [7] |
中华人民共和国药典2015年版. 二部[S]. 2015: 1710 ChP 2015. Vol Ⅱ[S]. 2015: 1710 |
| [8] |
WS-10001-(HD-0914)-2002莨菪浸膏片[S]. 2002 WS-10001-(HD-0914)-2002 Hyoscyamus Extract Tablets[S]. 2002 |
| [9] |
凌霄, 赵海云, 王国金, 等. 氢溴酸山莨菪碱注射液有关物质及含量测定研究[J]. 中国现代应用药学, 2014, 31(4): 452. LING X, ZHAO HY, WANG GJ, et al. Study on the determination and related substances of anisodamine hydrobromide injection[J]. Chin J Mod Appl Pharm, 2014, 31(4): 452. |
| [10] |
罗亚虹, 刘利敏, 刘红梅. 复方氢溴酸东莨菪碱贴膏含量测定方法[J]. 中国药师, 2014, 17(1): 170. LUO YH, LIU LM, LIU HM. Study on determination method for compound scopolamine hydrobromide adhesive plasters[J]. China Pharm, 2014, 17(1): 170. |
| [11] |
张磊, 白青山, 王亮. 复方颠茄口服溶液中硫酸阿托品含量测定及质量标准研究[J]. 药物分析杂志, 2013, 33(8): 1407. ZHANG L, BAI QS, WANG L. Content determination and quality control of compound belladonna oral solution[J]. Chin J Pharm Anal, 2013, 33(8): 1407. |
| [12] |
张文婷, 高杰, 岳超, 等. HPLC法同时测定颠茄片5个指标成分含量及特征图谱分析[J]. 药物分析杂志, 2014, 34(12): 2154. ZHANG WT, GAO J, YUE C, et al. Study on simultaneous determination of five main marker components in belladonna tablets and fingerprint analysis by HPLC[J]. Chin J Pharm Anal, 2014, 34(12): 2154. |
| [13] |
李岩, 孟庆勇, 赵欣, 等. HPLC法测定天仙子东莨菪碱和莨菪碱的含量[J]. 新疆医科大学学报, 2015, 38(1): 64. LI Y, MENG QY, ZHAO X, et al. Determination of total alkaloids from Hyoscyami Semen by HPLC[J]. J Xinjiang Med Univ, 2015, 38(1): 64. |
| [14] |
黄伟, 张文婷, 赵维良, 等. 颠茄流浸膏真伪鉴别及含量测定方法研究[J]. 药物分析杂志, 2012, 32(1): 151. HUANG W, ZHANG WT, ZHAO WL, et al. Study on identification and content determination of Extractum Belladonnae Liquidum[J]. Chin J Pharm Anal, 2012, 32(1): 151. |
 2018, Vol. 38
2018, Vol. 38 
