2. 江苏省中药高效给药系统工程技术研究中心, 南京 210023;
3. 南京老山药业有限公司, 南京 211811
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210023, China;
3. Nanjing Laoshan Pharmaceutical Co. Ltd., Nanjing 211811, China
猴菇菌Hericium erinaceus(Rull ex F.)Pers.隶属于担子菌纲红菇目猴头菌科,是一种药食兼用的腐生菌,本文所用的猴头菌为其固体培养物与菌丝发酵后的复合体。近年来的国内外研究表明[1-6],猴头菌中含有多糖、寡糖、蛋白质、腺苷、甾醇、猴头菌素、吡喃酮等多种活性成分。其中腺苷成分含量较高[7-8],具有镇静、扩血管、抗缺氧及抗炎、降胆固醇等生理活性[9-10],Le等[11]研究发现,腺苷通过人类单核细胞降低肿瘤坏死因子的释放,刺激白细胞介素-10产生而发挥有效的抗炎作用。岳显可等[12]采用HPLC法测定了猴头菇核苷类成分腺苷的含量,李洁莉等[13]通过HPLC法测得猴头菌丝体中腺苷含量为4.790 mg·g-1,同时水溶性的腺苷也有相当量存在于猴头菌药物制品中,其复方制剂中腺苷成分的含量测定也屡见报道[14-16]。相关质量控制研究报道还涉及猴头菌水溶性小分子提取物[17]、低聚糖[18]以及多糖部位[19]其他的指纹图谱,但未见对核苷部位指纹图谱的报道。本文建立了猴头菌丝固体培养物核苷类成分的HPLC指纹图谱,并同时测定猴头菌丝固体培养物中的尿苷、鸟苷和腺苷含量,为猴头菌丝固体培养物质量控制提供更加准确、有效、可靠的方法。
1 仪器与试药 1.1 仪器Waters Alliance 2695 HPLC仪(Waters公司),配Waters 2996 PDA检测器,Empower色谱工作站;SunFireTM C18色谱柱(4.6 mm×250 mm,5 μm;Waters公司);CPA225D电子天平(Sartorius公司);TGL-18C-C高速台式离心机(上海安亭科学仪器厂);KQ-500DE超声机(昆山市超声仪器有限公司);Synergy UV超纯水器(默克密理博公司)。
1.2 试药尿苷(批号110887-200202)、鸟苷(批号111977-201501)、腺苷(批号10879-200202)对照品均购自中国食品药品检定研究院;甲醇为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯;S1~S10号猴头菌丝固体培养物样品的批号分别为140113、140316、141026-1、141104-2、20141108、141122-1、141122-2、141210-2、150603、150703,均由南京老山药业股份有限公司提供。
2 方法与结果 2.1 色谱条件采用SunFireTM C18色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇(A)-水(B),梯度洗脱(0~10 min,0→2%A;10~20 min,2%A→6%A;20~30 min,6%A→15%A;30~40 min,15%A→30%A;40~55 min,30%A),流速1.0 mL·min-1,检测波长260 nm,柱温30 ℃,进样量10 μL。
2.2 溶液制备 2.2.1 混合对照品溶液精密称取尿苷、鸟苷、腺苷的对照品适量,用20%甲醇水溶解并定容,配成质量浓度分别为38.9、29.6、26.9 μg·mL-1的混合溶液,即得。
2.2.2 供试品溶液取样品粉末(过4号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入20%甲醇水25 mL,密塞,称量,超声(工作频率40 kHz,功率250 W)处理30 min,放冷,再称量,用20%甲醇水补足减失的量,摇匀,滤过,取续滤液,即得。
2.2.3 空白溶液20%甲醇水溶液。滤过,进样,记录色谱图。见图 1,阴性无干扰。
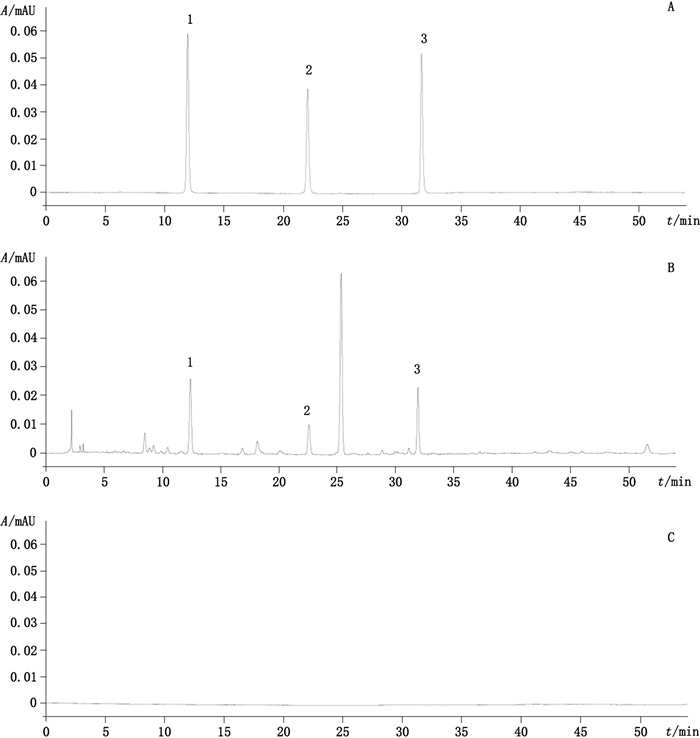
|
1.尿苷(uridine)2.鸟苷(guanosine)3.腺苷(adenosine) 图 1 混合对照品(A)、猴头菌丝固体培养物样品(B)和空白溶液(C)HPLC图 Figure 1 HPLC chromatograms of reference substances(A), solid culture of Hericium mycelium(B)and blank(C) |
取混合对照品溶液,连续进样6次,记录所测各组分峰面积,计算尿苷、鸟苷、腺苷色谱峰面积的RSD(n=6)分别为1.2%、0.44%、0.32%,表明仪器精密度良好。
2.3.2 标准曲线的制备精密量取混合对照品溶液5 mL,置10 mL量瓶中,用20%甲醇水稀释至刻度,摇匀;以此法再次2倍稀释后得系列溶液。精密吸取各浓度溶液10 μL,分别按“2.1”项下色谱条件进样测定,记录峰面积;以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。尿苷、鸟苷、腺苷3个核苷成分的回归方程分别为:
Y=22 565X-454.17 r=0.999 9
Y=20 509X+1 400.3 r=1.000 0
Y=31 111X-1 441.5 r=1.000 0
质量浓度依次在2.4~38.9、1.9~29.6、1.7~26.9 μg·mL-1范围内与峰面积呈现良好的线性关系。
2.3.3 重复性试验取同一批(批号20141108)猴头菌丝固体培养物样品(S5号样品)6份,依法制备供试品溶液,进样测定;结果尿苷、鸟苷、腺苷平均含量(n=6)分别为366.19、155.34、184.93µg·g-1,RSD分别为3.0%、1.0%、3.1%,表明方法重复性良好。
2.3.4 稳定性试验取同一批(批号20141108)猴头菌丝固体培养物样品(S5号样品)6份,依法制备供试品溶液,分别在0、2、4、8、12 h进样,测得尿苷、鸟苷、腺苷峰面积的RSD分别为1.4%、2.3%、2.9%,表明供试品溶液在12 h内稳定。
2.3.5 加样回收率试验取“2.3.3”项下已测知核苷含量的样品6份,每份约0.5 g,精密称定,精密加入尿苷、鸟苷、腺苷对照品适量,依法制备供试溶液,进样测定。尿苷、鸟苷、腺苷3个成分的回收率(n=6)分别为97.8%、98.4%、99.0%,RSD分别为1.8%、1.4%、2.4%。见表 1。
|
|
表 1 加样回收率试验(n=6) Table 1 Results of recovery tests |
取10批猴头菌丝固体培养物样品各3份,分别按“2.2.2”项下方法制备供试品溶液,并按“2.1”项下色谱条件进行测定,将峰面积带入标准曲线回归方程计算各样品中3个成分的含量,结果见表 2。
|
|
表 2 样品含量测定(µg·g-1,n=3) Table 2 Determination of the content of samples |
取10批样品,按“2.2.2”项下方法制备供试品溶液,分别进样10 μL,记录HPLC色谱图,色谱图导入国家药典委员会《中药色谱指纹图谱相似度评价系统》(2004版),生成共有模式指纹图谱,见图 2。在10批次样品的色谱图中16号色谱峰(鸟苷)的分离度良好,所有样品共有且为猴头菌丝培养物的主要成分之一,因此将其确定为参照峰(S)。各共有峰的相对保留时间与相对峰面积分别见表 3、4。
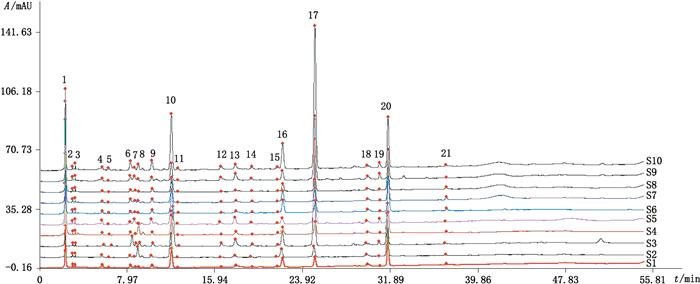
|
图 2 10批猴头菌丝体培养物指纹图谱 Figure 2 HPLC fingerprints of 10 batches of solid culture of Hericium mycelium |
|
|
表 3 10批样品各共有峰的相对保留时间 Table 3 The relative retention time of common peaks of 10 samples |
|
|
表 4 10批样品各共有峰的相对峰面积 Table 4 The relative areas of common peaks of 10 samples |
10批样品生成的对照指纹图谱,共标记了21个共有峰,经与对照品对照,指认其中3个色谱峰,10、16、20号峰依次为尿苷、鸟苷、腺苷。
2.5.3 相似度计算与评价将10批样品HPLC图与共有模式图比较,通过多点校正法对色谱峰进行自动匹配,生成猴头菌丝培养物的色谱指纹图谱共有模式,并在分析检验模式下,以批号为150603的样品(S9号样品)图谱作为参照图谱,时间窗为0.10,以平均数法进行相似度计算。与生成的对照图谱相比,10批样品指纹图谱相似度在0.932~0.992,分别为0.969、0.985、0.968、0.974、0.961、0.992、0.939、0.947、0.932、0.986。10批猴头菌丝固体培养物共有模式指纹图谱可以作为其指纹图谱,说明猴头菌丝固体培养物的核苷类成分比较稳定。
3 讨论 3.1 样品提取条件的优化考察了不同提取溶剂(水、20%甲醇水、40%甲醇水、60%甲醇水),不同提取时间(30、45、60 min),不同提取方法(超声、回流),以及不同样品用量(0.2、0.5、1.0、2 g)对提取效率的影响,结果发现,采用25 mL 20%甲醇水超声处理30 min时,猴头菌丝固体培养物色谱峰个数最多,且该条件下尿苷、鸟苷、腺苷3个成分的提取效果最佳。
3.2 色谱条件的优化通过DAD检测器对样品色谱于190~400 nm波长范围内进行检测,结果显示在260 nm波长下供试品溶液中色谱峰个数最多且基线平稳,色谱信息量大,待测色谱峰分离度良好。对比了不同的流动相(甲醇-水、甲醇-0.1%乙酸水、乙腈-水),流速(0.8、1、1.2 mL·min-1),柱温(25、30、35 ℃),进样量(5、10、15、20 μL)时色谱峰的数目及分离效果,结果发现流动相为甲醇-水,流速1 mL·min-1,柱温30 ℃,进样量10 μL时效果最优。
3.3 相似度结果分析不同批次猴头菌丝固体培养物样品相似度计算结果均大于0.93,表明其原药材各批次的指纹图谱相似度较高,各批次间成分总体差异较小,提取方法稳定,重复性好。但含量测定结果显示不同批次各成分含量存在一定差异,这种差异可能是由菌丝来源、培养基的不同等影响因素所造成的。研究表明,该方法操作性强,稳定易行,为控制和评价猴头菌丝固体培养物的内在质量提供了科学依据。
3.4 核苷类成分检测与LC-MS分析本次实验中,在相同的色谱条件下,分别用黄嘌呤、次黄嘌呤、尿苷、胸腺嘧啶、2-脱氧尿苷、肌苷、鸟苷、2-脱氧肌苷、2-脱氧鸟苷、腺苷、胸苷共11个核苷类的对照品对照本组试验中所出现的峰,分别对应出尿苷、鸟苷、腺苷这3个峰。同时将样品进行LC-MS分析,发现17号峰分子式为C13H31N5O,相对分子质量为273,但经检索未能确知为何种化合物。
| [1] |
HAN ZH, YE JM, WANG GF. Evaluation of in vivo antioxidant activity of Hericium erinaceus polysaccharides[J]. Int J Biol Macromol, 2013, 52: 66. DOI:10.1016/j.ijbiomac.2012.09.009 |
| [2] |
李巧珍, 刘朝贵, 于海龙, 等. 猴头菌不同生长发育期粗蛋白、粗多糖含量及水溶性粗多糖体外免疫活性[J]. 食用菌学报, 2011, 18(4): 73. LI QZ, LIU CG, YU HL, et al. Protein, polysaccharide and β-glucan levels in Hericium erinaceus fruit bodies harvested at different development stages and the effect of extracted polysaccharide on NO production by RAW264.7 cells[J]. Acta Edulis Fungi, 2011, 18(4): 73. |
| [3] |
周帅, 薛俊杰, 刘艳芳, 等. 高效阴离子色谱-脉冲安培检测法分析食用菌中海藻糖、甘露醇和阿糖醇[J]. 食用菌学报, 2011, 18(1): 49. ZHOU S, XUE JJ, LIU YF, et al. Determination of arabitol, trehalose and mannitol in the fruit bodies of edible fungi using high performance anion chromatography-pulsed amperometric detection(HAPEC-PAD)[J]. Acta Edulis Fungi, 2011, 18(1): 49. |
| [4] |
LI W, ZHOU W, CHA JY, et al. Sterols from Hericium erinaceum and their inhibition of TNF-alpha and NO production in lipopolysaccharide-induced RAW 264.7 cells[J]. Phytochemistry, 2015, 115: 231. DOI:10.1016/j.phytochem.2015.02.021 |
| [5] |
WANG K, BAO L, QI Q, et al. Erinacerins C-L, isoindolin-1-ones with α-glucosidase inhibitory activity from cultures of the medicinal mushroom Hericium erinaceus[J]. J Nat Prod, 2015, 78(1): 146. DOI:10.1021/np5004388 |
| [6] |
LU QQ, TIAN JM, WEI J, et al. Bioactive metabolites from the mycelia of the basidiomycete Hericium erinaceum[J]. Nat Prod Res, 2014, 28(16): 1288. DOI:10.1080/14786419.2014.898145 |
| [7] |
汤俊, 程敏, 鲁静, 等. 三种药用真菌核苷类成分的分析及含量比较[C]//2008年中国药学会学术年会暨第八届中国药师周论文集. 石家庄: 中国药学会学术会务部, 2008: 474 TANG J, CHENG M, LU J, et al. Profiling and determination of nucleosides in several medicinal fungi by HPLC method[C]//The Proceedings of 2008 Academic Annual Conference of Chinese Pharmaceutical Association and the Eighth China Pharmacists Week. Shijiazhuang: Academic Meeting Affairs Department of Chinese Pharmaceutical Association, 2008: 474 |
| [8] |
毕春洋, 李国源, 陈婷, 等. 猴头菌丝固体培养物质量标准研究[J]. 广东药学院学报, 2016, 32(6): 724. BI CY, LI GY, CHEN T, et al. Study on quality standard for Hericium erinaceus with solid culture[J]. J Guangdong Pharm Univ, 2016, 32(6): 724. |
| [9] |
郭艳艳, 李华, 刘钟栋. 猴头菌属化学成分及药理活性研究进展[J]. 农产品加工·学刊, 2010, 4(8): 77. GUO YY, LI H, LIU ZD. Phytochemical components and their pharmacological action of Hericium[J]. Acad Period Farm Prod Proce, 2010, 4(8): 77. |
| [10] |
王晓玉, 蒋秋燕, 凌沛学, 等. 猴头菌活性成分及药理作用研究进展[J]. 中国生化药物杂志, 2010, 31(1): 70. WANG XY, JIANG QY, LING PX, et al. Research progress in the effective components of Hericium erinaceus and its pharmacological actions[J]. Chin J Biochem Pharm, 2010, 31(1): 70. |
| [11] |
LE MOINE O, QUERTINMONT E, GULBIS B, et al. Blunted anti-inflammatory response to adenosine in alcoholic cirrhosis[J]. J Hepatol, 1999, 31(3): 457. DOI:10.1016/S0168-8278(99)80037-3 |
| [12] |
岳显可, 曹岗, 吴瑶, 等. HPLC法测定猴头菇核苷类成分腺苷的含量[J]. 实用药物与临床, 2015, 18(4): 432. YUE XK, CAO G, WU Y, et al. Determination of nucleosides of adenosine in Hericium erinaceus by HPLC[J]. Pract Pharm Clin Remed, 2015, 18(4): 432. |
| [13] |
李洁莉, 陆玲, 陈坤, 等. 猴头菌及其药物制品腺苷等药效成分分析[J]. 中国食用菌, 2002, 21(3): 32. LI JL, LU L, CHEN K, et al. Studies on adenosine etc.composition with medicinal effects of Hericium erinaceus and its pharmaceutical products[J]. Edible Fungi China, 2002, 21(3): 32. |
| [14] |
顾慧芬, 庄意丽, 张梦玲. HPLC法测定猴头菌片中腺苷[J]. 中成药, 2012, 34(7): 1405. GU HF, ZHUANG YL, ZHANG ML. Determination of adenosine in Houtoujun tablets by HPLC[J]. Chin Tradit Pat Med, 2012, 34(7): 1405. |
| [15] |
周静安. RP-HPLC测定复方猴头颗粒剂中腺苷的含量[J]. 中成药, 2005, 27(2): 213. ZHOU JA. Determination of adenosine in compound Houtou granules by HPLC[J]. Chin Tradit Pat Med, 2005, 27(2): 213. |
| [16] |
戚雁飞. HPLC测定复方猴头胶囊中腺苷的含量[J]. 中成药, 2002, 24(3): 181. QI YF. Determination of adenosine in compound Houtou capsules by HPLC[J]. Chin Tradit Pat Med, 2002, 24(3): 181. |
| [17] |
綦天华, 丁石博, 王再林, 等. 小刺猴头菌水溶性小分子提取物HPLC指纹图谱探讨[J]. 中国生化药物杂志, 2012, 33(1): 8. QI TH, DING SB, WANG ZL, et al. Discussion on HPLC fingerprint of water-soluble small molecule extract of Hericium caput-medusae[J]. Chin J Biochem Pharm, 2012, 33(1): 8. |
| [18] |
陈婷, 杨军辉, 李俊松, 等. 猴头菌丝固体培养物及胃乐宁片低聚糖部位的HPLC-ELSD指纹图谱[J]. 中成药, 2017, 39(6): 1211. CHEN T, YANG JH, LI JS, et al. HPLC-ELSD fingerprints of oligosaccharide sites from mycelia of Hericium erinaceum solid culture and Weilening tablets[J]. Chin Tradit Pat Med, 2017, 39(6): 1211. |
| [19] |
石博, 李雨亭, 綦天华, 等. 小刺猴头菌发酵液小分子指纹图谱与多糖含量相关性研究[J]. 菌物研究, 2012, 10(4): 244. SHI B, LI YT, QI TH, et al. Study on the correlation of small molecule fingerprints and polysaccharide content of Hericium caput-medusae fermented liquid[J]. J Fungal Res, 2012, 10(4): 244. |
 2018, Vol. 38
2018, Vol. 38 
