2. 河南中医药大学, 郑州 450008;
3. 河南省食品药品检验所, 郑州 450018
2. Henan University of Traditional Chinese Medicine, Zhengzhou 450008, China;
3. Henan Institute of Food and Drug Control, Zhengzhou 450018, China
牛膝为苋科植物牛膝(Achyranthes bidentata Bl.)的干燥根,具有逐瘀通经,补肝肾,强筋骨,利尿通淋及引血下行的功效,可用于经闭痛经,腰膝酸痛,筋骨无力,淋证水肿,头痛眩晕,牙痛口疮及吐血衄血等症[1]。作为常用大宗药材品种,牛膝临床应用广泛,在我国河南、河北、山东、山西、内蒙古、安徽等多地均有规模化种植,其中河南焦作的武陟、温县、博爱、沁阳及新乡的辉县等地区位于太行山脚下,南临黄河,北依沁河,明朝时属怀庆府地区,由于其地理位置的特殊性,牛膝种植面积大,产量高,质量优良,且因悠久的种植历史,该区域所种植的牛膝已成为道地药材品种“四大怀药”之一,蜚声海内外,成为国内牛膝的重要药材资源。牛膝中主要含有β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、旌节花甾酮和红苋甾酮等甾酮类[2-3]以及人参皂苷Ro、竹节参皂苷Ⅳa、竹节参苷Ⅴ和竹节参皂苷Ⅰ等三萜皂苷类化学成分[4],牛膝提取物药理作用报道比较广泛,主要有抗炎镇痛[5],抗肿瘤[6],促软骨修复[7],改善微循环和血液流变学[8]等作用,牛膝中三萜皂苷类成分具有抑制破骨细胞分化,保护软骨组织,促进软骨细胞增殖,抗凋亡等作用[9-11],是与牛膝强筋骨功效相关的活性物质。考虑到β-蜕皮甾酮在多种植物中均有分布[12-13],现行的《中华人民共和国药典》2015年版一部中仅以β-蜕皮甾酮作为牛膝的定量指标,专属性不强,不能准确反映怀牛膝的内在质量。本实验采用HPLC法同时测定了不同产地和等级的怀牛膝中β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮3个甾酮类成分和人参皂苷Ro、竹节参皂苷Ⅳa 2个皂苷类成分的含量,为今后更全面评价怀牛膝的质量提供科学依据。
1 仪器与试药Waters公司Waters 2695型高效液相色谱仪(配有2996二极管阵列检测器,柱温箱和Empower Ⅱ色谱工作站);Agilent公司ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶),岛津公司LIBROR-160DPT万分之一天平;Mettler公司AE240十万分之一天平;北京中兴伟业仪器有限公司恒温水浴锅;宁波新芝生物科技股份有限公司SB-5200DT超声波提取器。
对照品β-蜕皮甾酮(批号111638-201402),购自中国食品药品检定研究院;25R-牛膝甾酮(批号3736)、25S-牛膝甾酮(批号3737)、人参皂苷Ro(批号1421)及竹节参皂苷Ⅳa(批号2665),均购自上海诗丹德生物技术有限公司,纯度≥98%。16批怀牛膝药材经河南省中医药研究院都恒青研究员鉴定,均为觅科植物牛膝A.bidentata Bl.的干燥根,供试药材的来源及商品信息见表 1。
|
|
表 1 16批怀牛膝的来源及商品等级 Table 1 Habitats and commercial grades of 16 batches of Achyranthis Bidentatae Radix |
甲醇、乙腈(Fisher Chemical公司)为色谱纯,水为超纯水,其余试剂(国药集团化学试剂有限公司)均为分析纯。
2 方法与结果 2.1 色谱条件采用ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)-0.5%磷酸水溶液(B),梯度洗脱(0~18 min,17%A;18~20 min,17%A→32%A;20~64 min,32%A;64~65 min,32%A→17%A),流速1.0 mL·min-1,柱温30 ℃,检测波长250 nm(0~25 min,β-蜕皮甾酮、25R-牛膝甾酮和25S-牛膝甾酮)、203 nm(25~65 min,人参皂苷Ro和竹节参皂苷Ⅳa),进样量10 μL。
2.2 混合对照品溶液制备精密称取β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、人参皂苷Ro、竹节参皂苷Ⅳa的对照品适量,加甲醇配制成每1 mL含β-蜕皮甾酮0.109 mg,25R-牛膝甾酮39.8 μg,25S-牛膝甾酮77.4 μg,人参皂苷Ro 0.176 mg,竹节参皂苷Ⅳa 0.169 mg的混合溶液,即得。
2.3 供试品溶液制备怀牛膝供试药材粉碎,过3号筛,取约1 g,精密称定,置具塞三角瓶中,加入水饱和正丁醇30 mL,密塞,浸泡过夜,超声(功率300 W,频率40 kHz)处理30 min,滤过,用甲醇10 mL分数次洗涤容器及残渣,合并滤液和洗液,蒸干,残渣加甲醇溶解,移至5 mL量瓶中,加甲醇至刻度,摇匀,即得。
2.4 线性关系考察精密吸取“2.2”项下的混合对照品溶液2、5、10、15、20、25 μL,分别注入液相色谱仪进行测定,以峰面积Y对进样量X(μg)进行线性回归计算,回归方程、相关系数和线性范围见表 2。
|
|
表 2 回归方程、相关系数及线性范围 Table 2 Regression equations, correlation coefficients and linear ranges |
精密吸取“2.2”项下的混合对照品溶液10 μL,连续重复进样6次,测定峰面积并计算RSD;结果β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、人参皂苷Ro和竹节参皂苷Ⅳa峰面积的RSD分别为0.95%、1.2%、0.88%、2.9%和1.4%,表明仪器精密度较好。
2.6 稳定性试验取同一供试品溶液,分别于0、2、4、6、8、10、12 h注入液相色谱仪,测定各待测成分的峰面积并计算RSD;结果β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、人参皂苷Ro和竹节参皂苷Ⅳa峰面积的RSD分别为1.3%、1.2%、1.3%、2.4%和2.5%,表明供试品溶液中5个待测成分室温放置12 h内基本稳定。
2.7 重复性试验精密称取12号怀牛膝样品,按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进行测定。β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、人参皂苷Ro和竹节参皂苷Ⅳa的平均含量分别为0.061%、0.013%、0.014%、0.077%和0.057%,RSD分别为2.0%、1.7%、2.2%、2.1%和2.9%。
2.8 加样回收率试验精密称取已测知含量的12号怀牛膝药材粉末约0.5 g,置具塞三角瓶中,精密加入用水饱和正丁醇配制的混合对照品溶液(β-蜕皮甾酮69.0 μg·mL-1,25R-牛膝甾酮13.4 μg·mL-1,25S-牛膝甾酮12.6 μg·mL-1,人参皂苷Ro 82.0 μg·mL-1,竹节参皂苷Ⅳa 58.6 μg·mL-1)5 mL和水饱和正丁醇25 mL,按“2.3”项下方法制备加样供试溶液,测定并计算加样回收率,结果见表 3。
|
|
表 3 加样回收率测定结果(n=6) Table 3 Results of recovery tests |
取16个不同产地、不同等级、不同采收时间的怀牛膝样品,按“2.3”项下方法制备供试品溶液,按照“2.1”项下条件测定,外标法计算含量,结果见表 4,对照品和样品的色谱图见图 1。
|
|
表 4 16批怀牛膝样品含量测定结果(%,n=3) Table 4 Results of content determination of 16 batches of Achyranthis Bidentatae Radix |
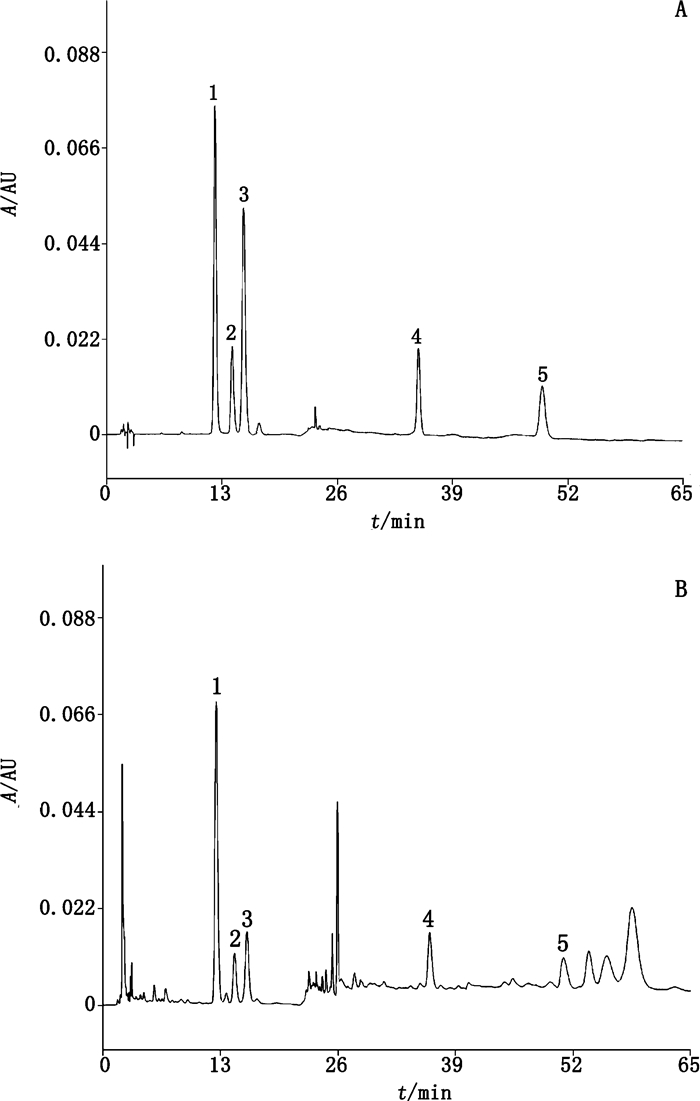
|
1. β-蜕皮甾酮(β-ecdysterone)2. 25R-牛膝甾酮(25R-inokosterone)3. 25S-牛膝甾酮(25S-inokosterone)4.人参皂苷Ro(ginsenoside Ro)5.竹节参皂苷Ⅳa(chikusetsusaponin Ⅳa) 图 1 混合对照品(A)与12号样品(B)的HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A)and sample No.12(B) |
在实验中,根据参考文献[14-16],比较了甲醇-水、甲醇-0.2%磷酸水溶液、乙腈-水、乙腈-0.2%磷酸水溶液、乙腈-0.5%磷酸水溶液等多种流动相洗脱条件下待测成分的分离情况。结果按本文确定的流动相,5个待测成分色谱峰保留时间适宜,峰形对称,与相邻峰分离度较好。
3.2 检测波长的选择在实验中,对5个待测成分进行了紫外光谱扫描,均在强吸收波长下进行测定,有效地提高了测定的灵敏度。本方法应用色谱工作站的定时波长功能,0~25 min检测波长设定为250 nm,用于检测β-蜕皮甾酮、25R-牛膝甾酮和25S-牛膝甾酮;25~65 min检测波长设定为203 nm,用于检测人参皂苷Ro和竹节参皂苷Ⅳa。
3.3 供试品溶液制备方法的选择根据待测成分的理化性质,比较了不同溶剂(甲醇、水饱和正丁醇)、及不同提取方式(加热回流、超声提取)及不同提取时间(15、30、60 min)制备的供试品溶液中5个成分的含量。结果,分别以甲醇和水饱和正丁醇为溶剂,试用加热回流和超声提取,提取30 min和60 min制得的供试品溶液中待测成分含量无显著差异。结合《中华人民共和国药典》2015年版一部牛膝项下有关规定,采用与药典一致的方法,即药材加水饱和正丁醇浸泡过夜,超声提取30 min制备供试品溶液。
3.4 小结本试验对不同产地、不同等级、不同采收时间的16批怀牛膝样品进行3个甾酮类和2个三萜皂苷类成分的含量测定。结果显示,16批怀牛膝样品中β-蜕皮甾酮的含量均符合《中华人民共和国药典》不得低于0.030%的有关规定。
同时,从收集到的样品的测定结果来看,β-蜕皮甾酮含量与25R-牛膝甾酮和25S-牛膝甾酮含量可能存在一定的正相关性,但人参皂苷Ro、竹节参皂苷Ⅳa含量与甾酮类成分的含量之间是否存在相关性则未见明显规律,牛膝中5个成分的含量与不同商品等级、不同产地间是否存在相关性,有待今后收集更多的样品进行实验比较。
本文采用HPLC法建立了同时测定怀牛膝中β-蜕皮甾酮、25R-牛膝甾酮、25S-牛膝甾酮、人参皂苷Ro和竹节参皂苷Ⅳa含量的方法,由测定结果可知,怀牛膝中所含除β-蜕皮甾酮外的另2个甾酮类成分和2个皂苷类成分的量并不低,仅以β-蜕皮甾酮作为定量指标不够科学,进行多种指标成分的含量测定将有助于更全面、更科学地评价牛膝的内在质量。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 72 ChP 2015. Vol Ⅰ[S]. 2015: 72 |
| [2] |
陈幸, 黎万寿, 朱久武, 等. RP-HPLC法测定川牛膝中杯苋甾酮的含量[J]. 药物分析杂志, 2000, 20(4): 234. CHEN X, LI WS, ZHU JW, et al. RP-HPLC determination of casterone in Radix Cyathulae[J]. Chin J Pharm Anal, 2000, 20(4): 234. |
| [3] |
张元昊. 植物生长物质对牛膝生长及主要药用成分积累的影响[D]. 新乡: 河南师范大学, 2015 ZHANG YH. Effect of Plant Growth Substance on Growth and Major Medicinal Components Accumulation of Achyranthes bidentata Blume[D]. Xinxiang: Henan Normal University, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10476-1015444545.htm |
| [4] |
贾淑萍, 俞智勇, 郝志芳, 等. 怀牛膝根成分的分离与鉴定[J]. 中国中药杂志, 2006, 31(15): 1244. JIA SP, YU ZY, HAO ZF, et al. Isolation and identification of triterpenoids from root of Achyranthes bidentata in Henan[J]. China J Chin Mater Med, 2006, 31(15): 1244. DOI:10.3321/j.issn:1001-5302.2006.15.009 |
| [5] |
陆兔林, 毛春芹, 张丽, 等. 牛膝不同炮制品镇痛抗炎作用研究[J]. 中药材, 1997, 20(10): 507. LU TL, MAO CQ, ZHANG L, et al. The research on analgestic and anti-inflammatory action of different processed products of Achyranthes bidentata[J]. J Chin Med Mater, 1997, 20(10): 507. |
| [6] |
胡洁, 齐义新, 李巧霞, 等. 中药牛膝提取物抗肿瘤活性的初步研究[J]. 中华微生物学和免疫学杂志, 2005, 25(5): 415. HU J, QI YX, LI QX, et al. The research of extract of Achyranthes bidentata Blume's anti-tumor activity[J]. Chin J Microbiol Immunol, 2005, 25(5): 415. |
| [7] |
于大永, 吕晓超, 史丽颖, 等. 牛膝中三萜皂苷抑制破骨细胞分化作用的研究[J]. 中国中医骨伤科杂志, 2011, 19(3): 9. YU DY, LÜ XC, SHI LY, et al. Inhibitory effect of triterpenoidal saponins from Achyranthes bidentata Bl.on osteoclast differentiation[J]. Chin J Tradit Med Traum Orthp, 2011, 19(3): 9. |
| [8] |
陈红, 石圣洪. 中药川、怀牛膝对小鼠微循环及大鼠血液流变学的影响[J]. 中国微循环, 1998, 2(3): 182. CHEN H, SHI SH. Effects of Chinese herbal medicine and Achyranthes bidentata Blume on microcirculation and hemorheology in rats[J]. J Chin Microcirc, 1998, 2(3): 182. |
| [9] |
刘渊, 孙雪莲, 周红海, 等. 牛膝总皂苷含药血清对兔膝软骨细胞增殖与凋亡的实验研究[J]. 时珍国医国药, 2015, 26(10): 2382. LIU Y, SUN XL, ZHOU HH, et al. Experimental study on the proliferation and apoptosis of rabbit knee chondrocytes cultured with serum containing Achyranthes bidentata saponins[J]. Lishizhen Med Mater Med Res, 2015, 26(10): 2382. |
| [10] |
孙雪莲, 刘渊, 周红海. 牛膝总皂苷对兔膝骨关节炎软骨组织形态变化及关节液中IL-1β、TGF-β1含量的影响[J]. 中药新药与临床药理, 2016, 27(3): 321. SUN XL, LIU Y, ZHOU HH. Effect of total saponins of Achyranthes on knee osteoarthritis rabbit cartilage histomorphology and contents of IL-1β and TGF-β1 in synovial fluid[J]. Tradit Chin Drug Res Clin Pharmacol, 2016, 27(3): 321. |
| [11] |
李成付, 王玖忠, 边瑜健, 等. 牛膝醇提物促进兔骨关节炎软骨修复的作用及其机制的实验研究[J]. 中国临床研究, 2015, 28(7): 844. LI CF, WANG JZ, BIAN YJ, et al. Experimental study on the role of promoting chondral renovation of alcohol extracts of Achyranthis Bidentatae in rabbits with osteoarthritis and its mechanism[J]. Chin J Clin Res, 2015, 28(7): 844. |
| [12] |
孙宇, 卿德刚, 张娟, 等. 鹿草根中β-蜕皮甾酮的含量测定[J]. 药物分析杂志, 2012, 32(9): 1614. SUN Y, QING DG, ZHANG J, et al. Determination of β-ecdysone in the root of Stemmacantha carthamoides(Willd.)Dittrich[J]. Chin J Pharm Anal, 2012, 32(9): 1614. |
| [13] |
李肇进, 张蕴. 漏芦总甾酮质量标准研究[J]. 中药材, 2008, 31(7): 1088. LI ZJ, ZHANG Y. Study on quality standard of total steroidal ketone in Rhapontici Radix[J]. J Chin Med Mater, 2008, 31(7): 1088. |
| [14] |
张留记, 张格艳, 屠万倩. HPLC法同时测定牛膝中β-蜕皮甾酮和竹节参皂苷-1[J]. 中成药, 2013, 35(5): 1010. ZHANG LJ, ZHANG GY, TU WQ. Simultaneous determination of β-ecdysterone and chikusetsusaponin-1 in Achyranthes bidentata Bl.by HPLC[J]. Chin Tradit Pat Med, 2013, 35(5): 1010. |
| [15] |
杨柳, 张颖, 刘季田媛, 等. 牛膝各化学拆分组分指纹图谱研究[J]. 中医药信息, 2015, 32(6): 16. YANG L, ZHANG Y, LIUJI TY, et al. Fingerprint study of split fractions of Radix Achyranthis Bidentatae[J]. Inf Tradit Chin Med, 2015, 32(6): 16. |
| [16] |
赵变, 杨俊涛, 王丹. 牛膝配方颗粒中蜕皮甾酮的含量测定[J]. 中国中医药现代远程教育, 2014, 12(11): 147. ZHAO B, YANG JT, WANG D. Determination of ecdysterone in dispensing granule of Achyranthes bientata Bl.from different pharmaceutical factories[J]. Chin Med Mod Dis Educ China, 2014, 12(11): 147. DOI:10.3969/j.issn.1672-2779.2014.11.093 |
 2018, Vol. 38
2018, Vol. 38 
