2. 江苏省中药资源产业化过程协同创新中心, 南京 210023;
3. 中药资源产业化与方剂创新药物国家地方联合工程研究中心, 南京 210023
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China;
3. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing 210023, China
牡丹皮为毛茛科植物牡丹(Paeonia suffruticosa Andr.)的干燥根皮,性苦、辛,微寒,有清热凉血及活血化瘀之效[1]。目前已从牡丹皮中鉴定出的化学成分有50多个[2],Xu等[3]曾采用HPLC-DAD/ESI-MS2技术鉴定出了17个单萜苷类成分、14个没食子酸糖苷类成分、5个酚酸类成分、3个黄酮类成分、1个三萜类成分,He等[4]采用HPLC-DAD-ESI/MS2技术对牡丹皮进行质量评价,共指认出了19个共有峰成分,并对5个成分进行了定量测定。关于牡丹皮的质控方法大多选择丹皮酚、芍药苷及没食子酸等少数几个指标性成分[5-8],中药材的药效是内部所有化学成分综合作用的结果,因此单一或少数几个指标性成分无法代表中药材的总体质量。近年来,超高效液相色谱(UPLC)串联三重四极杆质谱(TQ-MS)因具有分离速度快,灵敏度高,准确性强的特点,被广泛应用于中药材的分析中[9-10],故本文建立了基于UPLC-TQ-MS方法的多指标综合评价牡丹皮药材质量的方法,以期为牡丹皮药材及其成药的质量控制提供依据。
1 仪器与试药Waters公司ACQUITY UPLC系统(二元高压泵,自动进样器,柱温箱,二极管阵列检测器);Waters公司Xevo TQ/MS质谱系统;Waters公司MassLynxTM质谱工作站;梅特勒-托尼多仪器有限公司ML204电子分析天平(1/10万),MS105电子分析天平(1/1万);Millipore公司Millipore Q纯水系统;昆山禾创超声仪器有限公司KQ-250E型超声波清洗器;上海安亭科学仪器厂Anke GL-16GⅡ型离心机。
对照品丹皮酚(批号DPF20160828)、没食子酸(批号MSZS20140901)、芍药苷(批号SYG20160108)、五没食子酰葡萄糖(批号QMTT20160811)、没食子酸甲酯(批号MSJZ20161013)、苯甲酰芍药苷(批号BJYG20161011)、三没食子酰葡萄糖(批号SMTT20161213)、没食子酰芍药苷(批号MSYG20160601)、氧化芍药苷(批号YHYG20151121)、芍药苷元(批号SYGY20160313)、香草乙酮(批号XCYT20161102)、儿茶素(批号ECS20160315)、对羟基苯甲酸(批号DQJS20141212)、6-羟基香豆素(批号QJDS20160921)、牡丹皮苷C(批号MDGC20151211)、丹皮酚原苷(批号DPYG20161220)、槲皮素(批号HPS20160618)、芍药苷亚硫酸酯(批号160703)均购自南京春秋生物工程有限公司,纯度均≥98%;甲醇(南京化学试剂有限公司)为分析纯,乙腈(Merck公司)及甲酸(ACS公司)均为色谱纯,超纯水由Milli-Q纯水机制备。
牡丹皮药材购于安徽亳州康美中药城,经南京中医药大学段金廒教授鉴定为毛茛科植物牡丹(Paeonia suffruticosa Andr.)的干燥根皮,共采集了20批样品,编号S1~S20;其中S1~S10为硫熏样品,S11~S20为未硫熏样品,凭证标本存放于江苏省中药资源产业化过程协同创新中心。
2 方法与结果 2.1 混合对照品工作液的制备分别精密称取丹皮酚、没食子酸、芍药苷、五没食子酰葡萄糖、没食子酸甲酯、苯甲酰芍药苷、三没食子酰葡萄糖、没食子酰芍药苷、氧化芍药苷、芍药苷元、香草乙酮、儿茶素、对羟基苯甲酸、6-羟基香豆素、牡丹皮苷C、丹皮酚原苷、槲皮素、芍药苷亚硫酸酯的的对照品适量,以甲醇溶解并定容制成各对照品储备液。精密量取各成分对照品储备液适量,置于同一量瓶中,制成混合对照品溶液,其中上述各成分的质量浓度分别为129.4、122.2、121.4、99.4、179.4、110.6、100.6、100.7、95.6、111.1、100.0、109.1、125.7、120.3、63.6、72.4、91.6和123.9 μg·mL-1。并将上述混合对照品溶液用甲醇稀释成6份不同浓度(稀释2、10、20、100、200、1 000倍)的混合对照品工作液。
2.2 供试品溶液的制备取牡丹皮药材粉末(过4号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,超声处理(功率250 W,频率33 kHz)45 min,放至室温,称定质量,用甲醇补足减失的的质量,摇匀,13 000 r·min-1离心10 min,取上清液,过0.22 μm微孔滤膜,即得。
2.3 色谱及质谱条件色谱分析条件:采用Waters Acquity UPLC HSS BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),以0.1%甲酸水溶液(A)-乙腈(B)为流动相,梯度洗脱(0~5 min,95%A→90%A;5~7 min,90%A→75%A;7~10 min,75%A→50%A;10~15 min,50%A→5%A),流速0.4 mL·min-1,柱温35 ℃,进样量3 μL。进样前以流动相梯度初始条件平衡5 min。
质谱检测条件:ESI源;扫描方式为ESI+、ESI-模式;多反应监测(MRM);毛细管电压3 kV,锥孔电压20 V,萃取电压3 V,离子源温度150 ℃,脱溶剂气温度400 ℃,锥孔气流量50 L·h-1,脱溶剂气流量1 000 L· h-1,辅助气流0.15 mL·min-1;各待测成分的质谱参数见表 1,色谱图见图 1。
|
|
表 1 待测成分MRM参数 Table 1 MRM parameters of the component to be tested |
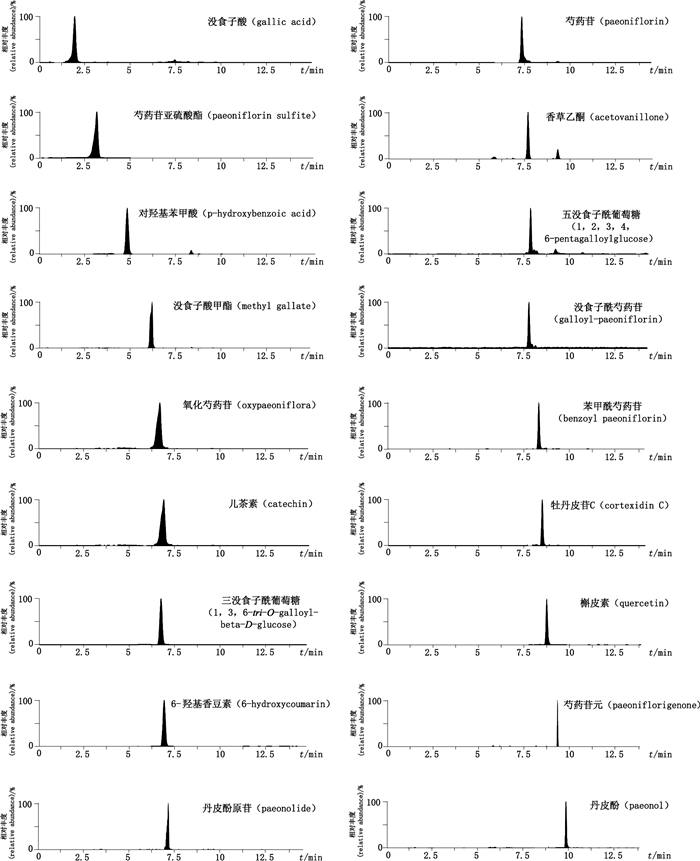
|
图 1 样品中各待测成分MRM色谱图 Figure 1 MRM chromatogram of each analyte in the sample |
精密量取“2.1”项下系列混合对照品工作液3 μL,按“2.3”项下的分析条件进行测定。以被测化合物质量浓度X为横坐标,相应峰面积Y为纵坐标,进行线性回归,并按信噪比(S/N)为10和3分别计算被测成分的定量下限(LOQ)和检测下限(LOD)。结果见表 2,各成分线性良好,r2值均在0.992 3以上。
|
|
表 2 回归方程、线性范围、检测下限与定量下限 Table 2 Regression equation, linear range, LOD and LOQ |
取中浓度(稀释20倍)混合对照品工作液,在上述色谱条件下连续进行6次以测定待测成分的峰面积,以各指标成分峰面积的RSD评价精密度。结果见表 3。
|
|
表 3 方法学考察 Table 3 Methodological study |
取S1号样品6份,按照“2.2”项下方法制备供试品溶液,分别进样分析,计算各成分的含量,以含量的RSD评价重复性,结果见表 3。
2.4.4 稳定性试验取S1号样品,按照“2.2”项下方法制备供试品溶液,分别于制备后0、2、4、8、12、24 h进样测定,以样品中各指标成分峰面积计算RSD,结果见表 3。
2.4.5 加样回收率试验取0.5 g已知含量的S1号样品6份,每份精密称定,加入与样品中各成分含量相近的各对照品,按照“2.2”项下方法制备供试品溶液并按上述条件测定,计算平均回收率和RSD。结果见表 3。
3 结果与分析 3.1 测定结果各样品按照“2.2”项下的方法制得供试品溶液,并按“2.3”项条件下进行测定,结果见表 4。
|
|
表 4 不同批次牡丹皮样品中待测成分的含量(mg·g-1,n=3) Table 4 The content of the substance in different batches of Cortex Moutan |
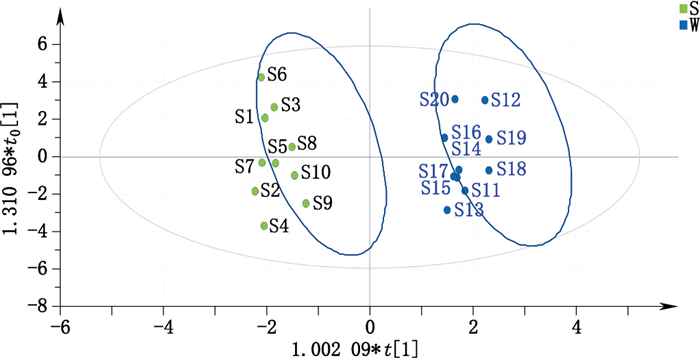
将20批次牡丹皮样品中18个化学成分含量数据生成二维数据矩阵,经UV标准化处理后导入SIMCA-P+13.0(Umetrics AB,Umea,瑞典)软件,利用正交偏最小二乘判别分析(OPLS-DA)建立分析模型。
绘制OPLS-DA得分图,如图 2,该图表明20批牡丹皮样品被t[2]轴明显区分为22个区域,且恰好分为硫熏(S)与未硫熏(W)2组,初步显示硫熏加工会导致牡丹皮内在化学成分发生较大的变化。
|
W.未硫熏(not sulfur smoked)S.硫熏(sulfur smoked) 图 2 OPLS-DA得分图 Figure 2 Score plot of OPLS-DA |
VIP值是OPLS-DA中评价变量对分类的贡献所常用的方法,一般认为VIP > 1的变量为组间的特征性成分,具有统计学意义[11]。以7倍交叉验证(7-fold cross validation)得到的评价模型的参数解释率(R2Y)为97.2%,模型预测率(Q2)为93.2%,并以此为标准,结合VIP图(图 3),筛选出对硫熏样品与未硫熏样品分组贡献较大的差异性成分。图 3显示,芍药苷亚硫酸酯、槲皮素、儿茶素、氧化芍药苷、没食子酸、没食子酸甲酯的VIP值> 1,说明牡丹皮药材经硫后上述几个化学成分的含量存在显著差异。
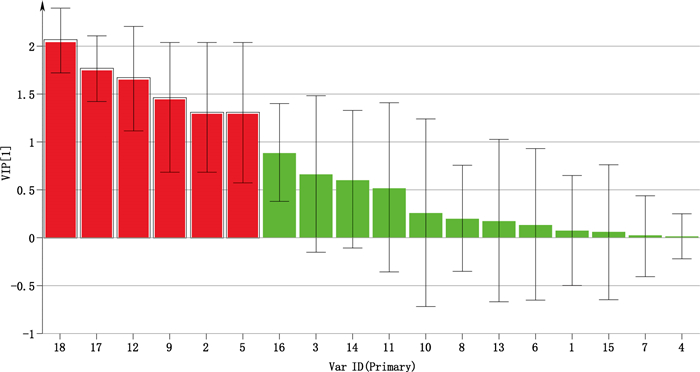
|
1.丹皮酚(paeonol)2.没食子酸(gallic acid)3.芍药苷(paeoniflorin)4.五没食子酰葡萄糖(1, 2, 3, 4, 6-pentagalloylglucose)5.没食子酸甲酯(methyl gallate)6.苯甲酰芍药苷(benzoyl paeoniflorin)7.三没食子酰葡萄糖(1, 3, 6-tri-O-galloyl-beta-D-glucose)8.没食子酰芍药苷(galloyl-paeoniflorin)9.氧化芍药苷(oxypaeoniflora)10.芍药苷元(paeoniflorigenone)11.香草乙酮(acetovanillone)12.儿茶素(catechin)13.对羟基苯甲酸(p-hydroxybenzoic acid)14. 6-羟基香豆素(6-hydroxycoumarin)15.牡丹皮苷C(cortexidin C)16.丹皮酚原苷(paeonolide)17.槲皮素(quercetin)18.芍药苷亚硫酸酯(paeoniflorin sulfite) 图 3 牡丹皮中18个化学成分VIP图 Figure 3 VIP values of 18 constituents in Cortex Moutan |
本研究曾尝试采用水蒸气蒸馏提取法和超声提取法2种方法制备供试品溶液,并分别考察了不同提取时间对测定结果的影响。结果表明用超声提取法,提取有效成分更加完全,且杂质含量较少。
4.2 讨论近年来,大量文献报道称,硫熏会导致药材内部化学成分发生改变[12-15],并残留一定量的二氧化硫以及含硫衍生物,存在安全隐患,李秀杨等采用UPLC-QTOF-MS/MS技术推测牡丹皮硫熏后产生特征性含硫成分芍药苷亚硫酸酯[16]。结合本研究测定结果,芍药苷亚硫酸酯在硫熏前后含量变化最为显著,因此本研究建议将芍药苷亚硫酸酯列为牡丹皮药材硫熏质控指标。
除此之外,牡丹皮经硫熏后,槲皮素、儿茶素、没食子酸含量显著升高,氧化芍药苷、没食子酸甲酯的含量显著降低;其中,槲皮素、儿茶素为黄酮类成分,在牡丹皮中含量较低,不是主要活性成分;没食子酸为有机酸,具有抗氧化、抗炎等药理活性,是牡丹皮中研究较广泛的化学成分之一;氧化芍药苷与没食子酸甲酯的含量也相对较低,且少见其药理活性的报道。
4.3 小结本研究利用UPLC-TQ-MS串联技术对牡丹皮药材中18个化学成分的含量进行测定分析,建立了一种全面、科学的测定方法,为综合评价牡丹皮药材质量提供切实可靠的参考;经OPLS-DA变量统计分析,指认出牡丹皮硫熏前后含量差异显著的6个指标性成分(芍药苷亚硫酸酯、槲皮素、儿茶素、氧化芍药苷、没食子酸、没食子酸甲酯),为牡丹皮药材质量控制提供依据。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 172 ChP 2015. Vol Ⅰ[S]. 2015: 172 |
| [2] |
王祝举, 唐力英, 赫炎. 牡丹皮的化学成分和药理作用[J]. 现代药物与临床, 2006, 21(4): 155. WANG ZJ, TANG LY, HE Y. Chemical constituents and pharmacological actions of Cortex Moutan[J]. Drugs Clin, 2006, 21(4): 155. |
| [3] |
XU SJ, YANG L, ZENG X, et al. Characterization of compounds in the Chinese herbal drug Mu-Dan-Pi by liquid chromatography coupled with electrospray ionization mass spectrometry[J]. Rapid Commum Mass Spectrom, 2006, 20(22): 3275. DOI:10.1002/(ISSN)1097-0231 |
| [4] |
HE Q, GE ZW, SONG Y, et al. Quality evaluation of Cortex Moutan by high performance liquid chromatography coupled with diode array detector and electrospray ionization tandem mass spectrometry[J]. Chem Pharm Bull, 2006, 54(9): 1271. DOI:10.1248/cpb.54.1271 |
| [5] |
范旭航, 马天成, 沈旭, 等. UPLC法测定不同产地不同部位牡丹皮中6种活性成分[J]. 中成药, 2012, 34(2): 317. FAN XH, MA TC, SHEN X, et al. UPLC determination of six active components in different parts of Moutan Cortex from different habitats[J]. Chin Tradit Pat Med, 2012, 34(2): 317. |
| [6] |
杨名宇, 邓桂明, 张志国, 等. 牡丹皮药材及饮片中丹皮酚的动态变化[J]. 医药导报, 2011, 30(10): 1355. YANG MY, DENG GM, ZHANG ZG, et al. Dynamic changes of paeonol in Cortex Moutan and herbal medicine pieces[J]. Her Med, 2011, 30(10): 1355. DOI:10.3870/yydb.2011.10.036 |
| [7] |
杨晨, 方成武, 韩燕全, 等. HPLC测定不同产地不同采收期牡丹皮中丹皮酚的含量[J]. 中国当代医药, 2010, 17(5): 5. YANG C, FANG CW, HAN YQ, et al. HPLC determination of paeonol in Cortex Moutan at different harvesting stages[J]. China Mod Med, 2010, 17(5): 5. |
| [8] |
胡云飞, 裴月梅, 吴虹, 等. 基于UPLC-Q-TOF-MS技术研究不同产地牡丹皮药材化学成分的差异[J]. 中草药, 2016, 47(17): 2984. HU YF, PEI YM, WU H, et al. Difference analysis of chemical constituents in Moutan Cortex from different origins by UPLC-Q-TOF-MS[J]. Chin Tradit Herb Drugs, 2016, 47(17): 2984. DOI:10.7501/j.issn.0253-2670.2016.17.005 |
| [9] |
刘杰, 许文, 李煌, 等. UPLC-MS/MS法同时测定白芍饮片中10种成分[J]. 药物分析杂志, 2015, 35(4): 635. LIU J, XU W, LI H, et al. Simultaneous determination of ten components in Radix Paeoniae Alba pieces by UPLC-MS/MS[J]. Chin J Pharm Anal, 2015, 35(4): 635. |
| [10] |
董乙文, 李天雪, 褚朝森, 等. UPLC-MS/MS法同时定量测定补中益气丸中的15种化合物[J]. 药物分析杂志, 2017, 37(7): 1228. DONG YW, LI TX, CHU CS, et al. UPLC-MS/MS method for simultaneous determination of 15 components in Buzhong Yiqi pills[J]. Chin J Pharm Anal, 2017, 37(7): 1228. |
| [11] |
严辉, 段金廒, 钱大玮, 等. 我国不同产地的当归药材质量的分析与评价[J]. 中草药, 2009, 40(12): 1988. YAN H, DUAN JA, QIAN DW, et al. Analysis and evaluation on the quality of Angelica sinensis from different areas[J]. Chin Tradit Herb Drugs, 2009, 40(12): 1988. |
| [12] |
李友连, 王珊, 朱晶晶, 等. 硫磺熏蒸对亳菊化学成分的影响[J]. 中国中药杂志, 2015, 40(13): 2624. LI YL, WANG S, ZHU JJ, et al. Study on effects of sulfur fumigation on chemical constituents of Chrysanthemum morifolium cv.Boju[J]. China J Chin Mater Med, 2015, 40(13): 2624. |
| [13] |
黄山君, 王瑞, 石燕红, 等. 硫磺熏制白芍的安全性评价初步研究[J]. 药学学报, 2012, 47(4): 486. HUANG SJ, WANG R, SHI YH, et al. Primary safety evaluation of sulfated Paeoniae Radix Alba[J]. Acta Pharm Sin, 2012, 47(4): 486. |
| [14] |
WANG Q, LIU RX, GUO HZ, et al. Study on influence of processing methods on chemical constituents in Radix Paeoniae Alba[J]. China J Chin Mater Med, 2006, 31(17): 1418. |
| [15] |
孟祥松, 刘文苹, 李军, 等. 硫磺熏蒸时间对白芍中芍药苷含量影响[J]. 安徽医药, 2012, 14(11): 1278. MENG XS, LIU WP, LI J, et al. Effects on paeoniflorin concentration of Radix Paeoniae Alba with different sulfuring time[J]. Anhui Med Pharm J, 2012, 14(11): 1278. |
| [16] |
李秀杨, 段素敏, 刘欢欢, 等. 特征含硫衍生物对硫熏牡丹皮检控的意义[J]. 药学学报, 2016, 51(6): 972. LI XY, DUAN SM, LIU HH, et al. Sulfur-containing derivatives as characteristic chemical markers in control of sulfur-fumigated Moutan Cortex[J]. Acta Pharm Sin, 2016, 51(6): 972. |
 2018, Vol. 38
2018, Vol. 38 
