2. 河北楚风中药饮片有限公司, 安国 071200;
3. 上海中医药大学附属龙华医院, 上海 200032
2. Hebei Chufeng Chinese Herbal Medicine Co. Ltd., Anguo 071200, China;
3. Longhua Hospital Affiliated to Shanghai Univesity of TCM, Shanghai 200032, China
苍术是菊科植物茅苍术 Atractylodes lancea(Thunb.)DC.和北苍术 Atractylodes chinensis(DC.)Koidz.的干燥根茎,两者被同时作为苍术基源[1]。茅苍术别名南苍术,主产于江苏、湖北等地,野生资源稀少,目前在湖北英山具有规模化种植基地[2]。北苍术一般为野生资源,分布于河北、吉林、内蒙古等地区[3]。关苍术为菊科植物关苍术 Atractylodes japonica Koidz. ex Kitam.,收录于日本药局方,分布于黑龙江、吉林等地区及北朝鲜,含有较高的白术内酯Ⅱ,而不含或几乎不含苍术素[3],未被《中华人民共和国药典》(2015年版)收载。
苍术化学成分主要为挥发油,包括β-桉叶醇、茅术醇、白术内酯Ⅰ、苍术酮等倍半萜类及倍半萜内酯类,苍术素、苍术素醇等聚炔类成分等。其中苍术素为《中华人民共和国药典》(2015年版)规定的苍术指标性成分。苍术具有促进胃肠运动,抗溃疡,抗炎,抑菌,降血糖,抗心律失常,抗肿瘤等药理作用[3-5]。
苍术资源分布广泛,不同产地、不同地理环境下的苍术化学成分含量差异明显,对苍术药材的质量控制造成一定困难。而通过外观形态难以区分苍术的种及质量优劣,导致药材混杂的现象较为普遍[6-7]。因此,开展对苍术质量控制和品质评价研究具有重要意义。本文以40批苍术药材为研究对象,采用高效液相色谱法对药材中的7个主要成分(白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮)进行定量分析,并结合主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least square discrimination analysis,OPLS-DA)的方法对定量结果进行统计分析,对茅苍术、北苍术和关苍术进行分类并寻找潜在的差异性成分,对苍术药材质量进行综合评价,以期为苍术药材的质量控制与评价提供科学依据[7-8]。
1 仪器与试药Agilent 1260型高效液相色谱仪(Agilent公司),AL104电子天平(梅特勒公司),DL-120D智能超声波清洗器(上海之信仪器有限公司),5424R冷冻离心机(Eppendorf公司),Research plus移液枪(Eppendorf公司),Milli-Q超纯水机(Millipore公司)。
甲醇为色谱纯,磷酸等试剂均为分析纯,均购于国药集团有限公司。
对照品白术内酯Ⅲ(HPLC测定含量≥98%,批号ZM0311BD13)、白术内酯Ⅱ(HPLC测定含量≥98%,批号PA0808RA13)、白术内酯Ⅰ(HPLC测定含量≥98%,批号Z20J7B16421)、苍术素(HPLC测定含量≥98%,批号Z27M7S15379)、β-桉叶醇(HPLC测定含量≥98%,批号P27A7F20168)、苍术酮(HPLC测定含量≥98%,批号P06A8F33355)均购自上海源叶生物科技有限公司,(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯(HPLC测定含量≥98%,批号17-2003)购自上海中药标准化研究中心。
11批茅苍术药材(1~11号样品)收集于湖北英山、随州等地,21批北苍术药材(12~32号样品)收集于内蒙、辽宁、山西、河北等地,8批关苍术药材(33~40号样品)收集于吉林、朝鲜等地,药材经上海中医药大学中药学院赵志礼教授鉴定。
2 方法与结果 2.1 溶液制备 2.1.1 对照品储备液精密称取白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮的对照品适量,分别置于棕色量瓶中,用甲醇定容至刻度,摇匀,分别配制成质量浓度为1.035、2.01、2.205、2.058、1.28、3.02、3.74 mg·mL-1的溶液,即得。
2.1.2 供试品溶液取苍术样品粉末(过60目筛)约1.0 g,精密称定,置于50 mL具塞锥形瓶中,精密加入90%甲醇水25 mL,密塞,称定质量,超声(功率250 W,频率40 kHz)提取45 min,放冷,再次称定质量,加甲醇补足减失的质量,摇匀,滤过,取续滤液过0.45 μm微孔滤膜,即得。
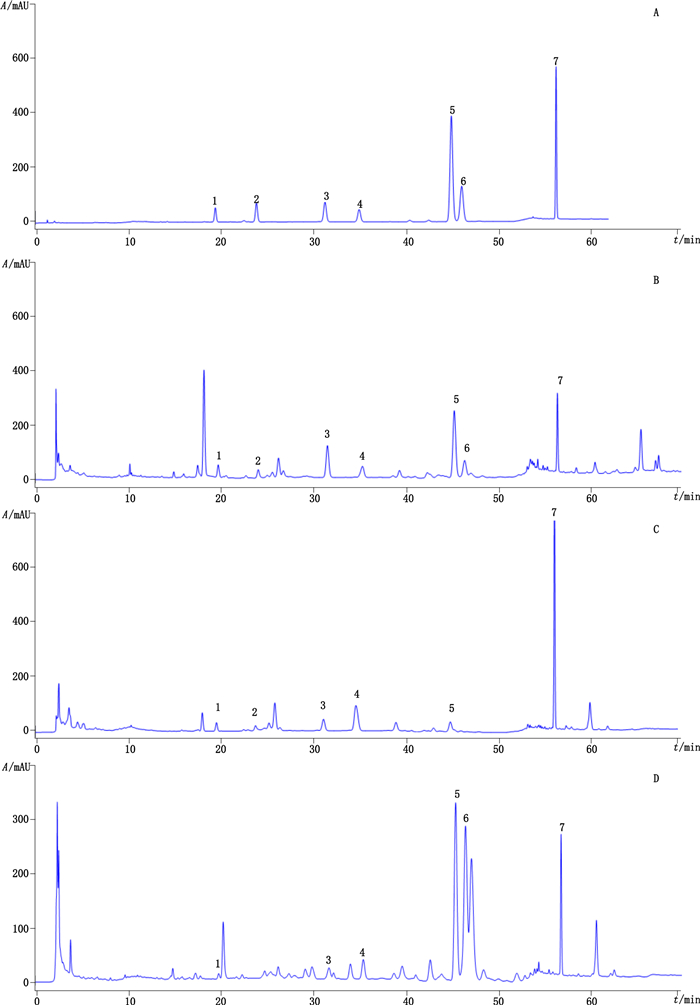
2.2 色谱条件采用资生堂CAPCELL PAK C18色谱柱(4.6 mm×250 mm,5 μm),以0.1%磷酸水溶液(A)-甲醇(B)为流动相,梯度洗脱(0~5 min,45%B→55%B;5~7 min,55%B→68%B;7~35 min,68%B→75%B;35~36 min,75%B→78%B;36~48 min,78%B;48~50 min,78%B→95%B;50~60 min,95%B;60~62 min,95%B→100%B;62~77 min,100%B),检测波长220 nm(0~28 min,检测白术内酯Ⅲ、白术内酯Ⅱ)、270 nm(28~40 min,检测白术内酯Ⅰ、(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯)、203 nm(40~50 min,检测苍术素、β-桉叶醇)、220 nm(50~77 min,检测苍术酮),流速为1.0 mL·min-1,柱温为25 ℃,进样量为10 μL。对照品及3种样品色谱图见图 1。
|
1.白术内酯Ⅲ(atractylenolide Ⅲ)2.白术内酯Ⅱ(atractylenolide Ⅱ)3.白术内酯Ⅰ(atractylenolide Ⅰ)4.(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯((4E,6E,12E)-tetradecatriene-8,10-diyne-1,3-diacetate)5.苍术素(atractylodin)6.β-桉叶醇(β-eudesmol)7.苍术酮(atractylon) 图 1 混合对照品(A)、15号北苍术样品(B)、37号关苍术样品(C)和3号茅苍术样品(D)色谱图 Figure 1 Chromatograms of mixed reference substances(A), A. chinensis sample No. 15(B), A. japonica sample No. 37(C) and A. lancea sample No. 3(D) |
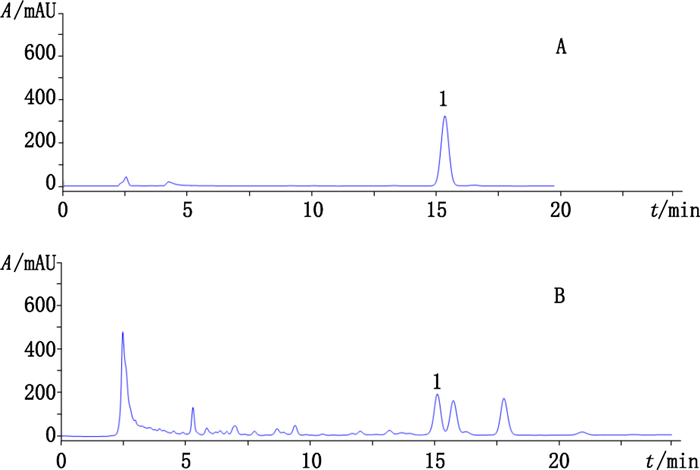
茅苍术样品的β-桉叶醇分离度不佳,因此对其β-桉叶醇含量进行单独测定并通过方法学验证。色谱条件:采用资生堂CAPCELL PAK C18色谱柱(4.6 mm×250 mm,5 μm),流动相为0.1%磷酸水溶液-甲醇(20:80),等度洗脱,流速1.0 mL·min-1,柱温25 ℃,检测波长203 nm,进样量5 μL。对照品及样品色谱图见图 2。
|
1. β-桉叶醇(β-eudesmol) 图 2 对照品(A)和3号茅苍术样品(B)色谱图 Figure 2 Chromatograms of reference substance(A) and A. lancea sample No. 3 (B) |
精密量取白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮的对照品储备液适量,用甲醇配制成质量浓度分别为0.041 4、0.080 4、0.088 2、0.082 3、0.320 0、0.845 6、0.935 0 mg·mL-1的混合对照品溶液;用流动相将上述混合对照品溶液稀释2、4、20、50、100、200倍,得到系列浓度的混合对照品溶液,按“2.2”项下色谱条件进样测定,以对照品质量X(μg)及峰面积值Y进行线性回归,分别以S/N=10及S/N=3求得各组分的定量下限及检测下限,结果见表 1。
|
|
表 1 7个成分的线性关系及定量下限、检测下限 Table 1 Linearity, LOQs and LODs of seven components |
另精密量取β-桉叶醇的对照品储备液(2.68 mg·mL-1)适量,用流动相稀释得到系列浓度的β-桉叶醇对照品溶液,按茅苍术样品中β-桉叶醇含量测定的色谱条件进样测定,得回归方程:
Y=1 075.5X+33.701 r=0.999 9
2.4 精密度试验精密吸取混合对照品溶液,按“2.2”项下色谱条件连续进样6次,记录白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮的峰面积,计算峰面积的RSD(n=6)分别为1.4%、1.6%、1.0%、1.9%、0.89%、1.7%、1.3%。用β-桉叶醇对照品溶液(0.268 0 mg·mL-1)进行茅苍术样品中β-桉叶醇含量测定的精密度试验,RSD为1.5%。结果表明仪器精密度良好。
2.5 重复性试验精密称取15号苍术样品,按“2.1.2”项方法平行制备6份供试品溶液,按“2.2”项下色谱条件进样分析,计算白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮的平均含量值(以干燥品计)分别为0.657、0.592、0.863、0.095、1.211、0.972、2.554 mg·g-1,RSD分别为1.3%、0.97%、1.1%、1.8%、2.3%、2.0%、1.7%。用3号样品进行茅苍术样品中β-桉叶醇含量测定的重复性试验,RSD为1.1%。结果表明方法重复性良好。
2.6 稳定性试验取15号苍术样品的供试品溶液,室温放置,分别在0、2、4、8、12、24 h按“2.2”项下色谱条件进样分析,计算24 h内供试品溶液中白术内酯Ⅲ、Ⅱ、Ⅰ及(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯、苍术素、β-桉叶醇、苍术酮峰面积的RSD分别为0.67%、1.0%、0.78%、1.5%、0.38%、1.7%、0.89%。用3号样品进行茅苍术样品中β-桉叶醇含量测定的稳定性试验,峰面积的RSD为2.3%。结果表明供试品溶液在24 h内稳定。
2.7 加样回收率试验精密称取15号苍术样品6份,每份约0.5 g,分别加入混合对照品溶液(每1 mL含白术内酯Ⅲ 0.240 8 mg,白术内酯Ⅱ 0.224 0 mg,白术内酯Ⅰ 0.329 2 mg,(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯0.037 75 mg,苍术素0.492 0 mg,β-桉叶醇0.383 0 mg,苍术酮0.932 5 mg)适量,按“2.1.2”项方法制备供试溶液,按“2.2”项下色谱条件进样分析并计算回收率,结果见表 2。用3号样品进行茅苍术样品中β-桉叶醇含量测定的加样回收率试验,结果平均回收率为100.6%,RSD为2.3%。结果表明本法回收率良好。
|
|
表 2 加样回收率结果(n=6) Table 2 Results of recovery test for seven components of Atractylodes samples |
取不同批次苍术样品,分别按“2.1.2”项方法制备供试品溶液,按“2.2”项下色谱条件进样分析(茅苍术样品中β-桉叶醇含量单独分析)。按外标峰面积法计算样品中各测定成分的含量(以干燥品计),结果见表 3。
|
|
表 3 样品的含量测定(mg·g-1) Table 3 Determination results of Atractylodes samples |
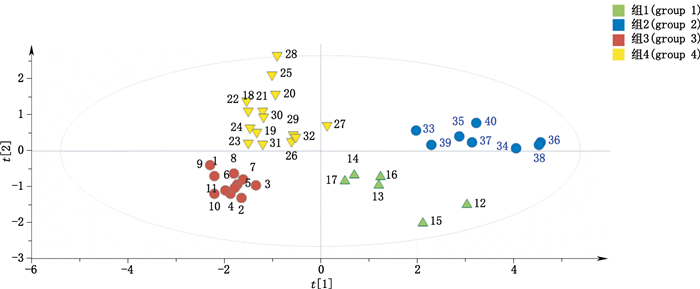
采用SIMCA 13.0软件,对40批样本的7个主要成分含量进行无监督模式PCA分析。所得PCA得分图见图 3。拟合主成分个数为2个,前2个主成分的累计方差贡献率为77.5%。从图 3可以看出,40批样品可以分为4组,其中组1和组4均为北苍术,组2为关苍术,组3为茅苍术。PCA分析可较好地区分茅苍术、北苍术和关苍术。
|
图 3 PCA得分散点图 Figure 3 Score scatter plot of PCA |
在PCA分析的基础上,以样本中各成分的含量为自变量,样本类别为因变量建立OPLS-DA判别模型进行分析,利用变量权重重要性排序(variable importance in projection,VIP)对组间差异性成分进行筛选和指认。
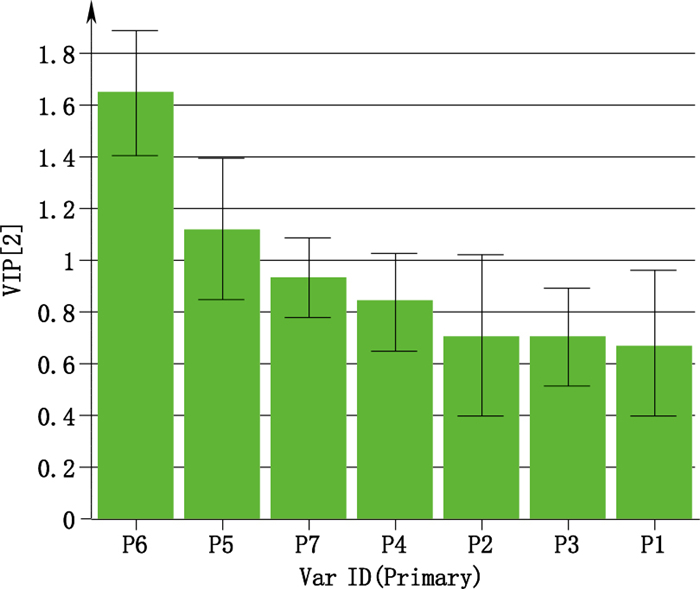
对3个种的苍术样本进行OPLS-DA分析。以2个预测成分和1个正交成分建立模型,结果R2Y(cum)=0.878,Q2(cum)=0.852,模型拟合及预测效果良好。VIP大于1的成分分别为苍术素(P5)和β-桉叶醇(P6),见图 4。
|
图 4 VIP图(3种苍术) Figure 4 VIP plot of OPLS-DA (three kinds of Atractylodes) |
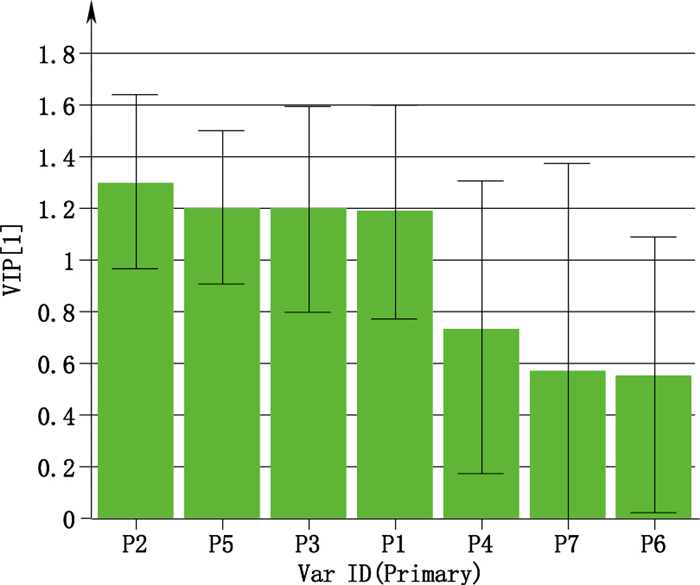
对2组北苍术样品(组1和组4)进行OPLS-DA分析。以1个预测成分和1个正交成分建立模型,结果R2(cum)=0.852,Q2(cum)=0.781,模型拟合及预测效果良好。VIP大于1的成分分别为白术内酯Ⅲ(P1)、白术内酯Ⅱ(P2)、白术内酯Ⅰ(P3)和苍术素(P5),见图 5。
|
图 5 VIP图(2组北苍术) Figure 5 VIP plot of OPLS-DA (two groups of A. chinensis) |
在OPLS-DA分析的基础上,选取OPLS-DA分析所得的VIP值大于1的成分,以样本类别为自变量,样本中各成分的含量为因变量进行单因素方差分析和独立样本t检验(P < 0.05为差异有统计学意义)。
通过单因素方差分析比较3个种苍术之间的苍术素、β-桉叶醇含量,结果发现3组之间苍术素和β-桉叶醇含量均存在显著性差异(P < 0.01)。通过独立样本t检验比较2组北苍术样本之间的白术内酯Ⅲ、Ⅱ、Ⅰ和苍术素含量,结果发现2组之间的白术内酯Ⅲ、Ⅱ、Ⅰ和苍术素含量均存在显著性差异(P < 0.01)。
对筛选的2个差异性成分在北苍术、茅苍术和关苍术中的分布进行比较,结果显示,苍术素在关苍术中含量最低,在茅苍术中含量较高。苍术素在北苍术中的分布较不均匀,其中部分北苍术(组4)的苍术素含量高于茅苍术,部分北苍术(组1)苍术素含量低于茅苍术但高于关苍术。β-桉叶醇在关苍术中含量最低,在北苍术中含量较低,在茅苍术中含量最高。因此可将苍术素、β-桉叶醇作为关键的差异性成分鉴别关苍术、北苍术和茅苍术。
对筛选的4个差异性成分在两组北苍术(组1和组4)中的分布进行比较,结果显示,白术内酯Ⅲ、Ⅱ和Ⅰ在组4中含量均较低,在组1中含量均较高。苍术素在组1中含量较低,在组4中含量较高。原因可能是北苍术药材多为野生资源,不同产地及不同地理环境下苍术化学成分含量具有明显差异,因此有必要对苍术药材进行质量控制研究。
4 讨论与小结 4.1 测定方法的建立本研究建立HPLC法同时测定苍术药材中7个主要成分含量,并进行PCA和OPLS-DA分析。研究过程中对苍术药材的提取条件、检测波长进行了考察。
采用不同体积百分数(50%、70%、90%、100%)甲醇和水超声提取,结果90%甲醇水超声提取效率最佳。比较30、45、60 min超声提取时间,45 min的提取效率最佳。
经紫外全波长扫描确定,白术内酯Ⅲ、Ⅱ和苍术酮的最大吸收波长为220 nm[9-10],白术内酯Ⅰ的最大吸收波长为278 nm,(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯的最大吸收波长为250 nm和315 nm 2个波长;由于两者保留时间较为接近,故选择在同一波长270 nm下进行检测[9, 11]。β-桉叶醇为紫外末端吸收,苍术素的最大吸收波长为335 nm,由于苍术素和β-桉叶醇的保留时间接近,故选择同一波长203 nm下检测苍术素和β-桉叶醇[12-14]。因此最终确定白术内酯Ⅲ、Ⅱ和苍术酮的检测波长为220 nm,白术内酯Ⅰ、(4E,6E,12E)-十四癸三烯-8,10-二炔-1,3-二乙酸酯的检测波长为270 nm,苍术素和β-桉叶醇的检测波长为203 nm。在此波长梯度条件下,7个成分均有较强的吸收,各成分能得到有效分离和检测。但茅苍术样品中某组分对β-桉叶醇有干扰,反复改变条件也无法达到定量要求,只能改变色谱条件,对茅苍术中的β-桉叶醇进行单独测定。
4.2 多元统计分析和意义本研究结合PCA和OPLS-DA多元统计方法,对40批苍术样本的7个主要成分含量进行数据分析,实现茅苍术、北苍术和关苍术的区分,并揭示苍术素和β-桉叶醇是区分3种苍术关键的差异成分。茅苍术产地为湖北不同地区,分布较集中,质量相对较稳定,平均质量较高。北苍术多为野生资源,化学成分含量和药材质量差异较大,因此有必要对其进行质量控制。
综上,本文研究3种苍术的7个主要成分含量并对其进行多元统计分析,希冀为苍术质量控制和评价的深入研究奠定基础。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 161 ChP 2015. Vol Ⅰ[S]. 2015: 161 |
| [2] |
曾敏. 苍术饮片规格及其质量评价标准研究[D]. 武汉: 湖北中医药大学, 2013 ZENG M. The Study on Specifications and Quality Evaluation Criteria of Atractylodes lancea[D]. Wuhan: Hubei University of Chinese Medicine, 2013 |
| [3] |
邹小兴. 苍术属植物药用亲缘学研究[D]. 北京: 北京中医药大学, 2010 ZOU XX. A Pharmacophylogenetic Study of Atractylodes DC. [D]. Beijing: Beijing University of Chinese Medicine, 2010 |
| [4] |
肖增丽, 梁慧, 康晖, 等. 五类新药苍术总萜醇的化学成分[J]. 中国实验方剂学杂志, 2013, 19(13): 100. XIAO ZL, LIANG H, KANG H, et al. Chemical components of the fifth sort of new drugs-total terpene alcohols of Atractylodes lances[J]. Chin J Exp Tradit Med Form, 2013, 19(13): 100. |
| [5] |
邓爱平, 李颖, 吴志涛, 等. 苍术化学成分和药理的研究进展[J]. 中国中药杂志, 2016, 41(21): 3904. DENG AP, LI Y, WU ZT, et al. Advances in studies on chemical compositions of Atractylodes lancea and their biological activities[J]. China J Chin Mater Med, 2016, 41(21): 3904. |
| [6] |
韩玉. 电子鼻在苍术质量评价中的应用研究[D]. 北京: 北京中医药大学, 2011 HAN Y. Study on the Application of Electronic Nose in the Quality Assessment of Atractylodis Rhizoma[D]. Beijing: Beijing University of Chinese Medicine, 2011 |
| [7] |
王璠, 欧阳臻, 郭兰萍, 等. 苍术综合化学模式识别[J]. 中国中药杂志, 2014, 39(13): 2536. WANG F, OUYANG Z, GUO LP, et al. Comprehensive chemical pattern recognition of Atractylodis Rhizoma[J]. China J Chin Mater Med, 2014, 39(13): 2536. |
| [8] |
常相伟, 李德坤, 王彤, 等. 基于UHPLC-Q TOF/MS的植物代谢组学技术鉴别林下山参的不同部位[J]. 药学学报, 2016, 51(10): 1609. CHANG XW, LI DK, WANG T, et al. Application of metabolomics approach to the study of different parts of mountain cultivated Ginseng using UHPLC-Q TOF/MS[J]. Acta Pharm Sin, 2016, 51(10): 1609. |
| [9] |
陈鸿平, 张杰红, 王晓宇, 等. 土炒对白术中白术内酯Ⅰ、Ⅱ、Ⅲ含量的影响[J]. 中药材, 2011, 34(3): 354. CHEN HP, ZHANG JH, WANG XY, et al. Content comparision of atractylode Ⅰ, Ⅱ, Ⅲ in Rhizoma Atractylodis Macrocephalae and the processed with soils[J]. J Chin Med Mater, 2011, 34(3): 354. |
| [10] |
王峰, 蔡光明, 郭惠玲. 高效液相色谱法测定白术挥发油中苍术酮的含量[J]. 中南药学, 2008, 6(3): 320. WANG F, CAI GM, GUO HL. Determination of atractylon in the volatile oil of Atractylodes macrocephala Koidz.by HPLC[J]. Cent South Pharm, 2008, 6(3): 320. |
| [11] |
方成武, 樊敏, 刘守金, 等. HPLC法同时测定茅苍术中3种聚乙烯炔成分的含量[J]. 中药材, 2010, 33(6): 932. FANG CW, FAN M, LIU SJ, et al. Simultaneous determination of three kinds of atractylodes polyethylene alkyne in Atractylodes lancea by HPLC[J]. J Chin Med Mater, 2010, 33(6): 932. |
| [12] |
杨雪梅, 班小军, 杨海红, 等. HPLC梯度洗脱法同时测定保安万灵丹中升麻素苷、5-O-甲基维斯阿米醇苷、茅术醇、β-桉叶醇和苍术素的含量[J]. 中国药事, 2015, 29(9): 384. YANG XM, BAN XJ, YANG HH, et al. Simultaneous content determination of prim-O-glucosylcimifugin, 5-O-methylvisammioside, hinesol, β-eudesmol and atractylodin in Bao'an Wanling pills by multiwavelength HPLC[J]. Chin Pharm Aff, 2015, 29(9): 384. |
| [13] |
张晓兰, 李锦, 李遇伯, 等. 高效液相色谱法测定茅苍术药材中β-桉叶醇与苍术素的含量[J]. 药物分析杂志, 2009, 29(12): 2051. ZHANG XL, LI J, LI YB, et al. HPLC determination of β-eudesmol and atractylon in Atractylodes lancea (Thunb.) DC.[J]. Chin J Pharm Anal, 2009, 29(12): 2051. |
| [14] |
周军, 赵晨, 王杰. 藿香正气不同制剂中苍术素的含量测定[J]. 药物分析杂志, 2012, 32(8): 1476. ZHOU J, ZHAO C, WANG J. Determination of atractylodin for different preparations of Huoxiangzhengqi[J]. Chin J Pharm Anal, 2012, 32(8): 1476. |
 2018, Vol. 38
2018, Vol. 38 
