2. 南京中医药大学中药品质与效能国家重点实验室(培育), 南京 210023
2. State Key Laboratory Cultivation Base for TCM Quality and Efficacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
乳香为橄榄科植物乳香树 Boszvellia carterii Birdw.及同属植物 Boswcllia bhaurdajiana Birdw.树皮渗出的树脂。乳香性温,味辛、苦,归心、肝、脾经。其主要含有3%~8%的挥发油、60%~70%的树脂、27%~35%的树胶,具有活血定痛及消肿生肌的功效,可用于治疗胸痹心痛、胃脘疼痛、痛经经闭、产后瘀阻、风湿痹痛、痈肿疮疡等病症[1-2]。
临床上常以乳香配伍没药使用,具有宣通经络、活血散瘀、消肿止痛的功效。没药为橄榄科植物地丁树 Commiphora myrrha Engl.或哈地丁树 Commiphora molmol Engl.的干燥树脂。性平,味辛、苦,具有散瘀定痛及消肿生肌的功效,主要含有单萜、倍半萜、三萜、甾体、木脂素类化合物[3]。乳香、没药相须配伍最早出自《证治准绳》之“乳香止痛散”。《本草纲目》亦云:“乳香活血,没药散血,皆能止痛、消肿、生肌,故二药每每相兼而用。”
本实验在前期研究基础上[4-8],采用UPLC-TQ/MS联用技术,对乳香-没药配伍后乳香中化学成分溶出变化进行定量分析,以期从化学成分角度初步揭示乳香-没药二者配伍的物质基础及配伍合理性。
1 仪器与试药 1.1 仪器Waters AcquityTM UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器;Waters公司);AcquityTM UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm;填料:十八烷基硅烷键合硅胶-亚乙基桥杂化颗粒;Waters公司);Xevo质谱检测器(Waters公司);MassLynx 4.1质谱工作站软件(Waters公司);EPED超纯水系统(南京易普易达科技发展有限公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);Anke GL-16GII型离心机(上海安亭科学仪器厂);BT125型电子天平(赛多利斯科学仪器有限公司)。
1.2 试药超纯水经易普易达超纯水制备系统自制;乙腈为色谱纯,购自默克公司;其他化学试剂均为分析纯,购自南京化学试剂有限公司。
乳香各5批次,分别购自先声药店及网订4个批次(批号1505101、131101、1601101、14110801),即R1~R5号乳香;没药药材购自先声药店,批号1408101,炮制方法均为醋制,经南京中医药大学段金廒教授鉴定,乳香为橄榄科植物乳香树 Boszvellia carterii Birdw.树皮渗出的树脂;没药为橄榄科植物地丁树 Commiphora myrrha Engl.的干燥树脂。
乳香对照品均购自宝鸡辰光生物科技有限公司,其包括α-乳香酸,批号20150522,纯度95%;3β-乙酰氧基-5α-8,24-羊毛脂二烯-21-酸,批号20150527,纯度98%;β-乳香酸,批号20150504,纯度98%;乙酰11α-甲氧基-β-乳香酸,批号20150519,纯度98%;3α-乙酰基-甘燧-7,24二烯-21-酸,批号20150523,纯度98%;3-O-乙酰基-α乳香酸,批号20150515,纯度98%;羽扇-20(29)烯-3α-乙酰基-24-酸,批号20150513,纯度98%;3-乙酰基-11-酮基-β-乳香酸,批号20150410,纯度98%;3α-乙酰氧基-羊毛脂-8,24-二烯-21-酸,批号20150519,纯度98%;3α-羟基甘燧烷-7,24-二烯-21-酸,批号20150529,纯度98%;3-羟基甘燧烷-8,24-二烯-21-酸,批号20150520,纯度95%。
2 方法与结果 2.1 溶液制备 2.1.1 供试品溶液取均为醋制的乳香、没药适量,粉碎,各精密称取10 g于圆底烧瓶中,用80%乙醇水回流提取2次,第1次以10倍量体积提取,第2次以8倍量体积提取,每次提取1 h后抽滤,合并2次滤液,减压浓缩至0.5 g·mL-1,置蒸发皿上将有机溶剂与水烘干,即得乳香-没药配伍后的提取物干浸膏。将制取的干浸膏转移至离心管中,称量后,4 ℃冷冻保存待用。精密称取5批次乳香、没药单味药各10 g,同上方法制备乳香、没药单味药的提取物干浸膏。
取乳香、没药单味药及乳香-没药配伍后的提取物干浸膏各100 mg,精密称定,分别置于10 mL量瓶中,加入80%甲醇水9 mL,超声(300 W,50 kHz)提取60 min后,取出放冷,加80%甲醇水至刻度,摇匀,13 000 r·min-1离心10 min,取上清液,经0.22 μm微孔滤膜过滤,得供试品溶液。
2.1.2 混合对照品储备液精密称定乳香对照品各1.0 mg,置5 mL量瓶中,用80%甲醇水溶解并稀释至刻度,制成混合对照品溶液[含α-乳香酸(204 μg·mL-1);3β-乙酰氧基-5α-8,24-羊毛脂二烯-21-酸(200 μg·mL-1);β-乳香酸(252 μg·mL-1);乙酰基-11α-甲氧基-β-乳香酸(202 μg·mL-1);3α-乙酰基-甘燧-7,24二烯-21-酸(198 μg·mL-1);3-O-乙酰基-α乳香酸(208 μg·mL-1);羽扇-20(29)烯-3α-乙酰基-24-酸(194 μg·mL-1);3-乙酰基-11-酮基-β-乳香酸(360 μg·mL-1);3α-乙酰氧基-羊毛脂-8,24-二烯-21-酸(204 μg·mL-1);3-α羟基甘燧烷-7,24-二烯-21-酸(234 μg·mL-1);3-羟基甘燧烷-8,24-二烯-21-酸(190 μg·mL-1)],-4 ℃冷冻保存待用。
2.2 UPLC-TQ/MS分析条件 2.2.1 色谱条件采用AcquityTM UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),柱温30 ℃,以乙腈(A)-0.1%甲酸水(B)为流动相,梯度洗脱(0~1 min,10%A;1~8 min,5%A;8~9 min,5%A;9~10 min,10%A),流速0.4 mL·min-1,进样量2 μL。
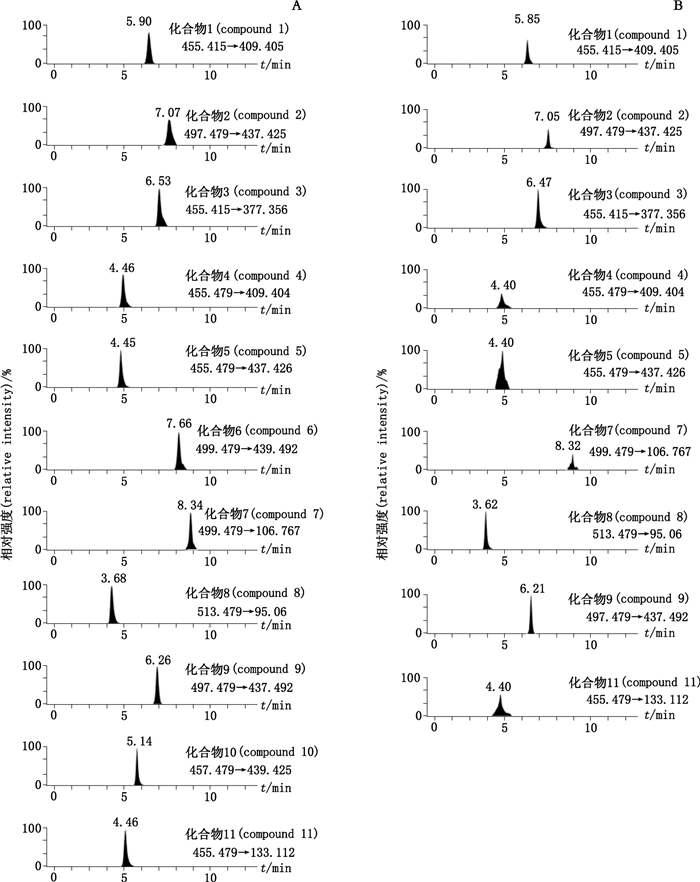
2.2.2 质谱条件采用电喷雾正、负离子源(ESI+/ESI−),多反应检测(MRM方式),氦气流速35 arb,辅助气流速15 arb,毛细管温度275 ℃,喷雾电压3.5 kV,管透镜电压水平65%,毛细管电压35 V,扫描范围m/z 100~1 000;质量分辨率60 000。二级质谱分析:裂解模式为高能诱导解离(HCD),隔离宽度2.0 Da,归一化碰撞能量35 V,激活时间30 ms,碰撞气为高纯氮气。主要质谱检测参数见表 1,混合对照品及样品的离子流色谱图见图 1。
|
|
表 1 乳香中11个化合物主要质谱检测参数 Table 1 MRM transition, cone voltage, collision energy and ion mode of 11 investigated compounds in frankincense |
|
图 1 混合对照品(A)、样品(B)的离子流色谱 Figure 1 LC-MS chromatograms of reference substances(A) and sample(B) |
取混合对照品储备液,分别稀释2、10、20、100、200、1 000倍,经0.22 μm微孔滤膜过滤,即得系列混合对照品溶液,依次进样分析;以峰面积为纵坐标,对照品的质量浓度为横坐标,绘制标准曲线,计算回归方程,结果见表 2。
|
|
表 2 回归方程、r值及线性范围 Table 2 Linear regression data |
取混合对照品溶液,连续进样6次,记录各化合物色谱峰。结果见表 3,各主要色谱峰峰面积的RSD均小于5.1%,表明仪器精密度良好。
|
|
表 3 各化合物的精密度、稳定性、重复性及回收率试验结果 Table 3 The results of precision, stability, repeatability and recovery of the 11 analytes |
按“2.1.1”项下方法,平行制备6份乳香-没药配伍供试品溶液,依次进样测定,记录样品中各待测物色谱峰峰面积, 计算含量。结果见表 3,各含量的RSD均小于5.7%,表明方法重复性良好。
2.4.3 稳定性试验取供试品溶液,分别于0、1、2、4、6、8 h进样测定,记录各待测物色谱峰。结果见表 3,各主要色谱峰峰面积的RSD均小于6.5%,表明供试品溶液在8 h内化学性质稳定。
2.4.4 加样回收率试验取“2.1.1”项下乳香配伍没药样品3份,精密加入与样品中化合物等量的对照品,按“2.1.1”项下方法制备供试溶液,进样测定回收率。结果见表 3,各指标成分的平均加样回收率为89.2%~104.4%,RSD为0.90%~4.8%。
2.5 5批次乳香样品分析结果取提取物浓缩液置蒸发皿上将有机溶剂与水烘干,即得提取物干浸膏,干浸膏得率=干浸膏量/生药量×100%。R1~R5号乳香干浸膏得率及含量测定结果见表 4。结果表明R5号乳香成分总含量最高且浸膏得率较高,故以R5号乳香与没药进行配伍测定。
|
|
表 4 5批次乳香样品中化学成分含量及浸膏得率(%) Table 4 Total content and extraction rate of five batches of frankincense |
取乳香配伍没药后的供试品溶液进样测定,以标准曲线法计算含量,结果见表 5。由表 5可见,配伍后乳香中α-乳香酸、3-羟基甘燧烷-8,24-二烯-21-酸含量小幅度下降,3β-乙酰氧基-5α-8,24-羊毛脂二烯-21-酸、乙酰基-11α-甲氧基-β-乳香酸、3α-乙酰氧基-羊毛脂-8,24-二烯-21-酸含量显著下降;β-乳香酸、羽扇-20(29)烯-3α-乙酰基-24-酸、3-乙酰基-11-酮基-β-乳香酸含量小幅度上升,3α-乙酰基-甘燧-7,24二烯-21-酸含量显著上升。
|
|
表 5 乳香单味药及配伍没药后样品中化学成分含量(%) Table 5 Content of 11 kinds of chemical compositions in frankincense before and after compatibility |
本实验采用UPLC-TQ/MS联用技术检测乳香中的11个化学成分,其分析时间短,溶剂消耗少,分离效果及分析效率大幅度提升,可以提高保留时间重现性及色谱分辨率,有着超高分离度、超高灵敏度的特点。中药所含化学成分种类较多且部分成分的化学结构相似,利用UPLC-TQ/MS联用技术可以在较短的时间里分离中药复杂体系,得到所需的化合物信息,是分析中药复杂化学成分的有力工具[9]。
本实验研究结果表明,乳香-没药配伍使用后,其化学成分发生了较大的变化。配伍后乳香中α-乳香酸、3-羟基甘燧烷-8,24-二烯-21-酸含量小幅度下降,3β-乙酰氧基-5α-8,24-羊毛酯二烯-21-酸、乙酰基-11α-甲氧基-β-乳香酸、3α-乙酰氧基-羊毛脂-8,24-二烯-21-酸含量显著下降;β-乳香酸、羽扇-20(29)烯-3α-乙酰基-24-酸、3-乙酰基-11-酮基-β-乳香酸含量小幅度上升,3α-乙酰基-甘燧-7,24二烯-21-酸含量显著上升。结果表明乳香-没药二者配伍对乳香中化学成分的溶出有抑制或促进作用,其作用趋势并无一致性。该结果可为阐明乳香没药二者相须配伍使用的物质基础提供一定的科学依据。
现代药理研究表明,乳香中的乳香酸类化合物具有抗炎作用,对肿瘤细胞有抗增殖、凋亡诱导和分化诱导作用[10]。课题组前期研究发现[5-6],3-羟基甘遂-8,24-二烯-21-酸可抑制脂多糖刺激的小鼠腹腔巨噬细胞释放一氧化氮的作用,其半数最大抑制浓度为7.8×10-3 mmol·L-1,本实验结果发现3-羟基甘遂-8,24-二烯-21-酸在配伍前后溶出度发生变化,该物质可能与其配伍前后药理活性的变化相关。且乳香、没药水提液及其不同配伍组合均具有显著抑制体外二磷酸腺苷诱导的家兔体外血小板聚集作用,两药配伍后,其活性强于单味药提取物的活性,具有协同增效作用[6]。乳香配伍没药后,乳香中11个成分总含量上升,可能与其配伍后发生协同增效作用相关。本研究结果为两药配伍协同增效的物质基础提供了一定的科学依据。
药对是中医临床上常用的相对固定的药物配伍形式,也是中药复方配伍的最基本并且最常见的形式[11]。中药药对虽组成相对简单,却具备了复方的基本主治功能,是中药方剂的核心和中医临床用药组方的关键[12],但现对于中药药对的物质基础研究仍然较为薄弱。药对配伍后的化学成分并非各单味药物化学成分的简单相加,配伍过程中会发生复杂的物理、化学变化,可能使有效成分的溶出率升高或降低,也可能产生新的化学成分[13]。中药药对研究可以揭示方剂复杂体系的深刻内涵,也可以为中医临床用药提供科学指导。
| [1] |
王勇, 潘国梁, 陈彦, 等. 4种方法提取乳香化学成分及其GC-MS研究[J]. 中国药学杂志, 2005, 40(14): 1054. WANG Y, PAN GL, CHEN Y, et al. Studies on extraction and identification of olibanum[J]. Chin Pharm J, 2005, 40(14): 1054. DOI:10.3321/j.issn:1001-2494.2005.14.005 |
| [2] |
王淳, 夏磊, 宋志前, 等. 乳香中5种乳香酸成分含量分析[J]. 中国中药杂志, 2011, 36(10): 1330. WANG C, XIA L, SONG ZQ, et al. Determination of five boswellic acids in Boswellia serrata[J]. China J Chin Mater Med, 2011, 36(10): 1330. |
| [3] |
韩璐, 孙甲友, 周丽, 等. 没药化学成分和药理作用研究进展[J]. 亚太传统医药, 2015, 11(3): 38. HAN L, SUN JY, ZHOU L, et al. Advances in chemistry and pharmacological research of myrrh[J]. Asia Pac Tradit Med, 2015, 11(3): 38. DOI:10.11954/ytctyy.201503015 |
| [4] |
陈婷, 宿树兰, 钱叶飞, 等. 乳香-没药配伍前后汤液理化参数变化与化学成分的关联分析[J]. 中成药, 2012, 34(8): 1529. CHEN T, SU SL, QIAN YF, et al. Association analysis between the physiochemical parameters and the chemical constituents in olibanum and myrrha decoction before and after combination[J]. Chin Tradit Pat Med, 2012, 34(8): 1529. |
| [5] |
陈婷, 宿树兰, 段金廒, 等. 乳香-没药配伍前后化学成分溶出变化及其对LPS-诱导的巨噬细胞产生NO的影响[J]. 中国中药杂志, 2013, 38(2): 179. CHEN T, SU SL, DUAN JA, et al. Change in dissolution of chemical components of frankincense-myrrh before and after their compatibility and effect on no release of LPS-induced macrophage cells[J]. China J Chin Mater Med, 2013, 38(2): 179. |
| [6] |
蒋海峰, 宿树兰, 欧阳臻, 等. 乳香、没药提取物及其配伍对血小板聚集与抗凝血酶活性的影响[J]. 中国实验方剂学杂志, 2011, 17(19): 160. JIANG HF, SU SL, OUYANG Z, et al. Effect of extracts from olibanum and myrrha and their compatibility on platelet aggregation and antithrombin activity[J]. Chin J Exp Tradit Med Form, 2011, 17(19): 160. DOI:10.3969/j.issn.1005-9903.2011.19.046 |
| [7] |
王艳艳, 王团结, 宿树兰, 等. 乳香、没药药对配伍挥发油成分的GC-MS分析[J]. 现代中药研究与实践, 2011, 25(2): 31. WANG YY, WANG TJ, SU SL, et al. Study on chemical constituents of volatile oils in drug pair of frankincense and myrrh by GC-MS[J]. Chin Med J Res Pract, 2011, 25(2): 31. |
| [8] |
宿树兰, 王团结, 段金廒. 常用树脂类药材资源分布及化学成分与药理活性研究进展[J]. 国际药学研究杂志, 2009, 36(2): 109. SU SL, WANG TJ, DUAN JA. Distribution, chemical components and bioactivity of resin herbs:research advances[J]. J Int Pham Res, 2009, 36(2): 109. |
| [9] |
刘祥东, 梁琼麟, 罗国安, 等. 液质联用技术在医药领域中的应用[J]. 药物分析杂志, 2005, 25(1): 110. LIU XD, LIANG QL, LUO GA, et al. The application of liquid chromatography-mass spectrometry in the field of medicine[J]. Chin J Pharm Anal, 2005, 25(1): 110. |
| [10] |
王峰, 华会明, 王淑美, 等. 乳香的化学成分研究[J]. 中草药, 2011, 42(7): 1293. WANG F, HUA HM, WANG SM, et al. Chemical constituents from frankincense[J]. Chin Tradit Herb Drugs, 2011, 42(7): 1293. |
| [11] |
段金廒, 宿树兰, 唐于平, 等. 中药药对配伍组合的现代认识[J]. 南京中医药大学学报, 2009, 25(5): 330. DUAN JA, SU SL, TANG YP, et al. Modern understanding of compatibility of traditional Chinese medicine[J]. J Nanjing Univ Tradit Chin Med, 2009, 25(5): 330. |
| [12] |
唐于平, 束晓云, 李伟霞, 等. 药对研究(Ⅰ)-药对的形成与发展[J]. 中国中药杂志, 2013, 38(24): 4185. TANG YP, SHU XY, LI WX, et al. Research on Chinese medicine pairs(Ⅰ):their formation and development[J]. China J Chin Mater Med, 2013, 38(24): 4185. |
| [13] |
庞婷, 麦蓝尹, 陈勇, 等. 中药药对配伍的化学成分变化研究进展[J]. 中药材, 2015, 38(11): 2429. PANG T, MAI LY, CHEN Y, et al. Research on chemical composition changes of compatibility of traditional Chinese medicine[J]. J Chin Med Mater, 2015, 38(11): 2429. |
 2018, Vol. 38
2018, Vol. 38 
