2. 北京市教委中药质量控制技术工程中心, 北京 102488
2. Quality Control Technology and Engineering Center of Chinese Medicine, Beijing Municipal Commission of Education, Beijing 102488, China
中药多指标成分的测定方法是对中药材进行质量控制和评价的有效手段;然而,多指标的质量评价模式却受到中药化学对照品分离难度大,单体不稳定或供应价格高等因素的制约[1]。针对这一问题,近年来多位研究学者提出了一测多评法[2-3],且该法已被2010年版[4]、2015年版[5]《中华人民共和国药典》收载应用,但此方法的适用性和耐用性方面尚存在一些问题。故探索建立符合中药多成分分析的方法是完善中药质量控制的关键。
中药对照提取物是指主要化学成分及其含量明确,稳定性好,纯度较高的中药提取物,其化学成分组分比例相对固定,指标性成分含量已采用相应的对照品进行标定,可以实现同时对多个组分进行定性和定量分析[6]。中药对照提取物作为一种反映中医药特色的对照物质,与单一对照品相比,可提高中药材检验的规范化、专属性和重现性,大大节约检测成本[7]。因此,加强对中药对照提取物的研究,将有效促进中药质量评价方法的完善,同时为更科学、合理、系统地开展中药质量控制,提供新的研究途径和研究模式。
薄荷为唇形科植物薄荷Mentha haplocalyx Briq.的干燥地上部分,具有疏散风热、清利头目、利咽、透疹等功效,临床多用于治疗风热感冒、风温初起、头痛等[5]。目前对薄荷药材的化学成分研究多集中于挥发性成分[8],而薄荷传统用药形式为水煎,提示非挥发性成分也应是其发挥药效的组分,以挥发性成分为指标难以全面、准确评价和控制其质量。文献及前期研究基础表明[9],薄荷[10-11]中橙皮苷、香叶木苷、蒙花苷、迷迭香酸及反式丹酚酸J等酚类成分对薄荷抗炎[12]、抗氧化[13-14]作用贡献较大。在综合考虑制备技术可行性及其药材含量,选择酚类成分橙皮苷、香叶木苷、蒙花苷、香蜂草苷、迷迭香酸为指标性成分,制备薄荷酚类对照提取物,建立薄荷药材中上述5个酚类成分的含量测定方法,并比较了以对照提取物和单体对照品为对照的薄荷药材含量测定结果,为客观评价薄荷药材质量提供重要的实验基础和方法模式,为建立科学合理的薄荷药材质量标准奠定基础。
1 仪器与试剂Waters 1525高效液相色谱仪,2996紫外检测器,Breeze色谱工作站,2707自动进样器;KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);DS电热三用水浴锅(北京医疗设备厂);Sartorious BT 25S型十万分之一电子分析天平(北京赛多利斯仪器有限公司)。
对照品迷迭香酸(批号10251178)、橙皮苷(批号11034732)、蒙花苷(批号03347189)、香叶木苷(批号10473233)均购自成都曼斯特生物科技有限公司,香蜂草苷(批号8901-765992)购自成都瑞芬思生物科技有限公司,含量分别为98.6%、99.1%、98.2%、98.7%、98.5%。薄荷药材(批号120512)购自北京本草方源药业公司,其他10批次薄荷药材购自于北京各大药房(批号分别为20100611、2010711、20120518、20120615、20110825、20121030、20120702、20120802、20110911、20120830),经北京中医药大学中药学院刘春生教授鉴定为唇形科植物薄荷Mentha haplocalyx Briq.的干燥地上部分。
乙腈、甲醇(色谱纯,Fisher公司),甲酸、乙醇(分析纯,北京化工厂),屈臣氏纯净水。
2 方法与结果 2.1 薄荷酚类对照提取物的研究 2.1.1 对照提取物制备薄荷药材,乙醇回流提取,减压回收溶剂至无醇味,水分散,大孔吸附树脂纯化,不同浓度乙醇洗脱,收集洗脱部位,回收溶剂,蒸干后,经制备液相色谱分离纯化,减压回收溶剂,冷冻干燥,即得薄荷酚类对照提取物粉末。
2.1.2 对照提取物标定以橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸的对照品为对照,测定薄荷酚类对照提取物中这5个指标成分的含量。
2.1.2.1 色谱条件采用Waters Sunfire C18色谱柱(4.6 mm×150 mm,5 μm),以乙腈(A)-0.5%甲酸水溶液(B)为流动相进行梯度洗脱(0~15 min,10%A→21%A;15~20 min,21%A→24%A;20~23 min,24%A →25%A;23~29 min,25%A→26%A;29~40 min,26%A→28%A;40~50 min,28%A→30%A;50~60 min,30%A),流速1 mL·min-1,检测波长296 nm,柱温30 ℃,进样量10 μL。在上述色谱条件下,混合对照品和对照提取物色谱图见图 1。
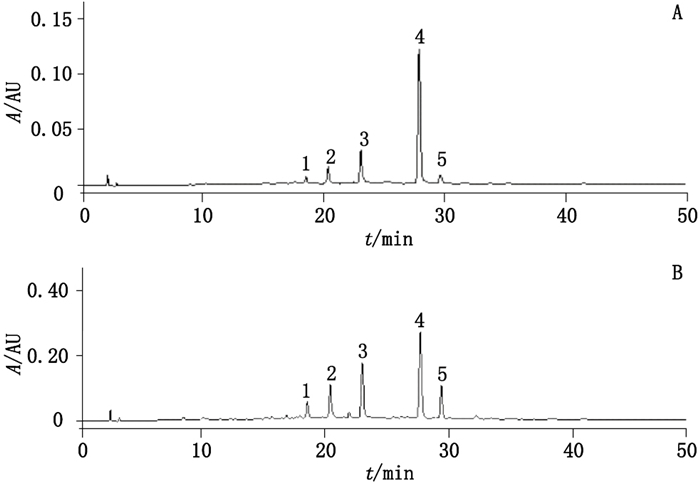
|
1.香叶木苷(diosmin)2.橙皮苷(hesperidin)3.迷迭香酸(rosmarinic acid)4.蒙花苷(linarin)5.香蜂草苷(didymin) 图 1 混合对照品(A)及对照提取物(B)HPLC色谱图 Figure 1 Chromatograms of the mixed standards(A) and the reference extract(B) |
分别精密称定橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸的对照品适量,加甲醇制成质量浓度分别为0.042、0.081、0.019、0.074、0.040 mg·mL-1的混合对照品溶液A;精密吸取上述混合对照品溶液A 1、1、0.5、0.5、0.1 mL,分别置2、10、10、25、10 mL量瓶中,定容,摇匀,作为混合对照品溶液B、C、D、E、F。
2.1.2.3 对照提取物供试品溶液配制取薄荷酚类对照提取物4 mg,精密称定,置10 mL量瓶中,加甲醇超声(100 kHz)30 min,溶解,静置,稀释至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.2.4 方法学考察 2.1.2.4.1 线性关系考察精密吸取“2.1.2.2”项下不同浓度的混合对照品溶液,经0.45 μm微孔滤膜滤过,取续滤液10 μL注入高效液相色谱仪,测定各色谱峰峰面积,以对照品进样量X(μg)为横坐标,色谱峰峰面积Y为纵坐标,进行线性回归,得出回归方程,结果见表 1。
|
|
表 1 5个指标性成分的回归方程及线性范围 Table 1 The regression equations and linear ranges of the five marker components |
按“2.1.2.3”项下方法制备对照提取物供试品溶液1份,按照“2.1.2.1”色谱条件连续进样6次,测得橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸色谱峰峰面积的RSD(n=6)分别为0.63%、0.24%、0.98%、0.17%、0.20%,表明该仪器精密度良好。
2.1.2.4.3 重复性试验取薄荷酚类对照提取物按“2.1.2.3”项下方法平行制备6份对照提取物供试品溶液,分别进样,测定橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸的含量,计算其RSD分别为0.40%、0.35%、0.66%、0.46%、1.0%,均小于2%,表明该方法重复性良好。
2.1.2.4.4 稳定性试验按“2.1.2.3”项下方法制备对照提取物供试品溶液1份,分别于制备之后0、3、6、9、12、24 h按照“2.1.2.1”项下色谱条件进样测定,结果橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸色谱峰峰面积的RSD分别为1.0%、0.81%、0.52%、0.96%、1.2%,表明供试品溶液在24 h内稳定。
2.1.2.4.5 色谱柱耐用性按“2.1.2.3”项下制备方法制备供试品溶液,分别用Waters Sunfire C18色谱柱(4.6 mm×250 mm,5 μm)、Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm)和Acchrom XAqua C18色谱柱(4.6 mm×250 mm,5 μm)测定橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸含量,计算其RSD分别为1.4%、0.32%、1.9%、1.5%、1.6%,均小于2%,表明该方法色谱柱耐用性良好。
2.1.2.4.6 准确度试验取已知含量的薄荷酚类对照提取物2 mg,精密称定,平行6份,加入一定量的混合对照品溶液,按“2.1.2.3”项下方法制备供试溶液,进样测定并计算各成分的平均加样回收率及RSD值。结果橙皮苷、香叶木苷、香蜂草苷、蒙花苷和迷迭香酸的平均加样回收率分别为100.0%、99.9%、99.6%、99.2%、100.4%,RSD分别为1.9%、1.7%、1.8%、1.7%、1.8%,表明该方法准确度良好。
2.1.2.4.7 对照提取物标定结果取10批薄荷酚类对照提取物,按“2.1.2.3”项下方法制备对照提取物供试品溶液。按“2.1.2.1”项下的色谱条件进样测定,采用外标法计算各样品中5个成分含量,结果见表 2。
|
|
表 2 10批对照提取物含量标定结果(%,n=3) Table 2 Calibration results of the ten batches of reference extracts |
采用“2.1.2.1”项下色谱条件定期抽样检测,考察薄荷酚类对照提取物的稳定性。对照提取物经制备后,常温避光保存,进行60 d稳定性试验,分别于第0、5、15、25、40、60天抽样检测,分析样品中橙皮苷、香叶木苷、香蜂草苷、蒙花苷和迷迭香酸的含量,结果见表 3,表明薄荷酚类对照提取物在60 d内具有良好的稳定性。
|
|
表 3 对照提取物稳定性试验结果 Table 3 Stability study results of the reference extracts |
以薄荷酚类对照提取物为对照,测定薄荷药材中橙皮苷、香叶木苷、香蜂草苷、蒙花苷及迷迭香酸5个成分的含量,并与单体对照品测得的结果进行比较,考察对照提取物用于药材质量控制的科学性和可行性。
2.2.1 对照提取物溶液配制精密称定薄荷酚类对照提取物20.05 mg,加甲醇超声(100 kHz)30 min,溶解后,制成橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸的质量浓度分别为0.034 5、0.075 2、0.015 9、0.067 4、0.061 9 mg·mL-1的对照提取物溶液A;分别精密吸取上述对照提取物溶液A 1、1、0.5、0.5 mL置2、10、25、50 mL量瓶中,定容,摇匀,作为对照提取物溶液B、C、D、E。
2.2.2 薄荷药材供试品溶液制备取薄荷粉末(过60目筛)0.1 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇水溶液40 mL,称量,水浴加热回流提取30 min,放至室温,用70%甲醇补充减失的量,摇匀,滤过,取其续滤液即得。
2.2.3 色谱条件色谱条件同“2.1.2.1”项下条件。对照提取物和薄荷药材样品色谱图见图 2。
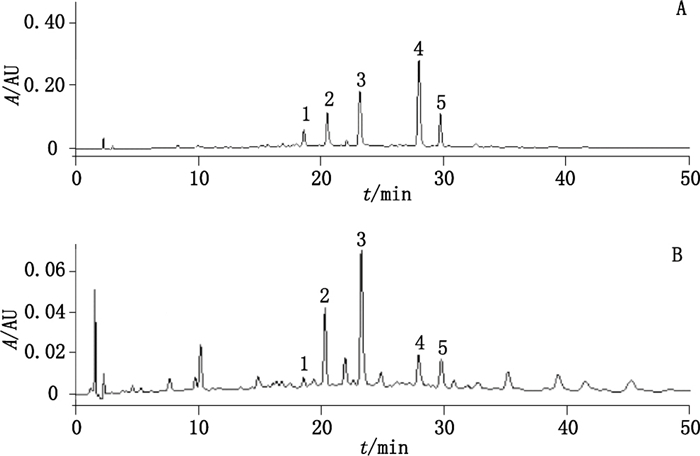
|
1.香叶木苷(diosmin)2.橙皮苷(hesperidin)3.迷迭香酸(rosmarinic acid)4.蒙花苷(linarin)5.香蜂草苷(didymin) 图 2 对照提取物(A)及薄荷药材样品(B)HPLC色谱图 Figure 2 Chromatograms of the reference extract (A) and sample of mint(B) |
精密吸取“2.2.1”项下不同浓度的薄荷酚类对照提取物溶液,注入高效液相色谱仪,测定色谱峰峰面积。以进样量X(μg)为横坐标,色谱峰峰面积(Y)为纵坐标,进行线性回归,得出回归方程,结果见表 4。
|
|
表 4 对照提取物线性关系考察结果 Table 4 The regression equations and linear ranges of the reference extracts |
按“2.2.2”项下方法制备对照提取物供试品溶液1份,按照“2.2.3”色谱条件连续进样6次,测得橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸色谱峰峰面积的RSD(n=6)分别为0.38%,0.35%,0.81%,1.0%,1.7%,表明该仪器精密度良好。
2.2.4.3 重复性试验取同一批薄荷药材粉末,按“2.2.2”项下方法平行制备6份薄荷药材供试品溶液,分别进样,测定峰面积,计算橙皮苷、香叶木苷、香蜂草苷、蒙花苷及迷迭香酸含量及其RSD;结果平均含量分别为0.153%、0.567%、0.0755%、0.382%、0.127%,RSD分别为1.9%、0.62%、1.3%、1.1%、1.9%,表明该方法重复性良好。
2.2.4.4 稳定性试验按“2.2.2”项下方法制备对照提取物供试品溶液1份,分别于制备之后0、3、6、9、12、24 h按照“2.2.3”项下色谱条件进样测定,结果橙皮苷、香叶木苷、香蜂草苷、蒙花苷、迷迭香酸色谱峰峰面积RSD分别为1.3%、0.94%、0.59%、1.5%、1.8%,表明供试品溶液在24 h内稳定。
2.2.4.5 色谱柱耐用性按“2.2.2”项下制备方法制备薄荷药材供试品溶液,分别用Waters Sunfire C18色谱柱(4.6 mm×250 mm,5 μm)、Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm)和Acchrom XAqua C18色谱柱(4.6 mm×250 mm,5 μm)测定各成分含量,计算其RSD分别为2.0%、0.54%、1.4%、0.99%、1.4%,结果表明该方法色谱柱耐用性良好。
2.2.4.6 准确度试验取已知含量的薄荷粉末0.05 g,精密称定,平行6份,加入一定量的对照品溶液,按“2.2.2”项下方法制备供试溶液,进样测定并计算各成分的平均加样回收率及RSD,结果见表 5。
|
|
表 5 准确度试验结果 Table 5 Experimental results of accuracy |
取10批薄荷药材,精密称定,按“2.2.2”项下方法制备薄荷药材供试品溶液,分别采用薄荷酚类对照提取物法和单体对照品法测定橙皮苷、香叶木苷、香蜂草苷、蒙花苷及迷迭香酸的含量,结果见表 6,表明对照提取物法与对照品法所得测定结果具有一致性。因此,薄荷酚类对照提取物可有效替代单体对照品进行薄荷质量评价。
|
|
表 6 10批薄荷药材含量测定结果(%) Table 6 The determined content of the mint samples |
本文在前期研究非挥发性薄荷酚类成分及其对照提取物制备方法的基础上,制备出含量明确的对照提取物,建立了基于薄荷酚类对照提取物的薄荷药材含量测定方法,并分别采用对照提取物法和对照品法对薄荷药材中橙皮苷、香叶木苷、香蜂草苷、蒙花苷及迷迭香酸的含量进行分析测定,结果显示对照提取物法与对照品法所得测定结果一致,表明对照提取物可替代单体对照品实现对薄荷药材的质量控制,且该质量控制模式更能满足实际需要,更符合中药多成分的特色。因此,今后可扩展薄荷酚类对照提取物的应用范围,替代单体对照品用于含薄荷的中药复方制剂的质量控制。
| [1] |
陆兔林, 翟为民, 蔡宝昌, 等. 对照提取物在中药质量控制中的应用[J]. 中国中药杂志, 2013, 38(3): 463. LU TL, ZHAI WM, CAI BC, et al. Application of reference extracts in quality control of traditional Chinese medicines[J]. China J Chin Mater Med, 2013, 38(3): 463. |
| [2] |
王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Multi-component quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
| [3] |
逄瑜, 孙磊, 金红宇, 等. 替代对照品法在中药多指标含量测定中的应用与技术要求探讨[J]. 药物分析杂志, 2013, 33(1): 169. PANG Y, SUN L, JIN HY, et al. Discussion on application and technical requirements of substitute reference substance method for simultaneous determination of multi-components in traditional Chinese medicine[J]. Chin J Pharm Anal, 2013, 33(1): 169. |
| [4] |
中华人民共和国药典2010年版. 一部[S]. 2010: 285 ChP 2010. Vol Ⅰ[S]. 2010: 285 |
| [5] |
中华人民共和国药典2015年版. 一部[S]. 2015: 304 ChP 2015. Vol Ⅰ[S]. 2015: 304 |
| [6] |
马玲云, 马双成. 中药标准物质的发展现状与展望[J]. 中国药事, 2010, 24(12): 1232. MA LY, MA SC. Development and prospect of TCM reference standards[J]. Chin Pharm Aff, 2010, 24(12): 1232. |
| [7] |
陈沛, 金红宇, 孙磊, 等. 对照提取物在中药整体质量控制中的应用[J]. 药物分析杂志, 2016, 36(2): 185. CHEN P, JIN HY, SUN L, et al. Application of extractive reference substance in holistic quality control of traditional Chinese medicine[J]. Chin J Pharm Anal, 2016, 36(2): 185. |
| [8] |
周文菊, 豆小文, 杨美华, 等. 薄荷及其饮片质量控制研究进展[J]. 中国中药杂志, 2016, 41(9): 1569. ZHOU WJ, DOU XW, YANG MH, et al. Quality control in Menthae Haplocalycis Herba and its decoction slices[J]. China J Chin Mater Med, 2016, 41(9): 1569. |
| [9] |
徐晶晶, 徐超, 刘斌. 一测多评法测定薄荷药材中4种黄酮苷的含量[J]. 中国药学杂志, 2014, 49(3): 234. XU JJ, XU C, LIU B. Simultaneous determination of four flavonoid glycosides in Mentha haplocalyx Briq.by a quantitative analysis of multi-components by single marker[J]. Chin Pharm J, 2014, 49(3): 234. |
| [10] |
钟昆芮, 张凡, 姜艳艳, 等. 薄荷总黄酮的纯化工艺优选[J]. 中国实验方剂学杂志, 2013, 19(6): 11. ZHONG KR, ZHANG F, JIANG YY, et al. Optimization of purification technology for total flavonoids from Mentha haplocalyx[J]. Chin J Exp Tradit Med Form, 2013, 19(6): 11. |
| [11] |
陈向阳, 张乐, 吴莹, 等. LCMS-IT-TOF法快速分析薄荷黄酮部位的主要化学成分[J]. 北京中医药大学学报, 2015, 38(8): 546. CHEN XY, ZHANG L, WU Y, et al. Rapid analysis of chemical compositions in the flavonoid fraction of Mentha haplocalyx Briq.with LCMS-IT-TOF[J]. J Beijing Univ TCM, 2015, 38(8): 546. |
| [12] |
徐晶晶, 刘斌. 基于DPPH、FRAP法的薄荷药材抗氧化谱效关系研究[J]. 北京中医药大学学报, 2015, 38(6): 405. XU JJ, LIU B. Spectrum-effect relation in antioxidant activity of Menthae Haplocalycis Herba based on DPPH and FRAP assay[J]. J Beijing Univ TCM, 2015, 38(6): 405. |
| [13] |
李岗, 余德顺, 杨军, 等. 超临界CO2萃取薄荷挥发油及其抗氧化能力的研究[J]. 食品科技, 2013, 38(1): 276. LI G, YU DS, YANG J, et al. The antioxidant capacity of volatile oil from Mentha haplocalyx by supercritical CO2 extraction method[J]. Food Sci Technol, 2013, 38(1): 276. |
| [14] |
陈智坤, 梁呈元, 李维林, 等. 薄荷不同溶剂提取物抗氧化活性的研究[J]. 食品工业科技, 2013, 34(3): 100. CHEN ZK, LIANG CY, LI WL, et al. Study on the antioxidant activity of different extracts from Mentha canadensis L.[J]. Sci Technol Food Ind, 2013, 34(3): 100. |
 2018, Vol. 38
2018, Vol. 38 
