2. 苏州大学, 苏州 215123;
3. 江苏省食品药品监督检验研究院, 南京 210008
2. Soochow University, Suzhou 215123, China;
3. Jiangsu Institute for food and drug control, Nanjing 215008, China
西洋参为五加科植物西洋参Panax quinquefolium L.的干燥根,又名花旗参。其味甘、苦,性凉,归心、肺、肾经,具有补气养阴,清热生津之功效[1]。近年来,在中药材的仓储过程中出现硫磺熏蒸中药材现象[2]。硫熏容易引起中药材的化学成分发生变化,对药材的功效有一定程度的影响[3-6]。西洋参为贵细药材,也存在硫熏现象,硫熏后的西洋参饮片色泽白晰水润,其外观优于未经硫磺熏蒸的西洋参,便于延长保存期。本文拟考察硫磺熏蒸对西洋参活性成分皂苷类的影响。
通过UPLC-梯度洗脱法测定硫熏和无硫组西洋参中人参皂苷Rg1、Re和Rb1三者的含量和总量,利用t检验分析,发现两者无显著性差异。但通过偏最小二乘法(partial least squares,PLS)对所得西洋参超高效液相色谱图进行统计分析,能够显示硫熏组西洋参与无硫组西洋参呈现明显分类,表明硫熏组与无硫组样本具有一定的差异性,且发现人参皂苷Re、Rb1、Rc和Rd等皂苷类成分受硫磺熏蒸影响,含量有所降低。
1 仪器与材料Waters UPLC超高效液相色谱仪,Empower 3工作站;Waters UPLC-Xevo G2 QTof液质联用系统,MassLynx 4.1工作站,Acquity BEH C18柱(2.1 mm×100 mm,1.7 μm;填料为十八烷基硅烷键合硅胶,Waters公司);梅特勒-托利多XS205DU电子天平;Millipore Milli-Q Reference纯水仪;
人参皂苷Rg1(批号110703-201128,含量为93.4%)、人参皂苷Re(批号110754-201123,含量为89.1%)、人参皂苷Rb1(批号110704-201223,含量为95.9%)、人参皂苷Rd(批号111818-2010001,含量为94.4%)均购自中国食品药品检定研究院。人参皂苷Rc(批号PS0903FA13,含量≥98%)购自上海源叶生物科技有限公司。34批样品经江苏省食品药品监督检验研究院狄恒建老师鉴定为五加科植物西洋参Panax quinquefolium L.药材,按中国药典2010年版第一增补本附录IX U二氧化硫残留量测定法测定其二氧化硫残留量,将34批样品分为无硫组和硫熏组,其中1~18号为无硫组样本,19~34号为硫熏组样本,详见表 1。
|
|
表 1 西洋参样品信息表 Table 1 Sample information of Panacis Quinquefolii Radix |
将西洋参供试品于60 ℃干燥2 h,粉碎成中粉,取约0.5 g,精密称定,置250 mL三角锥形瓶内,精密加甲醇50 mL,称定,水浴回流1.5 h,放冷,称定,用甲醇补足减失的量,摇匀,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.1.2 混合对照品储备液分别取人参皂苷Rg1、Re、Rb1的对照品适量,精密称定,置10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,制得质量浓度分别为241.91、749.33、1 583.31 μg·mL-1的混合对照品储备液。
2.1.2 色谱条件及系统适用性试验色谱柱:Acquity BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温:40 ℃;检测波长:203 nm;流速:0.5 mL·min-1;进样量:2 μL。以乙腈(A)-水(B)为流动相,梯度洗脱(0~6 min,19%A→20%A;6~17 min,20%A→60A%;17~18 min,60%A→100%A;18~19 min,100%A;19~20 min,100%A→19%A;20~22 min,19%A)。人参皂苷Rg1和人参皂苷Re分离度大于1.5,人参皂苷Rg1、Re、Rb1峰理论板数均超过250 000,见图 1。
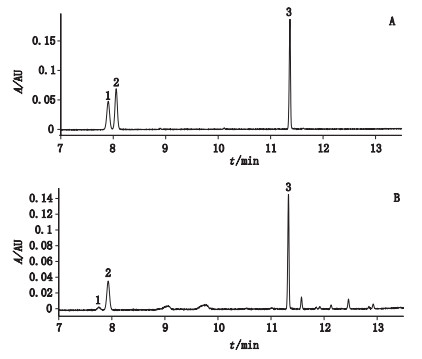
|
1.人参皂苷Rg1(ginsenoside Rg1)2.人参皂苷Re(ginsenoside Re)3.人参皂苷Rb1(ginsenoside Rb1) 图 1 人参皂苷Rg1、Re、Rb1混合对照品(A)和西洋参供试品(B)的UPLC色谱图 Figure 1 UPLC chromatograms of mixed reference substances(A) and sample of Panacis Quinquefolii Radix (B) |
精密吸取混合对照品溶液适量,用甲醇稀释10倍,制得人参皂苷Rg1、Re、Rb1质量浓度分别为24.19、74.93、158.33 μg·mL-1的混合对照品溶液,连续进样6次,测定峰面积值,RSD分别为1.0%、0.20%、0.30%,表明精密度良好。
2.1.4 标准曲线和线性范围取“2.1.1.2”项下人参皂苷Rg1、Re、Rb1混合对照品储备液适量,用甲醇逐步稀释,使人参皂苷Rg1的系列质量浓度分别为12.10、24.19、72.57、120.95、241.91 μg·mL-1,度分别为79.17、158.33、474.99、791.65、1583.31 μg·mL-1。人参皂苷Re的系列浓度分别为37.47、74.93、224.80、374.67、749.33 μg·mL-1,人参皂苷Rb1的系列质量浓进样2 μL,以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标进行线性回归,得回归方程,结果见表 2。
|
|
表 2 人参皂苷Rg1、Re、Rb1回归方程和线性范围 Table 2 The regression equation and the linear ranges of ginsenoside Rg1, Re and Rb1 |
称取西洋参供试品(批号130427-3),共6份,每份约0.5 g,精密称定,按照“2.1.1.1”项下方法制备供试品溶液,按照“2.1.2”项下条件测定峰面积,计算样品中人参皂苷Rg1,Re,Rb1的平均质量分数分别为0.17%、1.37%、2.98%,RSD分别为2.4%、2.0%、2.6%。
2.1.6 稳定性试验称取西洋参供试品(批号130427-3),按“2.1.1.1”项下方法制备供试品溶液,分别于0、2、4、8、12、24 h按“2.1.2”色谱条件进样,测定人参皂苷Rg1、Re、Rb1峰面积,RSD为2.8%、2.0%、2.6%,表明西洋参供试品溶液在24 h内测定稳定性良好。
2.1.7 加样回收试验称取西洋参供试品(批号130427-3),每份约0.25 g,精密称定,共6份,精密加入人参皂苷Rg1、Re、Rb1混合对照品溶液50 mL(人参皂苷Rg1对照品的加入量为436.03 μg,人参皂苷Re对照品的加入量为1 554 μg,人参皂苷Rb1对照品的加入量为5 249.57 μg),按照“2.1.1.1”项下方法制备供试品溶液并测定。计算得到人参皂苷Rg1的平均加样回收率为98.8%,RSD为3.2%;人参皂苷Re的平均加样回收率为98.3%,RSD为2.9%;人参皂苷Rb1的平均加样回收率为98.1%,RSD为2.4%。
2.1.8 34批西洋参甲醇提取液的特征图谱采集和人参皂苷Rg1、Re、Rb1的含量测定取34批西洋参供试品,按“2.1.1.1”项下方法制备供试品溶液,按“2.1.2”项条件进样,采集并记录液相色谱图,结果见图 2和表 3。
|
|
表 3 西洋参供试品中人参皂苷Rg1、Re、、Rb1的含量(%,n=2) Table 3 The contents of ginsenosides Rg1, Re and Rb1 in Panacis Quinquefolii Radix |
中国药典2015年版一部西洋参含量测定项下规定,含人参皂苷Rg1、Re、Rb1的总量不得少于2.0%,表 3结果表明,无硫组西洋参与硫熏组西洋参人参皂苷Rg1、Re、Rb1的总量均符合规定。人参皂苷Rg1、Re、Rb1的含量及总量以x±SD表示,采用SPSS软件22版t检验统计,结果显示硫熏组西洋参人参皂苷Rg1、Re、Rb1的含量及总量与无硫组西洋参比较,均无显著性差异。见表 4。
|
|
表 4 硫熏组与无硫组西洋参人参皂苷Rg1,Re,Rb1的含量及总量比较(%,x±SD) Table 4 Comparison of the contents of ginsenoside Rg1, Re and Rb1 between sulfur-fumigated and non-fumigated Panacis Quinquefolii Radix |
34批样品中18批为未经硫磺熏蒸的西洋参;16批为硫磺熏蒸的西洋参。在18批未经硫磺熏蒸的西洋参组中随机抽取12批西洋参,建立校正集模型;剩余6批作为预测样本。在16批硫磺熏蒸的西洋参组中随机抽取10批西洋参,建立校正集模型,剩余6批作为预测样本,如表 5所示。
|
|
表 5 样品组成 Table 5 The constituents of samples |
将西洋参UPLC-UV指纹图谱从Waters Empower 3工作站导出原始数据,即保留时间-响应值。如图 2-A所示,保留时间tR0~7.4 min处,为C18柱上不保留的西洋参强极性成分,且此段tR区间绝大多数时间处的UV响应值接近检出限,故将tR为0~7.4 min的数据去除。同时,17 min后为梯度结束时的洗柱时间,故tR > 17 min处的数据也去除,tR 7.4~17 min的原始数据(见图 2-B),将其转换为m文件后导入Matlab 6.5.1(MathWorks Corp,USA)进行数据处理。在分类模型建立前,对数据进行浓度归一化与均值中心化处理。
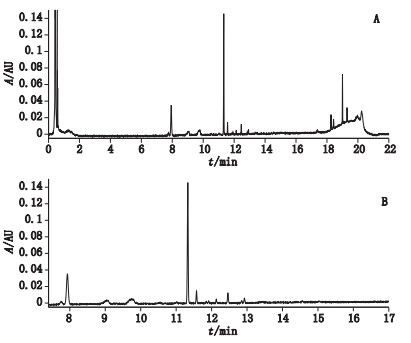
|
A. 0~22 min色谱图(0-22 min UPLC chromatogram of Panacis Quinquefolii Radix)B.7.4~17 min色谱图(7.4-17 min UPLC chromatogram of Panacis Quinquefolii Radix) 图 2 西洋参UPLC色谱图 Figure 2 The UPLC chromatograms of Panacis Quinquefolii Radix |
以PLS方法建立硫熏组与无硫组西洋参之间的分类模型。分类图中“△”代表硫熏组西洋参,“○”代表无硫组西洋参;黑色代表校正集,红色代表预测集。从分类图(图 3-A)中可以看出,硫熏组西洋参与无硫组西洋参校正集样本呈现明显分类。由于样品16(批号210081)和样品13(批号120919003)2批无硫组西洋参样本(图 3-A中箭头指示的样本)过度偏离相应的校正集样本范围,对PLS分类模型干扰较大,故将其剔除。剔除这2批样本后的PLS分类图如图 3-B所示,从图 3-B中可以看出硫熏组与无硫组的校正集样本呈现明显分类,且相应的预测集样本也能够很好地分布在相应的校正集样本附近,说明本文所建的PLS分类模型准确可靠,同时两类样本呈现分开趋势,表明硫熏组与无硫组样本具有一定的差异性。
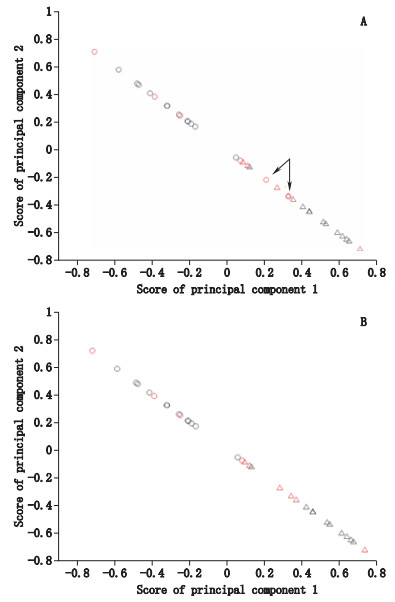
|
△.硫熏组样本(sulfur-fumigated sample)○.无硫组样本(non-fumigated sample) 黑色为校正集,红色为预测集(black represents calibration samples,red represents prediction samples) A. 34批西洋参样本PLS分类模型(PLS classification models from 34 batches of test samples of Panacis Quinquefolii Radix)B.剔除干扰样本后的西洋参样本PLS分类模型(PLS classification model from test samples of Panacis Quinquefolii Radix after eliminating interference samples) 图 3 西洋参样本的PLS分类模型图 Figure 3 PLS classification model of the test samples of Panacis Quinquefolii Radix |
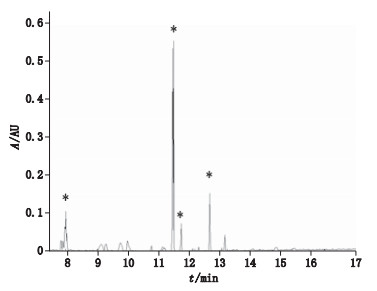
PLS分类模型显示硫熏组西洋参和无硫组西洋参存在明显分类,说明硫熏组与无硫组样本有一定的差异性。为了寻找对分类模型贡献较大的色谱组分,即硫磺熏蒸对西洋参有影响的皂苷类成分,获得了分类模型相对应的载荷图(图 4),并根据载荷图获得每个保留时间处的色谱组分对分类的贡献率图(图 5)。从图 5中可以看出对分类贡献较大tR为8、11.3、11.5、12.5 min,该4处tR的色谱组分为贡献较大的组分。
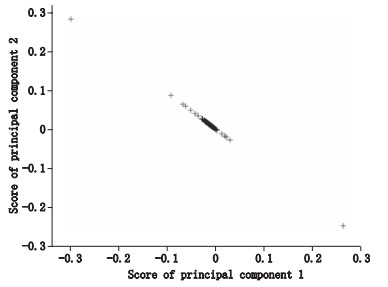
|
图 4 PLS分类模型的载荷图 Figure 4 Loadings on principal component 1 and 2 for building PLS classification model |
|
*标记代表对分类贡献大的色谱峰(peaks marked by * contributed much to the classification) 图 5 西洋参人参皂苷组分对PLS分类模型的贡献率 Figure 5 Contribution degree of ginsenosides of Panacis Quinquefolii Radix for building PLS classification models |
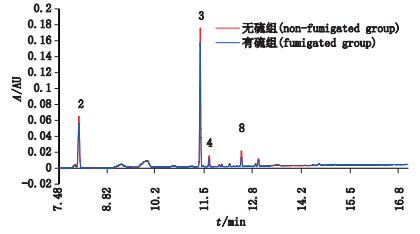
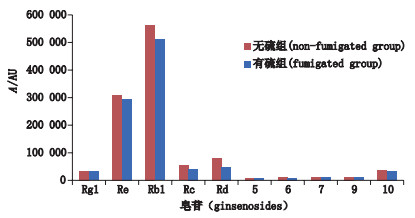
将18批无硫组的西洋参样本和16批硫熏组西洋参样本所有保留时间点的信号响应值求平均值,绘制7.4~17 min平均色谱图,比较两色谱图的差异,如图 6所示。结果表明,硫熏组西洋参样本的响应值低于无硫组样本,特别是2、3、4、8号色谱峰,差异性更加显著。与贡献率图所得判断结果一致。2号色谱峰为人参皂苷Re,3号色谱峰为人参皂苷Rb1,4号、8号色谱峰经UPLC-Q-TOF-MS/MS确证,分别为人参皂苷Rc和Rd。根据图 6提示,本文将18批无硫组西洋参和16批硫熏组西洋参中分离良好的10个皂苷成分的平均峰面积进行比较(峰面积除以称样量,保证在同一称量水平上),见图 7,可见人参皂苷Re、Rb1、Rc和Rd平均峰面积,硫熏组较无硫组降低。以上结果说明硫磺熏蒸后会导致西洋参中的人参皂苷Re、Rb1、Rc、Rd的含量降低。
|
2.人参皂苷Re(ginsenoside Re)3.人参皂苷Rb1(ginsenoside Rb1)4.人参皂苷Rc(ginsenoside Rc)8.人参皂苷Rd(ginsenoside Rd) 蓝色:16批硫熏西洋参样本的平均色谱图(the average chromatogram of 16 batohesof sulfur-fumigated Panacis Quinquefolii Radix)红色:18批无硫西洋参样本的平均色谱图(the average chromatogram of 18 batohesof non-fumigated Panacis Quinquefolii Radix) 图 6 西洋参样本的平均色谱图 Figure 6 The average chromatograms of the test samples |
|
图 7 硫熏组与无硫组西洋参中10种皂苷平均峰面积比较图 Figure 7 Comparison of the average peak areas of 10 ginsenosides between sulfur-fumigated and non-fumigated Panacis Quinquefolii Radix |
色谱柱为HSS T3柱(2.1 mm×100 mm,1.8 μm),柱温40 ℃,流速0.4 mL·min-1,进样量3 μL,流动相A为乙腈,流动相B为水,采用二元梯度洗脱,洗脱程序同“2.1.2”。
2.3.1.2 质谱条件Xevo G2 Q-Tof MS/MS系统,ESI负离子模式,离子源温度为120 ℃,毛细管电压2.0 kV,雾化气温度450 ℃,雾化气流速900 L·h-1,锥孔气流速50 L·h-1,采集模式MSE,碰撞能30 eV,质量扫描范围为m/z 100~1 200。
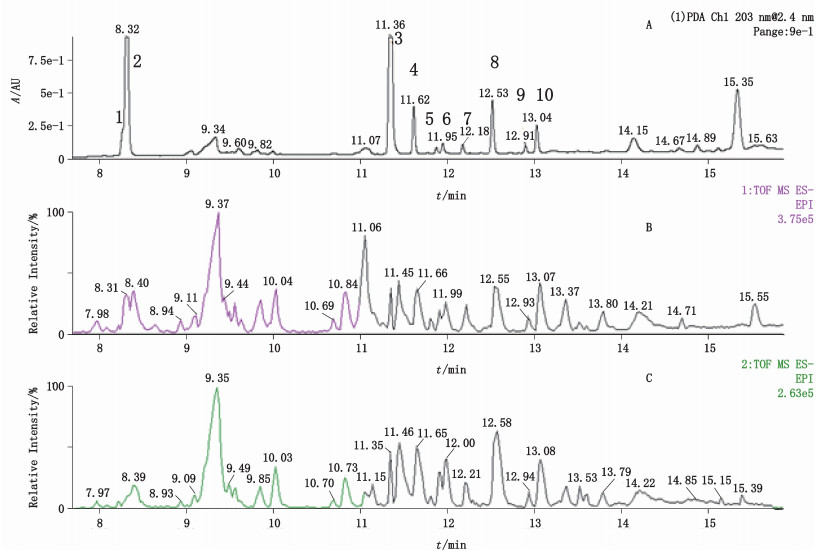
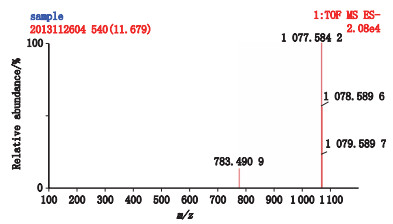
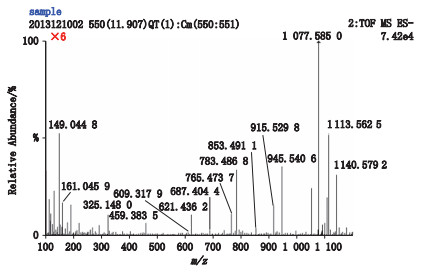
2.3.2 质谱确证结果4号峰在液相色谱图上的出峰时间为11.62 min,在总离子流图上的出峰时间为11.66 min,见图 8;[M-H]- m/z为1 077.584 2,见图 9;分子式推断为C53H90O22。其二级碎片离子有m/z 945.540 6、915.529 8、783.486 8、765.473 7、621.436 2、459.383 5,见图 10。因出现m/z 459.383 5的原人参二醇皂苷元特征碎片离子,推断其为原人参二醇型皂苷[7]。m/z 945.540 6推断为[M-(Ara-H2O)-H]-,母离子失去1个脱水的五碳糖(阿拉伯呋喃糖Ara)所致;m/z 915.529 8推断为[M-(Glu-H2O)-H]-,母离子失去1个脱水的葡萄糖基所致;m/z 783.4868推断为[M-(Glu-H2O)-(Ara-H2O)-H]-,母离子失去1个脱水的葡萄糖基和1个脱水的阿拉伯呋喃糖基所致;m/z 765.473 7推断为[M-(Glu-H2O)-(Ara-H2O)-H2O-H]-;m/z 459.383 5推断为[M-3(Glu-H2O)-(Ara-H2O)-H]-,母离子失去3个脱水的葡萄糖基和1个脱水的阿拉伯呋喃糖基得到的原人参二醇皂苷元特征碎片离子。推断该化合物为含有3个葡萄糖基和1个五碳糖基的原人参二醇型皂苷,经与对照品比较,确定4号峰为人参皂苷Rc。
|
A. 203 nm液相色谱图(UPLC-UV chromatogram at 203 nm) B. MSE一级质谱基峰色谱图(the basic peak chromatogram of MS scan) C. MSE二级质谱基峰色谱图(the BPC of MS/MS scan of methanol extract from Panacis Quinquefolii Radix) 图 8 2013121002号西洋参供试品甲醇提取物液质联用分析色谱图 Figure 8 The LC-MS chromatograms of methanol extract from Panacis Quinquefolii Radix sample No. 2013 12 1002 |
|
图 9 西洋参甲醇提取液4号峰一级质谱图 Figure 9 MS spectrum of peak 4 of methanol extract from Panacis Quinquefolii Radix |
|
图 10 西洋参甲醇提取液4号峰二级质谱图 Figure 10 MS/MS spectrum of peak 4 of methanol extract from Panacis Quinquefolii Radix |
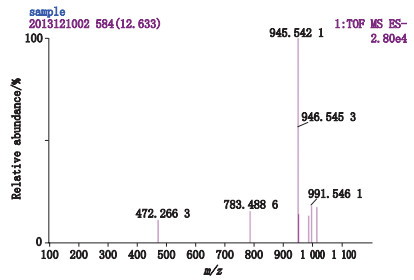
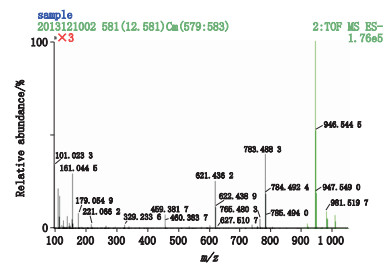
8号峰在液相色谱图上的出峰时间为12.53 min,在总离子流图上的出峰时间为12.55 min,见图 8;[M-H]-为m/z 945.542 1,见图 11;分子式推断为C48H82O18。其二级碎片离子有m/z 783.488 3、765.480 3、621.436 2、459.381 7,见图 12;因出现m/z 459.381 7的原人参二醇皂苷元特征碎片离子,推断其为原人参二醇型皂苷。m/z 783.488 3推断为[M-(Glu-H2O)-H]-,母离子失去1个脱水的葡萄糖基所致;m/z 765.480 3推断为[M-(Glu-H2O)-H2O-H]-,母离子失去1个脱水的葡萄糖基和一分子水所致;m/z 621.436 2推断为[M-2(Glu-H2O)-H]-,母离子失去2个脱水的葡萄糖基所致;m/z 459.381 7推断为[M-3(Glu-H2O)-H]-,母离子失去3个脱水的葡萄糖基得到的原人参二醇皂苷元特征碎片离子。因此推断该化合物为含有3个葡萄糖的原人参二醇型皂苷,经与对照品比较,确定8号峰为人参皂苷Rd。
|
图 11 西洋参甲醇提取液8号峰一级质谱图 Figure 11 MS spectrum of peak 8 of methanol extract from Panacis Quinquefolii Radix |
|
图 12 西洋参甲醇提取液8号峰二级质谱图 Figure 12 MS/MS spectrum of peak 8 of methanol extract from Panacis Quinquefolii Radix |
本文通过UPLC梯度洗脱,记录了西洋参甲醇提取液特征图谱,拟比较硫磺熏蒸对西洋参皂苷类成分的影响。将18批无硫西洋参甲醇提取液超高效液相色谱图原始数据导入中药色谱指纹图谱相似度评价系统软件(2004A版,均值法)合成无硫西洋参对照图谱(图 13)[8],取16批硫熏西洋参超高效液相色谱图与无硫西洋参对照指纹图谱比较,结果显示16批硫熏西洋参的超高效液相色谱图和无硫西洋参合成的对照指纹图谱相似度均在0.99以上,二者没有明显的成分差异。通过测定西洋参特征组分人参皂苷Rg1、Re和Rb1总量,显示硫磺熏蒸后人参皂苷Rg1、Re和Rb1总量均符合中国药典规定,t检验结果表明,硫熏组与无硫组西洋参人参皂苷Rg1、Re和Rb1含量及总量均无显著性差异;但通过偏最小二乘法统计分析,能够清晰地显示硫熏组西洋参与无硫组西洋参呈现明显分类,表明硫熏组与无硫组样本具有一定的差异性,且发现人参皂苷Re、Rb1、Rc和Rd是造成分类的主要皂苷成分,硫磺熏蒸后含量均有所降低。
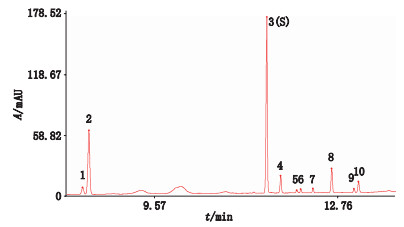
|
图 13 18批非硫熏西洋参合成的无硫西洋参对照指纹图谱 Figure 13 The fingerprint chromatogram of non-fumigated Panacis Quinquefolii Radix |
PLS是一种新型的多元统计数据分析方法[9-10],该方法集多元线性回归分析、典型相关分析和主成分分析的基本功能于一体,通过在变量系统中提取若干个对系统具有最佳解释功能的综合信息变量,实现对高维数据空间的降维处理;能够在自变量存在严重多重相关性和样本点个数少于变量个数的条件下进行回归建模,在最终模型中将包含原有的所有自变量,回归模型更易于辨识系统信息与噪音;与普通多元线性回归和主成分回归相比,具有简单、稳健、计算量小,预测精度高,无需剔除任何解释变量的特点。在样本量充足的前提下,将偏最小二乘法运用于中药材特征指纹图谱的统计分析[11-13],能够为硫熏中药材化学成分差异研究提供一个较好的研究思路和研究模式。
3.3 硫熏导致西洋参人参皂苷降低的原因探讨硫磺熏蒸产生的二氧化硫气体遇水能够生成亚硫酸,再遇空气能够氧化生成硫酸。亚硫酸可与苷类成分发生水解反应,也可与苷类成分上的醇羟基发生酯化反应,生成亚硫酸酯,从而使含量降低;硫酸可与人参皂苷的醇羟基发生磺化反应,有文献报道[14-15]人参经过硫熏后生成磺酸化人参皂苷Re和磺酸化人参皂苷Rb1,推测西洋参硫熏后可能也容易使人参皂苷Re、Rb1、Rc和Rd发生磺化反应,从而引起含量的降低,该工作值得进一步深入研究。本次实验结果表明,硫磺熏蒸西洋参能够引起人参皂苷Re、Rb1、Rc和Rd含量降低,影响西洋参品质,因此不提倡硫磺熏蒸西洋参,建议采用更为科学合理的存贮方法来延长西洋参的保质期和保持其品质。
| [1] |
中国药典2015年版. 一部[S]. 2015: 132 ChP 2015. VolⅠ[S]. 2015: 132 |
| [2] |
刘静静, 刘晓, 李松林, 等. 硫磺熏蒸中药材及饮片的研究现状[J]. 中草药, 2010, 41(8): 1043. LIU JJ, LIU X, LI SL, et al. Current situation in studies on traditional Chinese medicinal materials and Yinpian by sulfur-fumigated process[J]. Chin Tradit Herb Drugs, 2010, 41(8): 1043. |
| [3] |
陆兔林, 宁子琬, 单鑫, 等. 硫磺熏蒸对中药材化学成分和药理作用影响的研究进展[J]. 中国中药杂志, 2014, 39(15): 2796. LU TL, NING ZW, SHAN X, et al. Research situation of effects of sulfur fumigation on quality of traditional Chinese medicine[J]. China J Chin Mater Med, 2014, 39(15): 2796. |
| [4] |
MA XQ, LEUNG AKM CHAN CL, et al. UHPLC UHD Q-TOF MS/MS analysis of the impact of sulfur fumigation on the chemical profile of Codonopsis Radix(Dangshen)[J]. Analyst, 2014, 139: 505. DOI:10.1039/C3AN01561K |
| [5] |
蔡皓, 乔凤仙, 裴科, 等. UHPLC-Q-TOF/MS和化学计量学方法分析川芎硫磺熏蒸前后化学成分的变化[J]. 质谱学报, 2017, 38(1): 127. CAI H, QIAO FX, PEI K, et al. Investigation into differences of chemical constituents between sun-dried and sulfur-fumigated Chuanxiong Rhizoma based on UHPLC-Q-TOF MS and chemometric analysis[J]. J Chin Mass Spectrom Soc, 2017, 38(1): 127. |
| [6] |
李友连, 王珊, 朱晶晶, 等. 硫磺熏蒸对亳菊化学成分的影响[J]. 中国中药杂志, 2015, 40(13): 2624. LI YL, WANG S, ZHU JJ, et al. Study on effects of sulfur fumigation on chemical constituents of Chrysanthemum morifolium cv.Boju[J]. China J Chin Mater Med, 2015, 40(13): 2624. |
| [7] |
杨琳, 缪宇, 殷惠军, 等. LC-ESI-MSn法鉴定心悦胶囊中西洋参皂苷类成分[J]. 中草药, 2010, 41(12): 1942. YANG L, MIAO Y, YIN H, et al. Identification of gingsenosides from Panax quinquefolius in Xinyue capsules by LC-ESI-MSn[J]. Chin Tradit Herb Drugs, 2010, 41(12): 1942. |
| [8] |
张丹, 吴兰芳, 王乾, 等. 不同产地西洋参药材中8种皂苷类成分含量测定及指纹图谱研究[J]. 中药材, 2016, 39(10): 2306. ZHANG D, WU LF, WANG Q, et al. Research of the fingerprint and determination of 8 ginsenosides in Panax quinquefolius originated from different regions[J]. J Chin Med Mater, 2016, 39(10): 2306. |
| [9] |
王露露, 孙倩怡, 杨慧海, 等. 模式识别及其在中药质量评价中的应用[J]. 中草药, 2016, 23(12): 4282. WANG LL, SUN QY, YANG HH, et al. Pattern recognition and its application in quality assessment of Chinese material medica[J]. Chin Tradit Herb Drugs, 2016, 23(12): 4282. |
| [10] |
刘文慧, 李雨, 纪玉佳, 等. 偏最小二乘在中药药性判别中的应用[J]. 山东大学学报(医学版), 2012, 50(1): 151. LIU WH, LI Y, JI YJ, et al. Partial least squares in the discrimination of traditional Chinese herbal medicine property[J]. J Shangdong Univ(Health Sci), 2012, 50(1): 151. |
| [11] |
朱尔一. 一种适合用于处理中药指纹图谱数据的偏最小二乘法[J]. 计算机与应用化学, 2005, 22(8): 639. ZHU EY. A kind of PLS method suitable to deal with the fingerprinting data of traditional Chinese medicine[J]. Comput Appl Chem, 2005, 22(8): 639. |
| [12] |
熊淑雯, 章开, 陈东, 等. 指纹图谱技术结合PLS-DA在黄连上清丸质量控制中的应用[J]. 南昌大学学报(医学版), 2015, 55(6): 15. XIONG SW, ZHANG K, CHEN D, et al. Application of fingerprint and PLS-DA in quality control of Huanglian Shangqing pills[J]. J Nanchang Univ(Med Sci), 2015, 55(6): 15. |
| [13] |
陈卫, 刘林生, 顾炳仁, 等. 基于代谢组学的天舒胶囊质量评价与控制[J]. 中国药房, 2014, 25(35): 3313. CHEN W, LIU LS, GU BR, et al. Quality evaluation and control of Tianshu capsules based on Omics[J]. China Pharm, 2014, 25(35): 3313. DOI:10.6039/j.issn.1001-0408.2014.35.17 |
| [14] |
周珊珊, 徐金娣, 沈红, 等. UPLC-Q-TOF-MS/MS结合对照药材法快速筛查硫磺熏蒸商品人参[J]. 中国中药杂志, 2014, 39(15): 2807. ZHOU SS, XU JD, SHEN H, et al. Development of UPLC-Q-TOF-MS/MS combined with reference herb approach to rapidly screen commercial sulfur-fumigated ginseng[J]. China J Chin Mater Med, 2014, 39(15): 2807. |
| [15] |
JIN X, ZHU LY, SHEN H, et al. Influence of sulphur-fumigation on the quality of white ginseng:a quantitative evaluation of major ginsengsides by high performance liquid chromatography[J]. Food Chem, 2012, 135: 1141. DOI:10.1016/j.foodchem.2012.05.116 |
 2018, Vol. 38
2018, Vol. 38 
