中药栀子是茜草科植物栀子(Gardenia jasminoides Ellis)的干燥成熟果实,其主要成分为栀子苷(geniposide),又称为京尼平苷,属于环烯醚萜苷类成分,其苷元为京尼平[1]。现代药理学研究表明栀子苷具有抗炎[2-3]、保肝[4-5]、抗氧化[6]等作用,近年来对其在治疗脑血管疾病,如脑缺血保护[7-8]及治疗阿尔兹海默病[9-10]等方面也有了一定的研究。
微透析是近年来迅速发展的一种生物活体取样技术,它能够在不破坏生物体内环境的前提下,实现对生物体细胞间隙内源性和外源性物质的直接取样[11]。该技术基于透析的原理[12-13],将具有半透膜尖端的探针植入到相应组织或部位,用微量注射泵灌注灌流液,内源性和外源性小分子物质能够沿浓度梯度扩散到半透膜的另一侧,而蛋白质、酶等大分子则无法透过,收集的样品可以不经预处理直接进行测定,计算透析液中的药物或者内源性物质的浓度,再通过对探针体内外回收率进行系统性的研究,根据回收率来计算目标组织或部位细胞间隙游离的药物以及内源性物质的浓度,以完成后续药代动力学、药效动力学的研究[14]。栀子苷作为一种常用的、有多方面药理作用的中药成分,关于其微透析及回收率方面的研究,目前文献报道较少,为了进一步研究栀子苷的脑细胞间液药代动力学及其与血液药代动力学相关性,本文对栀子苷的脑、血微透析探针体内外回收率开展了研究。
1 仪器与材料 1.1 仪器API4000 Q-TRAP型三重四极杆串联质谱仪,配有Turbo VTM离子源仓、离子喷雾和大气压电离离子源及Analysis 1.4.2数据处理系统(Applied Biosystem公司);SYMBIOSISTM PICO在线固相萃取SPE-LC联用系统(Spark Holland公司);色谱柱为Waters Symmetry C18(150 mm×2.1 mm,5 μm;填料为十八烷基硅烷键合硅胶,Waters公司);CMA 12/4 mm脑微透析探针及套管、CMA 20/10 mm血液微透析探针、CMA 402微透析泵(CMA公司);68001型大鼠立体定位仪(Stoelting公司);MS1 Minishaker涡流混合器(IKA公司);B5200S-DT型超声清洗机[必能信超声(上海)有限公司];AG-245分析天平(Mettler Toledo公司);Integral 3型超纯水系统(Millipore公司)。
1.2 材料与试剂栀子苷对照品(中国食品药品检定研究院,批号110749-201316,20 mg,含量97.5%);玻璃离子体水门汀(上海医疗器械股份有限公司);肝素钠注射液(临用前用生理盐水配成体积分数2%的溶液,常州千红生化制药股份有限公司,批号150911,规格2 mL/12 500单位);复方氯化钠注射液(林格氏液,华润双鹤药业股份有限公司,批号D201407173,规格500 mL);甲醇、乙腈(色谱纯,Merk公司);甲酸(色谱纯,J.T.BAKER公司);娃哈哈饮用纯净水(用于流动相配制,杭州娃哈哈集团有限公司);超纯水(用于微透析实验);其他试剂均为市售分析纯。
1.3 实验动物SPF级SD大鼠,雄性,240~280 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001。本实验均符合北京实验动物福利伦理审查指南的相关要求。
2 方法与结果 2.1 分析条件 2.1.1 质谱条件电喷雾离子化(ESI);正离子检测;多反应监测(MRM);离子喷射电压5.5 kV;源内气体1:0.28 MPa;源内气体2:0.34 MPa;源内温度550 ℃;气帘气体:0.1 MPa;用于定量的栀子苷的离子通道为m/z 406.200~227.100。
2.1.2 色谱条件采用外标法定量,色谱柱为Waters Symmetry C18(150 mm×2.1 mm,5 μm),流动相A为水-甲醇-乙腈(9:0.5:0.5,0.01%甲酸),B为甲醇-乙腈(1:1,0.01%甲酸,1%水),梯度洗脱(0~0.2 min,63%A;0.2~1 min,63%A→30%A;1~4.8 min,30%A;4.8~6.8 min,30%A→63%A),流速为0.23 mL·min-1,柱温25 ℃,进样器温度4 ℃,进样10 μL。
2.2 溶液的配制 2.2.1 对照品溶液取栀子苷对照品约4 mg,精密称定,置1.5 mL离心管中,精密加入甲醇1 mL,涡旋混合,得相应浓度的栀子苷甲醇溶液,用甲醇稀释为10 μg·mL-1的栀子苷溶液,再用甲醇将10 μg·mL-1的栀子苷溶液依次稀释成栀子苷质量浓度为5 000、4 000、1 000、250、120和40 ng·mL-1的对照品储备液,临用前分别以林格氏液将上述6个质量浓度的对照品储备液稀释10倍,得质量浓度为500、400、100、25、12和4 ng·mL-1的栀子苷对照品溶液。
2.2.2 供试品溶液取栀子苷对照品约5 mg,精密称定,置50 mL量瓶中,加林格氏液溶解后定容至刻度,得100 μg·mL-1栀子苷溶液,再用林格氏液将其稀释成质量浓度分别为1 000、500、200、100、50 ng·mL-1的微透析实验用栀子苷溶液,临用前新鲜配制。
2.2.3 样品处理取25 μL的栀子苷对照品溶液、微透析实验用栀子苷溶液及微透析样品,分别加入等体积的40%甲醇,涡旋混匀后进样10 μL。
2.3 脑、血液微透析探针的植入 2.3.1 脑微透析探针大鼠腹腔注射4%的水合氯醛(10 mL·kg-1)麻醉,备皮,切开头部囟门附近的皮肤,钝性分离皮下组织并擦净,暴露骨面。用立体定位仪固定大鼠头部,找出纹状体对应的点(前囟前后+0.05 cm,中缝左右-0.30 cm,颅骨平面上下-0.40 cm)并用牙科钻打孔,在钻孔点植入脑微透析探针套管,另钻两孔拧入螺丝钉,用牙科水泥将套管连同2个螺钉一并固定。待牙科水泥牢固后,松开立体定位仪,洒入少量注射用青霉素钠粉末,手术区域前后各缝皮1针。术后观察24 h,正常进水进食。实验时先将探针置于超纯水中浸泡约30 min后,以林格氏液或者一定浓度的微透析实验用栀子苷溶液灌流,排出气泡;取出已植入的探针套管的假针,小心插入准备好的微透析探针,以一定的灌流速度,开始微透析[15]。
2.3.2 血液微透析探针首先将血液探针置于超纯水中浸泡约30 min,之后置于2%肝素钠溶液中,以2 μL·min-1的流速灌流2%肝素钠约30 min。大鼠腹腔注射4%水合氯醛(10 mL·kg-1)麻醉,在腹部中线靠左约0.5 cm、锁骨附近,备皮,纵向剪口约1.5 cm,找出并钝性分离颈静脉,结扎远心端,在远心端剪一小口,将血液探针朝心脏方向插入约2.4 cm,与两旁的肌肉组织缝合以固定探针,缝皮;继续以2 μL·min-1的流速灌流2%肝素钠溶液约30 min,之后灌流液更换为林格氏液或者一定浓度的微透析实验用栀子苷溶液,以一定的灌流速度,开始微透析[16]。
2.4 专属性试验和基质效应 2.4.1 专属性试验大鼠植入脑、血微透析探针并开始微透析,分别以1.5 μL·min-1的流速灌流林格氏液,各自平衡60 min后,收集空白脑、血微透析液;之后灌流质量浓度为100 ng·mL-1的微透析实验用栀子苷溶液,各自平衡60 min后,收集脑、血微透析液。样品处理后进行测定,结果见图 1。结果表明栀子苷的峰形良好,保留时间约2.8 min,脑、血空白透析液中未见影响栀子苷测定的干扰物。

|
A.空白脑微透析液(blank brain microdialysis sample)B.含药脑微透析液(brain microdialysis sample containing geniposide)C.栀子苷对照品溶液(100 ng·mL-1geniposide standard solution)D.空白血液微透析液(blank blood microdialysis sample)E.含药血液微透析液(blood microdialysis sample containing geniposide) 图 1 大鼠微透析样品中栀子苷测定的HPLC-MS/MS图 Figure 1 HPLC-MS/MS chromatograms of geniposide in rats microdialysis samples |
取6只SD大鼠,分别各自植入微透析探针并开始微透析,分别以1.5 μL·min-1的流速灌流林格氏液,各自平衡60 min后,收集空白微透析液适量。分别精密吸取20 μL质量浓度为120、1 000、4 000 ng·mL-1的栀子苷对照品储备液(每个浓度分2组,每组6份),分别加入180 μL的林格氏液、空白微透析液,涡旋混匀,样品处理后进行测定,分别记录峰面积为A1、A2,计算基质效应,见表 1。结果说明,微透析液中的栀子苷基本无基质效应。
|
|
表 1 栀子苷基质效应(n=6) Table 1 Matrix effect of geniposide |
取质量浓度为4、12、25、100、400、500 ng·mL-1的栀子苷对照品溶液,按“2.2.3”项下方法处理后依次进样分析,以各成分的峰面积(Y)为纵坐标,质量浓度(X)为横坐标,按(1/X2)加权线性回归,得栀子苷回归方程:
Y=2 420 X-1 770 r=0.999 6
线性范围4~500 ng·mL-1,定量下限为4 ng·mL-1(S/N > 10)。
2.6 精密度和准确度试验依次制备低中高(12、100、400 ng·mL-1)3个质量浓度的栀子苷对照品溶液,按“2.2.3”项下方法处理后进行测定,1 d内平行操作5次考察日内精密度和准确度,连续3 d考察日间精密度和准确度,精密度和准确度分别用RSD和RE表示,见表 2。
|
|
表 2 栀子苷精密度和准确度测定结果(n=5) Table 2 Precision and accuracy results of geniposide |
取质量浓度依次为12、100、400 ng·mL-1的栀子苷对照品溶液,每个浓度5份,按“2.2.3”项下方法处理后进行测定,12 h后再次测定,考察12 h稳定性。另取低中高3个浓度的栀子苷对照品溶液,每个浓度5份,在-80 ℃条件下放置3个月后,按“2.2.3”项下方法处理后进行测定,考察3个月稳定性,见表 3。结果表明微透析液中的栀子苷在12 h(4 ℃)和3个月(-80 ℃)内相对稳定。
|
|
表 3 栀子苷稳定性试验(n=5) Table 3 Stability test of geniposide |
按照“2.2.1”项下制备2 μg·mL-1的栀子苷甲醇溶液,以林格氏液稀释10倍,平行测定5个样品,样品处理后进行测定,用质量浓度计算RSD,结果显示在稀释10倍后,栀子苷的RSD为4.8%,准确度分别为91.3%、93.1%、91.4%、96.4%和85.0%,证明稀释10倍后测定的结果可靠。
2.9 脑、血液微透析探针回收率试验微透析探针回收率一般有2种常用的测定方法:正透析法(增量法)和反透析法(减量法),正透析法能够反映透析针的真实回收率,反透析法则用于评价体内回收率和真实回收率的一致性。在实验过程中探针的回收率受到很多因素的影响,本实验选择灌流速度、浓度、探针使用次数等因素,考察脑、血微透析探针体内和体外回收率。
2.9.1 体内回收率稳定性考察体内药代动力学实验一般需要持续较长的时间,这就需要同一根探针几个小时甚至几十个小时连续取样,取样过程中回收率如果变化不定,就无法得到真实可靠的实验结果。因此,对脑、血液微透析探针体内回收率的稳定性进行了考察。
脑、血液微透析探针的植入按照“2.2”项下方法进行,均以1.5 μL·min-1的流速灌流200 ng·mL-1的微透析实验用栀子苷溶液,平衡60 min之后,开始收集,每1 h为一份样品,共收集10 h,样品处理后进行测定,按公式1计算反透析法探针回收率(RL),结果见表 4。公式1:回收率=(C0-Cdialysate)/C0×100%,Cdialysate为透析液浓度中栀子苷的浓度,C0为原液中栀子苷浓度。结果表明,脑、血微透析探针对栀子苷的体内回收率在10 h内保持相对稳定,脑探针对栀子苷的体内平均回收率为23.4%,血液探针对栀子苷的体内平均回收率为42.6%。
|
|
表 4 脑、血微透析探针对栀子苷体内回收率稳定性考察 Table 4 Stability of brain and blood probe recovery for geniposide in vivo |
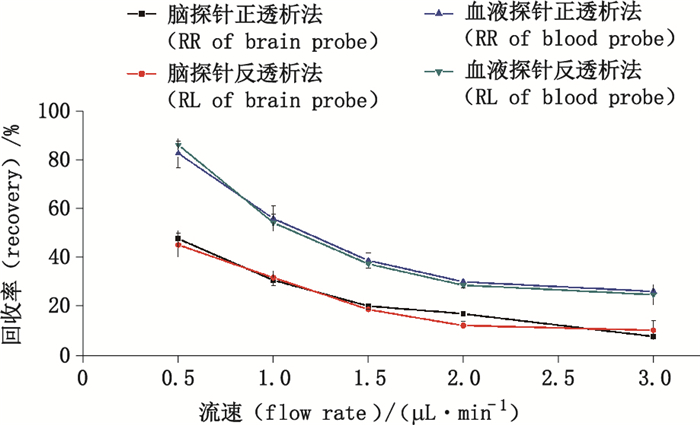
分别采用正透析法和反透析法测定并计算体外回收率。正透析法:将探针置于200 ng·mL-1的微透析实验用栀子苷溶液中(恒温37 ℃),分别以0.5、1.0、1.5、2.0、3.0 μL·min-1的流速灌注林格氏液,每个流速在平衡60 min后,收集5份样品(每份30 μL),样品处理后进行测定,并计算正透析法探针回收率(RR)(公式2)=Cdialysate/C0×100%,其中Cdialysate为微透析液中栀子苷浓度,C0为原药液中栀子苷浓度。结果见图 2。
|
图 2 灌流速度对脑、血液微透析探针体外正、反透析法回收率的影响(n=5) Figure 2 The effect on RR and RL of brain and blood probe under different flow rate in vitro |
反透析法:将探针置于林格氏液中(恒温37 ℃),分别以0.5、1.0、1.5、2.0、3.0 μL·min-1的流速灌注200 ng·mL-1的微透析实验用栀子苷溶液,每个流速在平衡60 min后,收集5份样品(每份30 μL),样品处理后进行测定,按照公式1计算反透析法探针回收率。结果见图 2。结果显示,在0.5~3.0μL·min-1范围内,随着灌流速度的增大,脑、血液微透析探针的回收率均随着流速的增大而下降;相同流速时,2种探针的正透析法、反透析法测得的回收率结果基本一致。微透析探针的回收率跟透析针半透膜的表面积成正比,而血液微透析探针的半透膜长度为脑微透析探针的2.5倍,因此其回收率也要高于脑微透析探针。
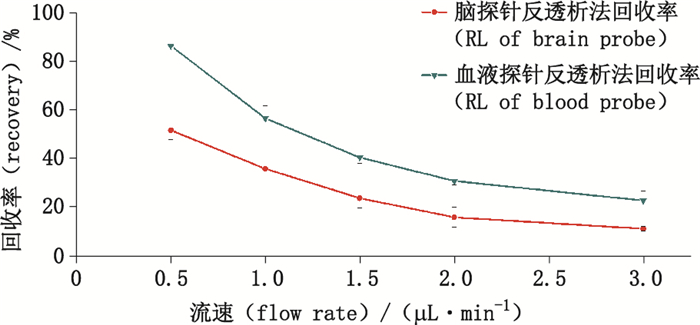
2.9.3 灌流速度对探针体内回收率的影响按照“2.3”项植入脑、血微透析探针,分别以0.5、1.0、1.5、2.0、3.0 μL·min-1的流速灌流200 ng·mL-1的微透析实验用栀子苷溶液,每种流速在平衡60 min后,收集5份样品,样品处理后进行测定,公式1计算反透析法回收率。结果见图 3。结果表明,在0.5~3.0 μL·min-1,随着灌流速度的增加,脑、血微透析探针对栀子苷的体内回收率均逐渐降低。
|
图 3 灌流速度对脑、血液微透析探针体内回收率的影响(n=5) Figure 3 The effect on recovery of brain and blood probe under different flow rate in vivo |
在同一恒定的灌流速度下,采用正透析法浓度对探针体外回收率的影响。依次将探针置于50、200、500、1 000 ng·mL-1的微透析实验用栀子苷溶液中(恒温37 ℃),以恒定的流速(1.5 μL·min-1)灌注林格氏液,每个浓度在平衡60 min后,收集5份样品(每份30 μL),质量浓度为1 000 ng·mL-1的微透析实验用栀子苷溶液采用林格氏液稀释10倍后再进行测定,其他原溶液及样品直接处理后进行测定。按公式2计算正透析法探针回收率,结果见图 4。结果显示,当灌流速度不变时,在4种不同药物浓度的溶液中测得的脑、血液微透析探针回收率相似。以回收率对浓度做图,得到与x轴基本平行的线,表明在50~1 000 ng·mL-1时,脑、血液微透析探针的回收率与浓度无关。

|
图 4 浓度对脑、血液微透析探针体外回收率的影响(n=5) Figure 4 The effect on recovery of brain and blood probe under different concerntration in vitro(n=5) |
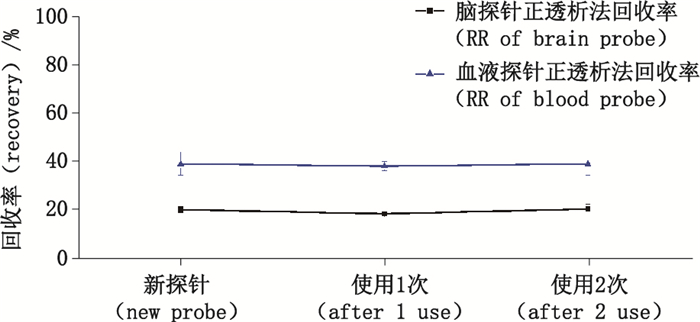
选择灌流速度为1.5 μL·min-1,200 ng·mL-1的微透析实验用栀子苷溶液,采用正透析法分别对新探针、体内使用1次和使用2次并经过恢复处理的探针进行体外回收率试验,每个探针在平衡60 min后,收集5份样品(每份30 μL),测定峰面积并用公式2计算RR,结果见图 5。
|
图 5 使用次数对脑、血液微透析探针体外回收率的影响(n=5) Figure 5 The effect on recovery of brain and blood probe with different times in vitro |
结果显示,在使用1次和2次并经过恢复处理后,脑、血液探针对栀子苷的回收率与新探针的相比,基本保持一致,说明探针的恢复处理对其继续使用并保持较高的透过率有重要的影响。
3 讨论微透析作为一种新型生物采样技术,能够在不干扰机体正常生命过程的情况下进行在体、实时、在线取样,根据不同的组织和靶器官,选择不同类型的透析针,可以实现给药后多个部位样品的同时采集。微透析探针的回收率是微透析技术用于研究药物体内动力学的一个关键问题,影响回收率的因素有灌流速度、温度、半透膜的性质等,因此探针回收率的研究是其用于进一步研究的首要工作。
采用微透析进行药物体内动力学的研究一般需要持续长时间的采集样品,因此首先对微透析探针的体内稳定性进行了考察。通过对栀子苷脑、血探针回收率的10 h稳定性的考察,发现探针在体内的稳定性良好,能够保证长时间实验时数据的准确性。灌流速度直接决定了半透膜两侧物质交换的效率,灌流速度越快,膜两侧物质的平衡时间越短,导致回收率较低,相反,灌流速度越慢则回收率越高,但是收集的样品量也会相应减少,需要综合回收率和样品量两方面来选择灌流速度。本实验分别采用正透析法和反透析法考察了不同流速对栀子苷探针体外回收率的影响,最终选择的灌流速度为1.5 μL·min-1,30 min收集1份样品。
通过反透析法测定探针的体内回收率,判断其与体外回收率是否一致,进而推测给药后体内药物的真实浓度。本实验采用反透析法对栀子苷探针体内回收率进行了考察,结果表明不同流速下所测得的体内回收率与体外回收率基本一致,反透析法测得的回收率能够用于推测靶器官内药物的浓度。
探针使用后,本实验先采用高流速灌流2%肝素钠溶液约30 min,以冲洗附着在探针半透膜上的生物基质,再以低流灌流超纯水约12 h冲洗盐溶液,经上述恢复处理后,使用不超过3次的探针,与新探针相比,仍然能够保持较高的透过率。
| [1] |
KITANO A, SAIKA S, YAMANAKA O, et al. Genipin suppression of fibrogenic behaviors of the alpha-TN4 lens epithelial cell line[J]. J Cataract Refract Surg, 2006, 32(10): 1727. DOI:10.1016/j.jcrs.2006.05.015 |
| [2] |
MA TT, LI XF, LI WX, et al. Geniposide alleviates inflammation by suppressing MeCP2 in mice with carbon tetrachloride-induced acute liver injury and LPS-treated THP-1 cells[J]. Int Immunopharmacol, 2015, 29(2): 739. DOI:10.1016/j.intimp.2015.08.045 |
| [3] |
LIAO PP, LIU LH, WANG B, et al. Baicalin and geniposide attenuate atherosclerosis involving lipids regulation and immunoregulation in ApoE-/-mice[J]. Eur J Pharmacol, 2014, 740: 488. DOI:10.1016/j.ejphar.2014.06.039 |
| [4] |
WANG JM, ZHANG YY, LIU RX, et al. Geniposide protects against acute alcohol-induced liver injury in mice via up-regulating the expression of the main antioxidant enzymes[J]. Can J Physiol Pharm, 2015, 93(4): 261. DOI:10.1139/cjpp-2014-0536 |
| [5] |
MA TT, HUANG C, ZONG GJ, et al. Hepatoprotective effects of geniposide in a rat model of nonalcoholic steatohepatitis[J]. J Pharm Pharmacol, 2011, 63(4): 587. DOI:10.1111/j.2042-7158.2011.01256.x |
| [6] |
YIN F, LIU JH, ZHANG XX, et al. Geniposide induces the expression of heme oxygenase-1 via PI3K/Nrf2-signaling to enhance the antioxidant capacity in primary hippocampal neurons[J]. Biol Pharm Bull, 2010, 33(11): 1841. DOI:10.1248/bpb.33.1841 |
| [7] |
LI FH, LI WH, LI XG, et al. Geniposide attenuates inflammatory response by suppressing P2Y14 receptor and downstream ERK1/2 signaling pathway in oxygen and glucose deprivation-induced brain microvascular endothelial cells[J]. J Ethnopharmacol, 2016, 185: 77. DOI:10.1016/j.jep.2016.03.025 |
| [8] |
PAN LM, ZHOU J, ZHU HX, et al. Study on integrated pharmacokinetics of gardenia acid and geniposide:time-antioxidant efficacy after oral administration of Huanglian-Zhizi couplet medicine from Huang-Lian-Jie-Du-Tang in MCAO rats[J]. Am J Chin Med, 2014, 42(2): 393. DOI:10.1142/S0192415X14500268 |
| [9] |
ZHAO CH, ZHANG HJ, LI H, et al. Geniposide ameliorates cognitive deficits by attenuating the cholinergic defect and amyloidosis in middle-aged Alzheimer model mice[J]. Neuropharmacology, 2016, 116: 18. |
| [10] |
LIU WZ, LI GL, HOLSCHER C, et al. Neuroprotective effects of geniposide on Alzheimer's disease pathology[J]. Rev Neurosci, 2015, 26(4): 371. |
| [11] |
CHAURASIA CS. In vivo microdialysis sampling:theory and applications[J]. Biomed Chromatogr, 1999, 13(5): 317. DOI:10.1002/(ISSN)1099-0801 |
| [12] |
徐铭, 李范珠. 微透析取样技术及其在体内药物分析中的应用[J]. 药物分析杂志, 2006, 26(7): 1030. XU M, LI FZ. Microdialysis sampling technique and its application in biopharmaceutical analysis[J]. Chin J Pharm Anal, 2006, 26(7): 1030. |
| [13] |
CHEN CF, DREW KL. Droplet:based microdialysis:Concept, theory, and design considerations[J]. J Chromatogr A, 2008, 1209(1-2): 29. DOI:10.1016/j.chroma.2008.09.006 |
| [14] |
STAHLE L. Microdialysis in pharmacokinetics[J]. Eur J Drug Metab Pharmacokinet, 1993, 18(1): 89. DOI:10.1007/BF03220011 |
| [15] |
吕允凤. 应用微透析技术测定天麻素对大鼠脑内乙酰胆碱释放量的影响[J]. 药物分析杂志, 2013, 33(10): 1720. LÜ YF. Effect of gastrodin on release of extracellular acetylcholine in rat brain dialysate[J]. Chin J Pharm Anal, 2013, 33(10): 1720. |
| [16] |
李周, 王利胜, 巴文强, 等. 青藤碱、雷公藤甲素皮肤和血液在体微透析方法的建立[J]. 中草药, 2015, 46(14): 2076. LI Z, WANG SL, BA WQ, et al. Establishment of skin and blood microdialysis sampling method of sinomenine and triptolide in vivo[J]. Chin Tradit Herb Drugs, 2015, 46(14): 2076. DOI:10.7501/j.issn.0253-2670.2015.14.010 |
 2018, Vol. 38
2018, Vol. 38 
