2. 河北省第三医院 药剂科, 石家庄 050051
2. Hebei Third Hospital, Shijiazhuang 050051, China
鸡骨草和毛鸡骨草分别为豆科相思子属植物广东相思子Abrus cantoniensis Hance和毛相思子Abrus mollis Hance去除荚果的干燥全草,主要盛产于广东、广西等地。中国药典对鸡骨草有收录[1],毛鸡骨草则收录于《广东省中药材标准》等地方标准中[2]。由于两者的药理作用类似,如都具有清热解毒,利湿护肝等作用,均能用于治疗急慢性肝炎或用于煲汤、煮凉茶等保健食疗[3-5],常把毛鸡骨草作为鸡骨草的替代品使用,二者的这种相互替代是否存在合理性,需要从多方面进行评价。
植物化学鉴定表明,鸡骨草与毛鸡骨草含有相似的化学成分,两者均含有挥发油类且以(±)-α-乙酸松油酯含量较高,有机酸类如棕榈酸、十八烷酸等[7-8],黄酮类如夏佛塔苷、新西兰牡荆苷、牡荆素等[9-10],生物碱类如相思子碱、下箴刺桐碱等[9-10],此外还含有三萜类、氨基酸、皂苷等[11-12]。本课题组已经从主要化学成分的体外含量比较[13]及体内药动学特征的比较等方面对二者相互替代的合理性进行了初步研究。药物进入机体内的命运和药理作用也息息相关,很多药效成分进入体内后要发生代谢,代谢物在一定程度上也会有产生与原型相同或相异的药理效应,因此通过比较鸡骨草及毛鸡骨草中几种主要化学成分的排泄过程的异同,可以初步了解其在体内的代谢情况,从而可以为更深入地评价二者相互替代的合理性提供依据。本研究采用HPLC-MS/MS方法同时测定鸡骨草与毛鸡骨草中9种成分在大鼠尿液以及6种成分在大鼠胆汁中的浓度,并进行排泄动力学比较研究,为鸡骨草与毛鸡骨草的科学应用提供一定的理论依据。
1 仪器与材料 1.1 仪器3200-QTrap型串联四极杆线性离子阱质谱仪,配有Turbo V离子源(AB公司);Agilent 1200液相色谱系统,配有四元泵、自动进样器、在线脱气机(Agilent公司);ZORBAX SB-C18(150 mm× 4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;Agilent公司)Analyst 1.6.0数据采集、分析软件(美国AB公司);MTN-2800D型氮吹仪(天津奥特赛恩斯仪器有限公司);雷勃尔LG16-B高速离心机(北京雷勃尔离心机有限公司)。
1.2 试药与试剂对照品夏佛塔苷(批号ZL25854XFT)、异夏佛塔苷(批号ZL85428YXF)、相思子碱(批号ZL20131125XS)、芒柄花素(批号ZL20100605MBS)和木犀草素(批号ZL10432MXC)购自于南京泽朗医药科技有限公司;维采宁-2(批号150122)和下箴刺桐碱(批号140428)购买于成都普菲德生物技术有限公司;牡荆素(批号3681934)和异牡荆素(批号29702258)购买于南京春秋生物工程有限公司;磺胺甲噁唑(内标,批号100025-199503)购自中国食品药品检定研究院,含量均大于98%;甲醇(色谱纯,美国天地公司);乙酸(色谱纯,美国迪马公司);水为娃哈哈纯净水(杭州娃哈哈集团有限责任公司);乙醇(分析纯,国药集团化学试剂有限公司)。药材购自广东省药材市场。
2 方法与结果 2.1 色谱条件采用ZORBAX SB-C18色谱柱(150 mm×4.6 mm,5 μm),以甲醇(A)-0.05%乙酸水溶液(B)为流动相,梯度洗脱(初始0~4 min,30%A;4~8 min,30%A→36%A;8~12 min,36%A→95%A;12~16 min保持95%A不变),流速为1.0 mL·min-1,预平衡时间10 min,进样量10 μL。
2.2 质谱条件离子源:电喷雾离子(ESI)源;检测方式:多反应监测(MRM)模式;采用正、负离子切换模式,切换时间5.0 min处;源喷射电压:5 500 V/-4 500 V;离子源温度(TEM):650 ℃;帘气(CUR):0.17 MPa;雾化气(Gas 1):0.41 MPa,加热气(Gas 2):0.45 MPa。尿中9种被测成分和胆汁中6种被测成分的监测离子对、解簇电压(DP)和碰撞能量(CE)见表 1。
|
|
表 1 待测成分的保留时间,最佳离子对,解簇电压和碰撞能量 Table 1 The retention time (tR), optimized MS/MS transitions, declustering potential (DP) and collision energy (CE) for each analytes |
分别取夏佛塔苷、异夏佛塔苷、相思子碱、芒柄花素、木犀草素、维采宁-2、下箴刺桐碱、牡荆素、异牡荆素对照品及磺胺甲噁唑(内标物)适量,精密称定,加甲醇溶解并配制成约1.0 mg·mL-1的储备液。分别精密量取上述各储备液适量,置10 mL量瓶中,用甲醇稀释至刻度,得混合对照品溶液。将混合对照品溶液逐级稀释得系列标准溶液。尿液和胆汁中内标液的质量浓度分别为3.40 μg·mL-1和0.99 μg·mL-1。
同法配制用来制备质控(QC)样品的低、中、高3种浓度的标准溶液。用于尿液QC样品制备的标准溶液中9种成分的浓度分别为:下箴刺桐碱为40.20、201.00、1 608.00 ng·mL-1;相思子碱为122.20、611.00、4 888.00 ng·mL-1;维采宁-2为215.00、1 075.00、8 600.00 ng·mL-1;夏佛塔苷为122.20、611.00、4 888.00 ng·mL-1;异夏佛塔苷为150.00、750.00、6 000.00 ng·mL-1;牡荆素为61.75、308.75、2 470.00 ng·mL-1;异牡荆素为64.35、321.75、2 574.00 ng·mL-1;木犀草素为33.80、169.00、1 352.00 ng·mL-1;芒柄花素为61.10、305.50、2 444.00 ng·mL-1。用于胆汁QC样品制备的标准溶液中6种成分的浓度分别为:下箴刺桐碱为43.55、217.75、1 742.00 ng·mL-1;相思子碱为235.00、1175.00、9 400.00 ng·mL-1;夏佛塔苷为235.00、1 175.00、9 400.00 ng·mL-1;异夏佛塔苷为264.00、1 320.00、10 560.00 ng·mL-1;牡荆素为61.75、308.75、2 470.00 ng·mL-1;异牡荆素为64.35、321.75、2 574.00 ng·mL-1。
2.4 尿液(或胆汁)样品的预处理取尿液(或胆汁)样品100 μL,分别加入甲醇10 μL,内标溶液10 μL,混匀后加入甲醇300 μL,涡旋混合2 min,14 000 r·min-1离心10 min,转移上清液,于空气流下挥干,残渣加入初始流动相100 μL复溶,涡旋,14 000 r·min-1离心10 min,取上清液10 μL进入HPLC-MS系统进行分析。
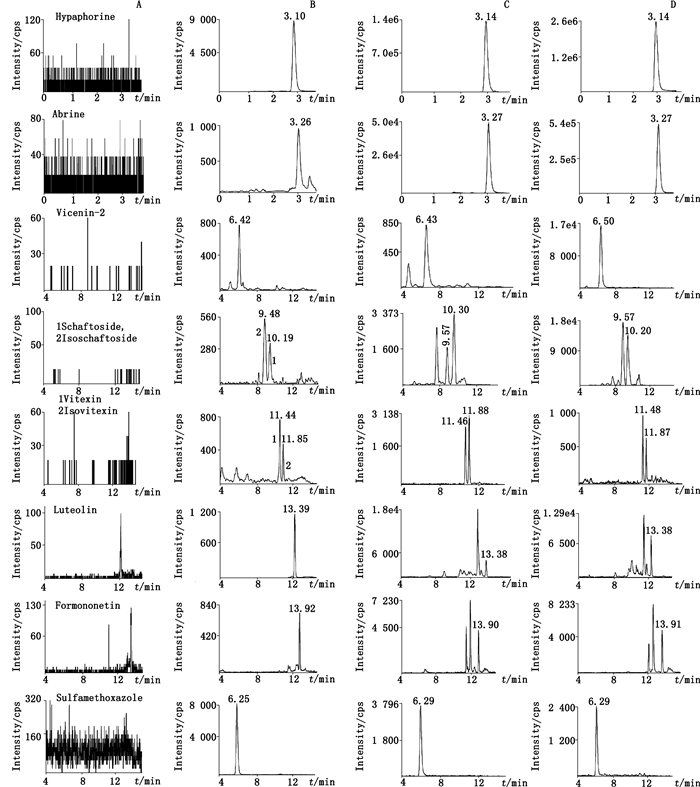
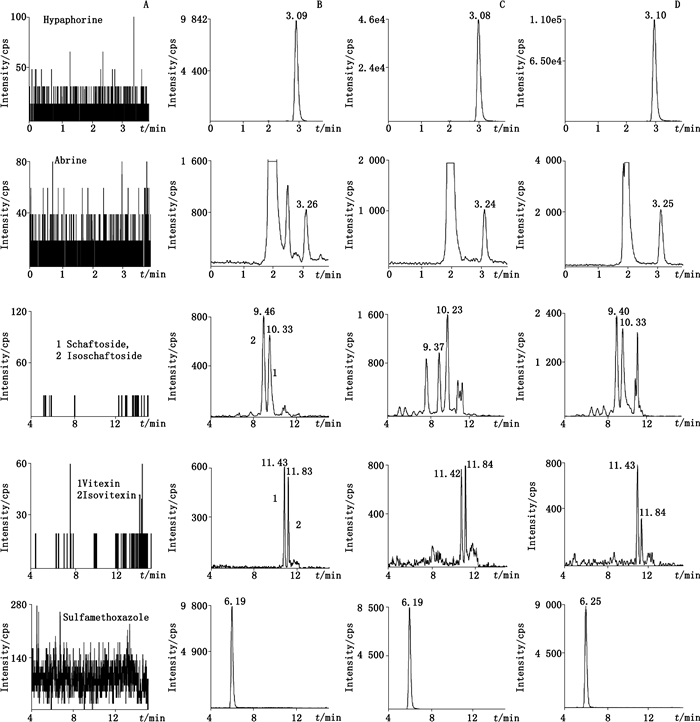
2.5 方法学验证 2.5.1 专属性取大鼠空白尿液(或胆汁)样品、加入对照品的空白尿液(或胆汁)和大鼠灌胃给予药材提取物后的真实尿液(或胆汁)样品,按“2.4”项下方法处理后进行分析,结果表明,尿液和胆汁样品在各待测成分及内标的保留时间处均无干扰峰的出现,方法专属性良好,结果见图 1和图 2。
|
A.空白尿(blank urine)B.空白尿加入定量下限的各种成分和内标(blank urine spiked with the analytes at LLOQ and IS)C.灌胃给予鸡骨草后的4~8 h时样品(urine samples collected 4-8 h after oral administration of Abri Herba extract)D.灌胃给予毛鸡骨草后的4~8 h时样品(urine samples collected 4-8 h after oral administration of Abri Mollis Herba extract) 图 1 尿液中各待测成分和内标的MRM色谱图 Figure 1 Typical MRM chromatograms of the analytes and sulfamethoxazole (IS) in urine |
|
A.空白胆汁(blank bile)B.空白胆汁加入定量下限的各种成分和内标(blank bile spiked with the analytes at LLOQ and IS)C.灌胃给予鸡骨草后的2~4 h时胆汁样品(bile samples collected 2-4 h after oral administration of Abri Herba extract)D.灌胃给予毛鸡骨草后的2~4 h时胆汁样品(bile samples collected 2-4 h after oral administration of Abri Mollis Herba extract) 图 2 胆汁中各待测成分和内标的MRM色谱图 Figure 2 Typical MRM chromatograms of the analytes and sulfamethoxazole (IS) in bile |
取大鼠空白尿液(或胆汁)100 μL,分别加入系列标准溶液10 μL,内标工作溶液10 μL,按“2.4”项下方法处理后进样分析。以待测物与内标物的峰面积比值(Y)为纵坐标,待测物在生物样品中的浓度(X)为横坐标,用加权(1/x2)最小二乘法进行线性回归,得回归方程。尿液中9种待测成分和胆汁中6种待测成分的标准曲线、相关系数、线性范围和LLOQ见表 2,表明每个成分在线性范围内线性关系良好。LLOQ处的准确度(RE)均小于±15%,精密度(RSD)均小于15%。
|
|
表 2 各待测成分在尿液和胆汁的回归方程,线性范围和定量下限 Table 2 The regression equations, linear ranges, and LLOQs of the analytes in urine and bile |
取大鼠空白尿液(或胆汁)100 μL,分别加入上述用于制备QC样品的标准溶液10 μL,内标溶液10 μL,制备低、中、高3个质量浓度的QC样品各6份,按“2.4”项下同法处理后进样分析。于同一天内依法测定并计算各待测成分和内标物的峰面积比,代入随行的标准曲线计算QC样品的测定浓度,计算方法的日内精密度和准确度。连续测定3 d,分别以当日的标准曲线计算QC样品的测定浓度,计算方法的日间精密度和准确度。结果表明,尿液和胆汁样品中各待测成分日内、日间精密度RSD < 15%,准确度RE < ±15%,表明该方法的精密度好,准确度高,结果见表 3。
|
|
表 3 测定方法的准确度、精密度、基质效应和提取回收率 Table 3 Accuracy, precision, matrix effects (ME) and extraction recovery (ER) of the method |
取大鼠空白尿液(或胆汁)100 mL,依法制备低、中、高3个浓度的QC样品,按“2.4”项下方法处理,记录待测物和内标的峰面积(A),每一浓度平行测定6份;另取空白尿液(或胆汁)100 mL,依法进行提取后加入用于制备QC样品的标准溶液10 μL,内标溶液10 μL,混匀,于空气流下挥干,分别加入初始流动相100 μL复溶,测定,记录待测物和内标的峰面积(B),每一浓度平行测定6份;A/B×100%即得提取回收率。结果表明,在尿液和胆汁中各待测成分的提取回收率范围分别为87.7%~111.0%和85.9%~105.2%,结果见表 3。
2.5.5 基质效应取6份不同来源的SD大鼠空白尿液(或胆汁)100 μL,按上述方法测定高中低3种浓度时待测物和内标的峰面积(B)。同时用100 μL水代替空白基质,测定不含基质时待测物和内标的峰面积(C),计算各分析物与内标的基质因子(B/C×100%),再计算出每一分析物经内标归一化的基质因子与其RSD。结果见表 3。结果表明,经内标归一化的基质因子RSD均小于15%,表明基质效应不影响待测物的浓度测定。
2.5.6 稀释效应对于实测样品中浓度超出标准曲线范围的样品,需要进行稀释后测定。为考察稀释是否影响测定的准确度和精密度,需考察稀释可靠性。取空白基质加入高浓度标准溶液适量配制成高于定量上限浓度的样品,再分别用空白尿液和空白胆汁稀释8倍、40倍、120倍制备成高中低3个浓度,每个浓度平行制备5份,按“2.4”项下方法处理后分析,测得浓度的精密度RSD均小于15%,准确度RE在-13.7%~12.2%,表明尿液和胆汁稀释不影响测定。
2.5.7 稳定性试验取大鼠空白尿液(或胆汁),同法制备低、中、高3个浓度的QC样品,分别考察样品在-80 ℃长期冷冻保存、冷冻-解冻循环(-80 ℃到20 ℃)、室温放置及自动进样器中放置等不同储存条件下的稳定性。结果表明,尿液(或胆汁)样品-80 ℃长期冷冻30 d、3次冷冻-解冻循环、室温放置12 h、样品处理后在自动进样器中放置12 h,各成分的RE均不超过±15%,RSD均小于15%,满足试验要求。
2.6 排泄动力学 2.6.1 鸡骨草与毛鸡骨草灌胃液的制备将鸡骨草与毛鸡骨草切段并粉碎,取200 g,加入50%乙醇浸泡1 h后回流提取,重复提取3次(料液比1:15,1:15,1:10),合并3次提取液,过滤,回收溶剂,加水溶解并定容至100 mL。使用外标法测定了鸡骨草与毛鸡骨草灌胃液中各成分的量分别为:下箴刺桐碱为1 037.37和2 082.59 μg·mL-1;相思子碱为2 119.27和4 279.77 μg·mL-1;维采宁-2为956.49和7 411.83 μg·mL-1;夏佛塔苷为682.97和934.18μg·mL-1;异夏佛塔苷为250.66和1 042.55 μg·mL-1;牡荆素为11.61和28.89 μg·mL-1;异牡荆素为17.38和20.28 μg·mL-1;木犀草素为40.08和27.30 μg·mL-1;芒柄花素为8.19和1.10 μg·mL-1。
2.6.2 实验动物给药及样品采集24只雄性SD(Spraque-Dawley)大鼠(河北医科大学实验动物中心,合格证编号为603242),室温、相对湿度50%条件下饲养1周,正常光照,给药前禁食12 h,自由饮水。实验前随机分为4组,即鸡骨草尿排泄组,鸡骨草胆汁排泄组,毛鸡骨草尿排泄组和毛鸡骨草胆汁排泄组,每组6只。
胆汁排泄组:取大鼠,按7 mL·kg-1剂量腹腔注射25%乌拉坦溶液,麻醉后固定,沿腹中线打开腹腔,行胆管插入术,按5 mL·kg-1剂量灌胃给予鸡骨草与毛鸡骨草灌胃液。分别收集0~1 h,1~2 h,2~4 h,4~6 h,6~8 h,8~12 h,12~24 h时间段的胆汁,测量体积,置于-80 ℃冷冻保存,临用前取出,室温放置解冻。
尿液排泄组:取大鼠,按5 mL·kg-1剂量灌胃给予鸡骨草与毛鸡骨草灌胃液,置代谢笼中,收集0~4 h,4~8 h,8~12 h,12~24 h,24~32 h,32~48 h,48~60 h,60~72 h,72~84 h,84~96 h时间段的尿液,测量体积,置于-80℃冷冻保存,临用前取出,室温放置解冻。
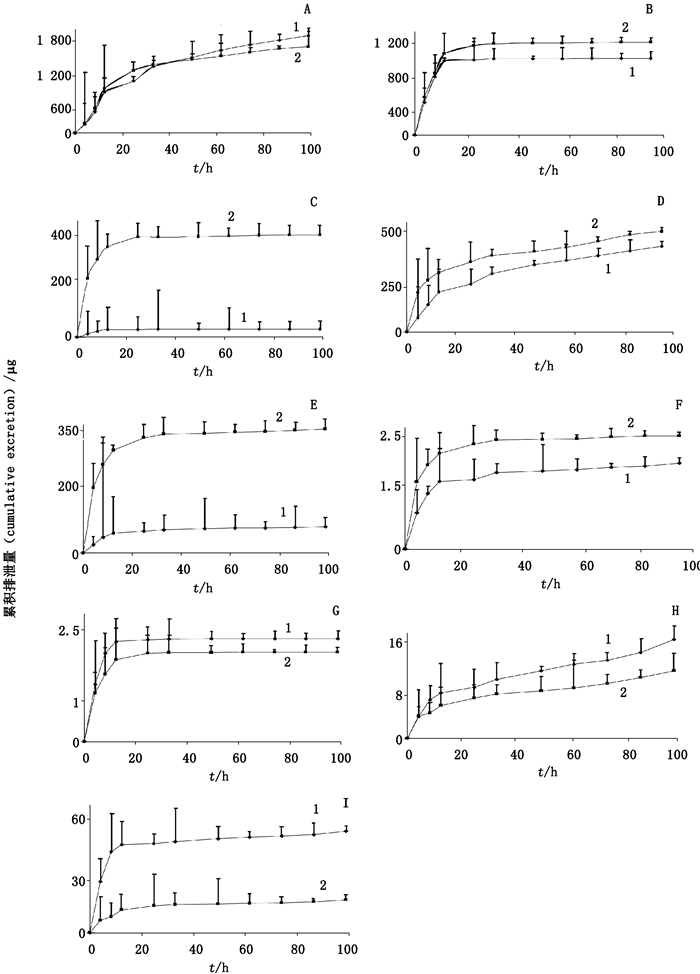
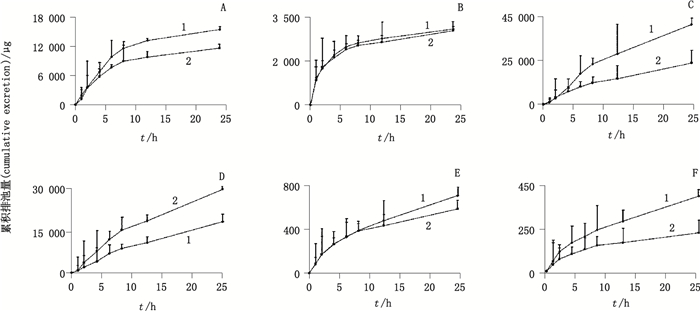
2.6.3 排泄动力学特征分别将各个时间段尿液和胆汁样品,按“2.4”项下方法进行处理,依法测定各尿液(或胆汁)样品中待测物的峰面积(AS)和内标物的峰面积(Ai),并计算峰面积的比值AS/Ai,带入随行的标准曲线计算样品中各成分的浓度,根据各时间段的体积,计算每个时间段的排泄量及不同时间的排泄速率;以时间为横坐标,平均累积排泄量为纵坐标,绘制各成分的累积排泄量-时间曲线(见图 3和图 4),以时间为横坐标,排泄速率为纵坐标,绘制平均排泄速率-时间曲线(见图 5和图 6)。累积排泄量与给药剂量相比,即得该成分的累积排泄百分数,也称累积排泄率。排泄速率:lgΔXu/Δt=-k/2.303tc+lg(keX0)总排泄量:EXu=ke×X0/k(ΔXu-间隔时间内排泄的原型成分量;k-消除速率常数;ke-一级肾排泄速率常数;X0-给药量)。
|
A.下箴刺桐碱(hypaphornne)B.相思子碱(abrine)C.维朱宁-2(vicenin-2)D.夏佛塔苷(schaftoside)E.异夏佛塔苷(isoschaftoside)F.牡荆素(vitexin)G.异牡荆素(isovitexin)H.木犀草素(luteolin)I.芒柄花素(formononetin) 图 3 灌胃给予大鼠鸡骨草(1)及毛鸡骨草(2)提取物后尿中9种成分的累积排泄量-时间曲线(n=6) Figure 3 The accumulation of 9 coumarins excreted in the urine after oral administration of Abri Herba(1) and Abri Mollis Herba (2) extract |
|
A.下箴刺桐碱(hypaphornne)B.相思子碱(abrine)C.夏佛塔苷(schaftoside)D.异夏佛塔苷(isoschaftoside)E.牡荆素(vitexin)F.异牡荆素(isovitexin) 图 4 灌胃给予大鼠鸡骨草(1)及毛鸡骨草(2)提取物后胆汁中6种成分的累积排泄量-时间曲线(n=6) Figure 4 The accumulation of 6 coumarins excreted in the bile after oral administration of Abri Herba (1) and Abri Mollis Herba (2) extract |
|
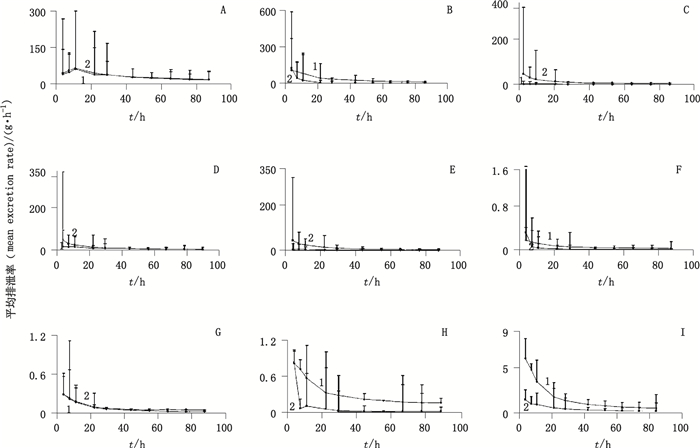
A~I.同图 3(same as Fig. 3) 图 5 灌胃给予大鼠鸡骨草(1)及毛鸡骨草(2)提取物后尿中9种成分的平均排泄速率(n=6) Figure 5 Mean urinary excretion rate vs time curves of the nine analytes in rats after oral administration of Abri Herba (1) and Abri Mollis Herba (2)extract |
|
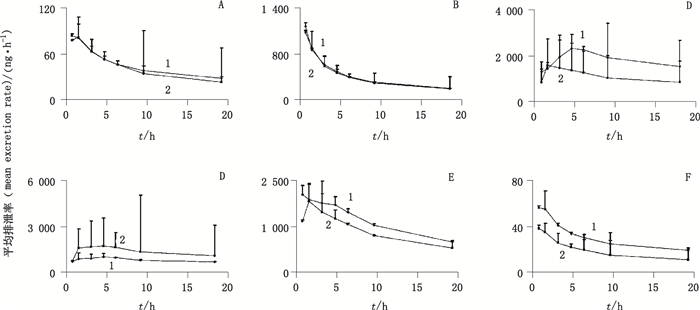
A~F.同图 4(same as Fig. 4) 图 6 灌胃给予大鼠鸡骨草(1)及毛鸡骨草(2)提取物后胆汁中6种成分的平均排泄速率(n=6) Figure 6 Mean biliary excretion rate vs time curves of the six analytes in rats after oral administration of Abri Herba (1)and Abri Mollis Herba(2)extract |
结果显示,在尿中,鸡骨草与毛鸡骨草中相同被测成分排泄速率达到峰值的时间一致,其中下箴刺桐碱在10 h达到峰值,而其余8种成分均在2 h达到峰值。在给药54 h后2种药材的累积排泄量均达到稳态。2种药材中下箴刺桐碱、相思子碱、维采宁-2、夏佛塔苷、异夏佛塔苷、牡荆素、异牡荆素、木犀草素和芒柄花素以原型在尿液中96 h内的平均累积排泄率分别为1.585%、0.426%、0.030%、0.554%、0.272%、0.148%、0.118%、0.364%、5.893%和0.700%、0.255%、0.046%、0.476%、0.311%、0.078%、0.088%、0.365%、14.237%。
在胆汁中,鸡骨草与毛鸡骨草中相同被测成分排泄速率达到峰值的时间并不完全相同,下箴刺桐碱、夏佛塔苷和牡荆素在鸡骨草与毛鸡骨草中达峰时间分别为0.5 h和1.5 h,5 h和1.5 h,0.5 h和1.5 h。其余3种成分的达峰时间是一致的,其中相思子碱和异牡荆素达峰时间为0.5 h,异夏佛塔苷为5 h。在给药10 h后2种药材的累积排泄量均达到稳态。2种药材中下箴刺桐碱、相思子碱、夏佛塔苷、异夏佛塔苷、牡荆素和异牡荆素以原型在胆汁中24 h内的平均累积排泄率分别为0.015%、0.001%、0.056%、0.069%、0.058%、0.023%和0.006%、0.001%、0.021%、0.027%、0.019%、0.010%。
3 讨论实验时,分别将各对照品配成质量浓度约为10 μg·mL-1的甲醇溶液,针泵进样至3200-Trap质谱仪,在正离子和负离子同时监测模式下,发现下箴刺桐碱和相思子碱在正离子模式下的[M-H]+离子更稳定,灵敏度更高,其余成分和内标在负离子模式下的[M-H]-离子响应值更高,故选择正负离子切换模式。分别选取各化合物响应最强的离子([M-H]-/[M+H]+)作为母离子,进行MRM优化扫描,最终确定了各自的最优DP及CE电压。
被分析物的碎片归属如下,磺胺甲噁唑(SMZ)为m/z 252.0 [M-H]-→155.9 [M+H-C4H4N2O]-,刺桐碱为m/z 247.1 [M+H]+→188.1 [M+H-CO2-CH3]+;相思子碱为m/z 219.1 [M+H]+→132.2 [M+H-C3H5O2N]+,夏佛塔苷与异夏佛塔苷为m/z 563.2 [M-H]-→353.0 [M-H-C4H9O4-C3H6O3]-,木犀草素为m/z285.0 [M-H]-→132.9 [M-H-C7H4O4]-,牡荆素与异牡荆素为m/z 431.1 [M-H]-→311.0 [M-H-C4H8O4]-,维采宁-2为m/z 593.0 [M-H]-→352.8 [M-H-C4H9O4-C4H9O4]-,芒柄花素为m/z 267.0 [M-H]-→252.0 [M-H-CH3]-,与文献报道[13-15]一致。
本研究结果显示,鸡骨草与毛鸡骨草中的相同成分在尿液及胆汁中的排泄动力学过程既有相同之处又有不同之处,需辩证分析。2种药材中的相同被测成分在尿液中的排泄达峰时间是一致的,且96 h内基本经尿液排泄完全,其中芒柄花素的排泄率最高,其他成分以原型排泄率并不高,2种药材中的下箴刺桐碱和芒柄花素的累积排泄率相差最大,其他成分无明显差别;在胆汁中,鸡骨草与毛鸡骨草中的相同被测成分排泄速率达到峰值的时间并不完全相同,各成分以原型在胆汁的排泄率较低且除相思子碱外,其他被测成分的累积排泄率差异均较大。导致这种差异的原因一方面是大鼠的个体差异性导致的,另一方面可能是不同药材中其他成分对一些待测成分的体内过程产生了影响,具体原因需要进一步验证。
| [1] |
中国药典2015年版. 一部[S]. 2015: 194 ChP 2015. Vol Ⅰ[S]. 2015: 194 |
| [2] |
广东中药材标准[S]. 2011: 81 Guangdong Traditional Chinese Medicine Standard[S]. 2011: 81 |
| [3] |
陈晓白, 莫志贤, 甘耀坤. 毛鸡骨草对高脂血症模型大鼠血脂和肝脂的影响[J]. 中国药房, 2010, 21(3): 202. CHEN XB, MO XZ, GAN YK. Effects of Abrus mollis on blood lipids and liver lipids in hyperlipoidemia rats[J]. China Pharm, 2010, 21(3): 202. |
| [4] |
冯娴婧, 陈红霞. 相思子属药用植物研究新进展[J]. 广西医科大学学报, 2013, 30(6): 969. FENG XQ, CHEN HX. Recent progress of study on Abrus Adans Hance[J]. J Guangxi Med Univ, 2013, 30(6): 969. |
| [5] |
李冬梅, 黄耀康, 蔡继旋. 苦瓜-鸡骨草复合多糖饮料的研制[J]. 食品工业, 2015, 36(3): 24. LI DM, HUANG YK, CAI JX. Study on compound polysaccharide beverage with Bitter Gourd and Abrus cantoniensis Hance as materials[J]. China Food, 2015, 36(3): 24. |
| [6] |
黄平, 麦秋良, 蒙晓芳. 毛鸡骨草中相思子碱和下箴刺桐碱含量测定[J]. 现代中药研究与实践, 2010, 24(6): 62. HUANG P, MAI LQ, MEMG XF. Determination of abrine and hypahorine in Abrus mollis Hance by HPLC[J]. China Med J Res Pract, 2010, 24(6): 62. |
| [7] |
孔德鑫, 黄荣韶, 王一兵. 基于FTIR的鸡骨草药材化学成分整体分析与评价[J]. 时珍国医国药, 2010, 21(1): 140. KONG DX, HUANG RS, WANG YB. Integrity analysis and assessment of the Abrus cantoniensis material based on FTIR[J]. Lishizhen Med Mater Med Res, 2010, 21(1): 140. |
| [8] |
肖晓, 许重远, 杨德俊. 鸡骨草与毛鸡骨草挥发油及脂肪酸成分的比较分析[J]. 药学实践杂志, 2017, 35(1): 39. XIAO X, XU ZY, YANG DJ. Comparative analysis of essential oil and fatty acid consitituents of Abrus cantoniensis and Abrus mollis[J]. J Pharm Pract, 2017, 35(1): 39. |
| [9] |
黄平, 李文静, 何碧婷. 毛鸡骨草药材的HPLC指纹图谱[J]. 中国实验方剂学杂志, 2014, 20(1): 66. HUANG P, LI WJ, HE BT. HPLC fingerprint of Abrus mollis[J]. Chin J Exp Tradit Med, 2014, 20(1): 66. |
| [10] |
徐柯心, 王宝丽, 贾子尧. UPLC同时测定鸡骨草中2种生物碱和2种黄酮碳苷的含量[J]. 药物分析杂志, 2017, 37(4): 610. XU HX, JIA ZY, WANG BL. Simultaneous determination of 2 alkaloids and 2C-glycoside flavones in Abri Herba by UPLC[J]. Chin J Pharm Anal, 2017, 37(4): 610. |
| [11] |
孔德鑫, 黄荣韶, 黄庶识. 基于FTIR比较分析鸡骨草与毛鸡骨草的化学组分[J]. 光谱实验室, 2010, 27(2): 512. KONG DX, HUANG RS, HUANG SS. Identif ication of chemical constituents of Abrus mollis by FTIR[J]. Chin J Spectrosc Lab, 2010, 27(2): 512. |
| [12] |
林梦瑶, 黄锁义, 李琳. 鸡骨草研究的新进展[J]. 中国野生植物资源, 2017, 36(1): 45. LIN MY, HUANG SY, LI L. Recent progress of study on Abrus cantoniensis Hance[J]. Chin Wild Plant Resour, 2017, 36(1): 45. |
| [13] |
YAN WY, HAN QJ, GUO PP. Simultaneous detection of flavonoids, phenolic acids and alkaloids in Abri Herba and Abri Mollis Herba using liquid chromatography tandem mass spectrometry[J]. Phytochem Anal, 2016, 27(1): 50. DOI:10.1002/pca.2598 |
| [14] |
GUO PP, YAN WY, HAN QJ. Simultaneous quantification of 25 active constituents in the total flavonoids extract from Herba Desmodii Styracifolii by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry[J]. J Sep Sci, 2015, 38(8): 1156. |
| [15] |
RAFFAELLI A, MONETI G, MERCATI V, et al. Mass spectrometric characterization of flavonoids in extracts from Passiflora ncarnate[J]. J Chromatogr A, 1997, 777(1): 223. DOI:10.1016/S0021-9673(97)00260-4 |
 2018, Vol. 38
2018, Vol. 38 
