2. 兰州大学第一医院, 兰州 730030
2. The First Hospital of Lanzhou University, Lanzhou 730030, China
孟鲁司特钠(montelukast sodium),化学名[R-(E)]-1-[[[1-[3-[2-[7-氯-2-喹啉)乙烯基]苯基-3-[2-(1-羟基-1-甲基乙基)苯基]丙基]硫]甲基]环丙烷乙酸钠,分子式为C35H35ClNNaO3S,为口服的白三烯受体拮抗剂(LTRA),属非激素类抗炎药,能特异性抑制气道中的半胱氨酰白三烯(CysLT)受体,从而改善气道炎症,有效控制哮喘症状,适用于成人和1岁以上儿童哮喘的预防和长期治疗及过敏性鼻炎的治疗[1-2]。目前国内外关于片剂在人体内的药动学及生物等效性研究较多[3-11],但关于颗粒剂的体内研究较少[12]。采用的分析方法多为HPLC法[9, 11, 13-17],部分采用HPLC-MS/MS法[3-5, 12],也有少量文献采用如HPTLC法[18]来进行测定。但是很多方法都存在分析时间长[13-14],血浆用量大[7]、前处理方法复杂[4-5]等问题。本研究旨在建立一种简便、快速,血浆使用量少的LC-MS/MS法,测定12名健康受试者服用孟鲁司特钠颗粒后的血药浓度并进行药动学研究,为该药的进一步研究与应用提供参考。
1 仪器与材料 1.1 仪器API4000三重四极杆质谱(Applied Biosystem公司);AB SCIEX ExionLCTM高效液相色谱仪(Applied Biosystem公司);Phenomenex luna C18色谱柱(填料:十八烷基硅烷键合硅胶;50 mm×2.1 mm,5 μm),(Phenomenex公司);XS3DU百万分之一天平(上海梅特勒-托利多仪器有限公司);VWR Vortexer Multi Tube Model 58816-115 VX 2500多管涡旋振荡器(VWR公司);D3024台式高速微量离心机(北京大龙兴创实验仪器有限公司);MPR-312DCN-PC 4 ℃保存箱(Sanyo公司);MDF-U548D-C负20 ℃低温冰箱(Panasonic公司);905-ULTS负80℃超低温冰箱(Thermo Scientific公司);UPR-I-10T型超纯水机(四川优普超纯科技有限公司)。
1.2 药品与试剂孟鲁司特钠颗粒(批号1606131,规格0.5 g:4 mg(以孟鲁司特计),江苏正大丰海制药有限公司);孟鲁司特钠对照品(批号2.0,含量100%,欧洲药典);孟鲁司特-d6对照品(批号1809-086A4,化学纯98.8%,TLC);甲酸(DIKMA,批号7742690);乙腈(批号LHA0005,色谱纯,北京百灵威科技有限公司);甲醇(批号LD70Q117,北京百灵威科技有限公司);水为去离子水。
2 方法 2.1 试验条件色谱条件:采用Phenomenex luna C18色谱柱(50 mm×2.1 mm,5 μm),以乙腈-水-甲酸(80:20:0.01)为流动相,流速为0.5 mL·min-1,柱温为45 ℃,进样量为5 μL,以孟鲁司特-d6作为内标。质谱条件:电喷雾离子源(ESI源),采用多反应监测模式(MRM);正离子扫描,离子喷射电压5.5 kV,离子源温度500 ℃,气帘气68.95 kPa,碰撞气55.2 kPa,喷雾气275.8 kPa,辅助气344.8 kPa;孟鲁司特及孟鲁司特-d6的离子对分别为m/z 586.6→422.3及m/z 592.0→427.2,去簇电压分别为100 V、70 V,碰撞能量均为32 V。
2.2 溶液配制平行取2份约5 mg孟鲁司特钠对照品,精密称定后用90%甲醇溶解,配制成质量浓度分别为103.0 μg·mL-1及104.2 μg·mL-1的孟鲁司特方法学标准曲线及质控储备液。再取适量标准曲线储备液,用50%甲醇逐级稀释,得到质量浓度为0.041 20、0.103 0、0.206 0、1.030、3.090、4.944及6.180 μg·mL-1的系列标曲工作溶液。取适量质控储备液用50%甲醇稀释,得到质量浓度分别为4.168、2.084、0.125 0及0.041 68 μg·mL-1的系列工作溶液。未知样品测定中按照如上方法称量及稀释,得到质量浓度为0.039 36、0.098 40、0.196 8、0.984 0、2.952、4.723、5.904 μg·mL-1的系列标准曲线工作溶液及质量浓度分别为4.024、2.012、0.120 7及0.040 24 μg·mL-1的系列质控工作溶液。
内标工作溶液:取孟鲁司特-d6对照品约2 mg,精密称定后用90%甲醇溶解得到质量浓度为206.5μg·mL-1的内标储备液。取该储备液适量,用50%甲醇稀释,得到质量浓度为2.065 μg·mL-1的方法学内标工作溶液,未知样品测定按照同样方法配制,得到质量浓度为2.037 μg·mL-1的内标工作溶液。
2.3 样品处理与测定精密移取于室温下融化的空白或受试者血浆95 μL置于EP管中,加入不同浓度分析物工作溶液(受试者血浆更换为50%甲醇)及内标工作溶液各5 μL,涡旋震荡1 min后加入乙腈300 μL,涡旋5 min,13 000 r·min-1离心5 min,移取上清液100 μL,至另一EP管中,加入40%乙腈900 μL,涡旋震荡1 min,13 000 r·min-1离心2 min,取上清,进样5 μL分析,记录孟鲁司特及内标峰面积用于计算浓度。
2.4 给药与采血方案经兰州大学第一医院伦理委员会批准。12名健康成年男性受试者中,8名参与空腹试验,4名参与餐后试验。试验开始前一天晚上18:00前(确保给药10 h之前入住),受试者入住Ⅰ期病房,入住当晚21:00后停止任何食物的摄入。试验过程中,受试者需要在Ⅰ期临床病房入住到给药后24 h,在这期间统一进餐。受试者在给药前后1 h内禁止饮水,给药后4、10 h给予标准餐。试验期间受试者禁止喝茶、咖啡、含咖啡因饮料和葡萄柚汁,并禁止吸烟。服药方法为早晨空腹或进食高脂(约50%的总热量)、高热量(约800~1 000 kcal)试验餐后30 min后以240 mL温开水一次性送服孟鲁司特钠颗粒1袋(0.5 g:4 mg(以孟鲁司特计))。受试者给药前(0 h)和给药后0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00、5.00、6.00、7.00、8.00、10.00、12.00和24.00 h通过静脉留置导管或者金属针头静脉穿刺的方法由上肢肘静脉进行采血。试验过程共设计16个取样点,每个点取血量约4 mL。采集的血液置含肝素钠的离心管中,离心10 min(4 000 r·min-1),所得血浆分成2份(一管1.0 mL,另一管约0.5 mL)。1份血浆样品(1.0 mL)用于含量测定,1份样品作为备份。使用棕色冻存管保存,并在采血后60 min内储存于大约-70 ℃环境中保存待测。
2.5 数据处理采用Phoenix WinNonLin 6.4软件,以非房室模型(NCA)法拟合计算相关的药动学参数,采用IBM SPSS STATISTICS 19软件将所得孟鲁司特的主要药动学参数的差异进行显著性检验。
3 结果 3.1 方法专属性按照选定的液相色谱-质谱联用条件,分别测定6个不同来源的空白血浆、空白血浆孟鲁司特(309.0 ng·mL-1)、空白血浆+内标、空白血浆+孟鲁司特(2.060 ng·mL-1)+内标(LLOQ+内标)以及受试者血浆样品,结果见图 1。结果表明,血浆样品中的内源性物质不会影响孟鲁司特以及内标的分离测定,血浆中孟鲁司特和内标的保留时间均为0.59 min。由碰撞室交叉干扰试验可得,孟鲁司特与内标峰面积无显著变化,二者出峰位置无杂峰干扰。滞留效应考察表明,药物及内标在进样分析以后,对此后进样分析的样品无干扰,即本分析方法无滞留效应。
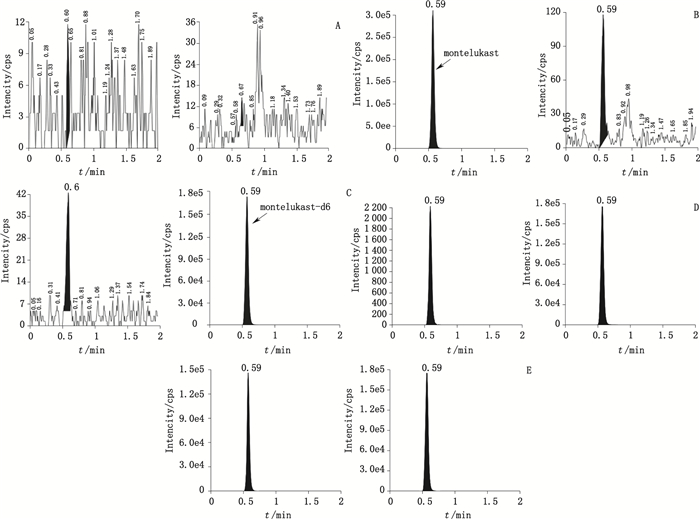
|
A.空白血浆(blank plasma)B.空白血浆+孟鲁司特(309.0 ng·mL-1)、(blank plasma spiked with 309.0 ng·mL-1 montelukast)C.空白血浆+内标(blank plasma spiked with IS)D.空白血浆+孟鲁司特(2.060 ng·mL-1)+内标(blank plasma spiked with 2.060 ng·mL-1 montelukast and IS)E.受试者C01口服孟鲁司特钠颗粒(0.5 g)3.5 h后血浆样品(3.5 h plasma sample obtained following an oral does of montelukast sodium granules(0.5 g)to subject C01 along with IS) 图 1 血浆中孟鲁司特和内标(孟鲁司特-d6)色谱图 Figure 1 Representative chromatograms of montelukast and IS(montelukast-d6) in human plasma |
按照“2.3”项下操作,将孟鲁司特系列标准曲线工作溶液加入空白血浆中制备质量浓度分别为2.060、5.150、10.30、51.50、154.5、247.2、309.0 ng·mL-1的标准曲线样品进行测定。以血浆样品中孟鲁司特峰面积与内标峰面积比值(Y)对血浆中孟鲁司特质量浓度(C)作加权回归,权重为1/C2,得回归方程:
Y=0.007 432C-0.000 338 4 r2=0.998 1
表明血浆中孟鲁司特的质量浓度在2.060~309.0 ng·mL-1范围内与孟鲁司特峰面积和内标峰面积的比值具有良好的线性关系。本方法定量下限为2.060 ng·mL-1,该浓度的标准血浆样品的精密度RSD(n=6)为3.2%,准确度在96.1%~106.0%之间。
3.3 精密度及准确度按照“2.3”项下操作,制备质量浓度分别为2.084、6.250、104.2及208.4 ng·mL-1的孟鲁司特质控样品各6份进行测定,计算精密度与准确度。每个浓度同一分析批内测定结果RSD考察日内精密度,以不同天的3个分析批的RSD计算日间精密度,结果见表 1。
|
|
表 1 血浆中孟鲁司特测定的准确度、日内及日间精密度、提取回收率(n=6) Table 1 Accuracy, intra-and inter-day precisions, and extraction recoveries of montelukast in plasma |
按照“3.3”项下操作,制备低、中、高(6.250、104.2、208.4 ng·mL-1)3个浓度的质控样品各6份,进样5 μL分析记录孟鲁司特峰面积和内标峰面积,以此作为样品提取后测定的峰面积,记作REC.PRE。将空白血浆按照同样的处理方法提取后向其中分别加入低、中、高3个不同浓度的孟鲁司特工作溶液后处理,进样5 μL,记录孟鲁司特峰面积与内标峰面积,以此作为孟鲁司特样品未提取测定的峰面积,记作REC.POST。以不同浓度配制样品提取后测定的峰面积(REC.PRE)分别与相同浓度未提取样品测定的峰面积(REC.POST)平均值之比计算提取回收率。结果见表 1。由表 1可知,低、中、高3个浓度的样品回收率相似,均在100%左右,符合CFDA《化学药物临床药代动力学研究技术指导原则》相关要求。
3.5 基质效应取去离子水40 μL,精密加入孟鲁司特质控及内标工作溶液各5 μL以及乙腈300 μL,涡旋震荡1 min,取上述溶液100 μL加入40%乙腈900 μL,涡旋震荡1 min,即得基质效应的NEAT样品,进样5 μL。选择6种不同来源的普通空白血浆、溶血血浆、高脂血浆,参照提取回收率项下REC.POST的做法得到MAT样品,进样5 μL。公式:绝对基质效应(matrix factor,MF)=待测物或内标在MAT中的峰面积和NEAT中峰面积均值的比值,内标归一化基质效应因子(IS-normalized MF)=待测物与内标的MF的比值;相对基质效应=IS-normalized MF的相对标准偏差(RSD),结果见表 2。由表 2可知,正常、溶血及高脂血浆中孟鲁司特的绝对基质效应均小于15%,符合相关指导原则的要求。
|
|
表 2 不同血浆孟鲁司特的相对基质效应(n=6) Table 2 IS-normalized matrix effect of montelukast in differerent plasma |
制备低、高浓度(6.250、208.4 ng·mL-1)标准血浆样品,考察其在不同条件下的稳定性。将处理后样品于4℃冰箱中放置24 h后,测得结果与0 h相比,偏差为3.6%(n=6);置室温条件下放置4 h后测定,与0 h相比偏差为-3.1%(n=6);反复冻融3次后测定与0次冻融结果相比偏差为2.8%(n=6);于冰冻条件(-70℃)下保存40 d后测定,与0 d相比偏差为4.5%(n=6);采血过程中,将空腹8位受试者3.5 h及10 h全血分出约1 mL于室温下放置1 h后进行离心后处理测定。以放置1 h的血浆样品与0 h的血浆样品测得值的偏差考察全血稳定性,结果表明全血在室温下放置1 h后离心测定值与放置0 h测定结果偏差在-9.4%~13.7%范围内。稳定性考察结果表明孟鲁司特在各考察条件下均稳定。
3.7 药动学研究结果12名受试者单剂量空腹或餐后口服孟鲁司特钠颗粒1袋(0.5 g:4 mg(以孟鲁司特计))后,血药浓度均值药-时曲线见图 2,计算所得相关药动学参数结果见表 3。服用高脂餐后,AUC较空腹时增加约30%,Cmax较空腹时下降约15%,但进行t检验,结果二者p值均 > 0.05,表明两组间AUC及Cmax的差异不具有统计学意义,即早晨给予高脂餐,不影响孟鲁司特钠颗粒在体内的吸收程度。由图 2可明显看出,餐后孟鲁司特血药浓度达峰时间明显延迟,并且Tmax经秩和检验,结果p值为0.008 < 0.05,即差异具有统计学意义,表明高脂餐会延缓孟鲁司特钠颗粒的吸收速度,将孟鲁司特达峰时间由(2.56±0.62)h延缓至(5.38±1.49)h。T1/2、V/F、Cl/F等参数经t检验,p值均 > 0.05,即空腹及餐后试验中各参数的差异不具有统计学意义。以上研究结果与FDA关于孟鲁司特钠颗粒(顺尔宁®)的说明书中的结果一致。

|
图 2 12名健康受试者空腹/餐后口服孟鲁司特钠颗粒后的平均药-时曲线图 Figure 2 Mean plasma concentration-time curves of montelukast in 12 healthy volunteers following an oral does of montelukast sodium granules(0.5 g) under the condition of fasting or fed |
|
|
表 3 受试者口服孟鲁司特钠颗粒后的药动学参数(空腹n=8,餐后n=4) Table 3 Pharmacokinetic parameters of healthy volunteersafter oral administration of montelukast sodium granules(fasting, n=8;fed, n=4) |
孟鲁司特在其含硫侧链的次甲基上有手性中心存在,存在R及S 2种不同的构型,在体内复杂的生物条件下,可能会存在2种构型间的转化。Lida Liu等采用HPLC联合柱切换方法考察孟鲁司特在体内可能发生的构型转化,在6名健康受试者连续7 d服用10 mg孟鲁司特后,于第7天采血进行分析,结果在血浆样品中并未定量检测到S构型的孟鲁司特的存在,表明体内并无明显的S构型转化[19]。同时,因为双键的存在,孟鲁司特钠还存在顺反异构体[20]。在光照条件下,孟鲁司特会向顺式异构体转化,导致在一定的色谱条件下,出现2个明显分离的峰,并且在光照后,其中1个峰面积变大,另一个峰面积变小。所以需要全程避光进行整个试验操作。
本试验建立了测定人血浆中孟鲁司特的HPLC-MS/MS法,并从专属性、线性、精密度与准确度、提取回收率、不同血浆基质效应、稀释准确度以及稳定性等方面进行了全面的考察,满足生物样品的分析要求。且方法分析时间短,将每个样品分析时缩短至2 min,方法稳定,所用血浆样本量少,适用于孟鲁司特钠颗粒的体内药动学研究。且本试验采用受试者真实血样证明了含药全血在室温放置1 h过程中孟鲁司特的含量可保持稳定,为临床实验采血过程中全血不能及时离心的情况提供了强有力的数据支持。本试验研究了孟鲁司特钠颗粒在中国成年健康受试者体内的药动学行为,并考察高脂餐对该制剂体内行为的影响,为该制剂的进一步研究及临床使用提供了参考。
| [1] |
JONES TR, LABELLE M, BELLEY M, et al. Pharmacology of montelukast sodium (Singulair), a potent and selective leukotriene D4 receptor antagonist[J]. Canadian J Physiol Pharmacol, 1995, 73(2): 191. DOI:10.1139/y95-028 |
| [2] |
VIRCHOW JC, FAEHNDRICH S, NASSENSTEIN C, et al. Effect of a specific cysteinyl leukotriene-receptor 1-antagonist (montelukast) on the transmigration of eosinophils across human umbilical vein endothelial cells[J]. Clin Exp Allergy, 2001, 31(6): 836. DOI:10.1046/j.1365-2222.2001.01051.x |
| [3] |
ABUALHASAN ANZ, WATSON DG, MOUSA A, et al. Investigation of the bioequivalence of montelukast chewable tablets after a single oral administration using a validated LC-MS/MS method[J]. Drug Des Devel Ther, 2015, 9: 5315. |
| [4] |
MUPPAVARAPU R, GUTTIKAR S, RAJAPPAN M, et al. Sensitive LC-MS/MS-ESI method for simultaneous determination of montelukast and fexofenadine in human plasma:application to a bioequivalence study[J]. Biomed Chromatogr, 2014, 28(8): 1048. DOI:10.1002/bmc.v28.8 |
| [5] |
同丽萍, 关月, 刘渝, 等. 对孟鲁司特钠分散片的人体生物等效性研究[J]. 药学服务与研究, 2010, 10(5): 371. TONG LP, GUAN Y, LIU Y, et al. Bioequivalence of montelukast sodium dispersible in human body[J]. Pharm Care Res, 2010, 10(5): 371. |
| [6] |
CHALLA BR, AWEN BZ, CHANDU BR, et al. Method development and validation of montelukast in human plasma by HPLC coupled with ESI-MS/MS:application to a bioequivalence study[J]. Sci Pharm, 2010, 78(3): 411. DOI:10.3797/(ISSN)0036-8709 |
| [7] |
PATEL NK, SUBBAIAH G, SHAH H, et al. Rapid determination of montelukast in human plasma by LC-ESI-MS/MS and its application to a bioequivalence study[J]. Anal Lett, 2009, 42(13): 2041. DOI:10.1080/00032710903082721 |
| [8] |
BHARHTHI DV, HOTHA KK, JAGADEESH B, et al. Quantification of montelukast, a selective cysteinyl leukotriene receptor (CysLT1) antagonist in human plasma by liquid chromatography-mass spectrometry:validation and its application to a human pharmacokinetic study[J]. biomed chromatogr, 2009, 23(8): 804. DOI:10.1002/bmc.v23:8 |
| [9] |
SRIPALAKIT P, KONGTHONG B, SARAPHANCHOTIWITTHAYA A. A simple bioanalytical assay for determination of montelukast in human plasma:application to a pharmacokinetic study[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2008, 869(1-2): 38. DOI:10.1016/j.jchromb.2008.05.017 |
| [10] |
张相林, 李凯鹏, 丁庆明, 等. 孟鲁司特钠药动学及其国产片剂/咀嚼片剂人体相对生物利用度研究[J]. Chin J New Drugs, 2006, 15(9): 728. ZHANG XL, LI KP, DING QM, et al. Pharmacokinetics and relative bioavilability of montelukast film-coated tablets and chewable tablets[J]. Chin J New Drugs, 2006, 15(9): 728. |
| [11] |
ALASARRA IA. Development of a stability-indicating HPLC method for the determination of montelukast in tablets and human plasma and its application to pharmacokinetic and stability studies[J]. Saudi Pharm J, 2004, 12(4): 136. |
| [12] |
FEY C, THYROFF-FRIESINGER U, JONES S. Bioequivalence of two formulations of montelukast sodium 4 mg oral granules in healthy adults[J]. Clin Transl Allergy, 2014(4): 29. |
| [13] |
于广华, 张凤武. 高效液相色谱法测定孟鲁司特钠散的含量[J]. 黑龙江医药, 2016, 26(1): 18. YU GH, ZHANG FW. Determination of the content of montelukast sodium by high performance liquid chromatography(HPLC)method[J]. Heilongjiang Med J, 2016, 26(1): 18. |
| [14] |
VEKARIA H, LIMBASIYA V, PATEL P. Development and validation of RP-HPLC method for simultaneous estimation of montelukast sodium and fexofenadine hydrochloride in combined dosage form[J]. J Pharm Res, 2013, 6(1): 134. |
| [15] |
SINGH RR, RATHNAM MV. A stability-indicating method for the estimation of montelukast sodium and fexofenadine hydrochloride in pharmaceutical preparations[J]. Intern J Pharm Pharm Sci, 2011, 4(2): 587. |
| [16] |
RASHMITHA N, RAJ TJ, SRINIVAS N, et al. A validated RP-HPLC method for the determination of impurities in montelukast sodium[J]. E-J Chem, 2009, 7(2): 555. |
| [17] |
RADHAKRISHNANAND P, SUBBA RAO DV, SURENDRANATH KV, et al. A validated LC method for determination of the enantiomeric purity of montelukast sodium in bulk drug samples and pharmaceutical dosage forms[J]. Chromatographia, 2008, 68(3-4): 263. DOI:10.1365/s10337-008-0684-5 |
| [18] |
TANDULWARDKA SS, MORE SJ, RATHORE AS, et al. Method development and validation for the simultaneous determination of fexofenadine hydrochloride and montelukast sodium in drug formulation using normal phase high-performance thin-layer chromatography[J]. ISRN Anal Chem, 2012, 2012: 1. |
| [19] |
LIDA L, HAIYUNG C, JAMIE JZ, et al. Determination of montelukast (MK-0476) and its S-enantiomer in human plasma by stereoselective high-performance liquid chromatography with column-switching[J]. J Pharm Biomed Anal, 1997, 15: 631. DOI:10.1016/S0731-7085(96)01894-8 |
| [20] |
AL-OMARI MM, ZOUBI RM, HASAN EI, et al. Effect of light and heat on the stability of montelukast in solution and in its solid state[J]. J Pharm Biomed Anal, 2007, 45(3): 465. DOI:10.1016/j.jpba.2007.07.014 |
 2018, Vol. 38
2018, Vol. 38 
