2. 山东省济南市槐荫区疾病预防控制中心, 济南 250000;
3. 山东大学药学院, 济南 250012
2. Huaiyin Municipal Center for Disease Control and Prevention, Jinan 250000, China;
3. Pharmaceutics College of Shandong University, Jinan 250012, China
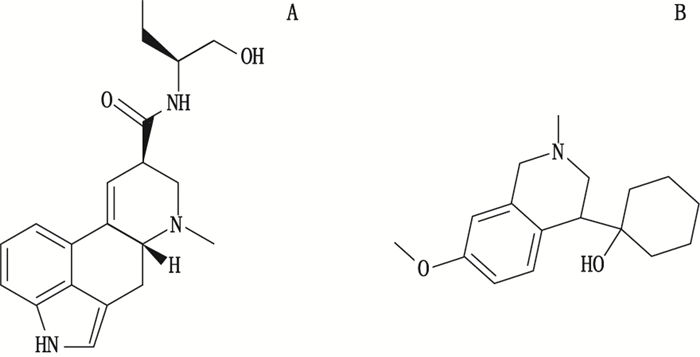
马来酸甲麦角新碱(methylergonovine maleate),化学名称为(8β)-9,10-二脱氢-N-[(1S)-1-(羟甲基)丙基]-6-甲基麦角灵-8-甲酰胺顺丁烯二酸盐(结构式见图 1),剂型为片剂和注射液,目前国内还未上市。马来酸甲麦角新碱可直接作用于子宫平滑肌,调节其张力及节律性收缩的速率和幅度,低剂量可产生交替性收缩与松弛,而高剂量时则会引起强力持久的收缩作用[1],用于预防和治疗因子宫收缩乏力或子宫复位不完全而引起的流产或产后出血[2-5]。近些年来,甲麦角新碱的应用也涉及到变异性心绞痛[6]、头痛[7-9]及化疗增敏剂等领域[10]。
|
图 1 甲麦角新碱(A)和内标文拉法辛(B)结构式 Figure 1 Chemical structures of methylergonovine(A) and internal standard venlafaxine (B) |
甲麦角新碱口服制剂生物利用度不佳[11],肌注用药则可明显提高生物利用度水平,快速产生有效子宫收缩。国外有文献报道,口服2.67 mg或静脉给药1.0 mg的二甲麦角新碱后,其代谢产物甲麦角新碱的消除半衰期分别为(223±43)min和(174±35)min,慢于其原型药物的消除速度[12]。口服0.125 mg甲麦角新碱后,男性消除速率慢于女性[半衰期分别为(2.08±0.43)h、(1.42±0.31 h][13]。
目前测定生物样本中麦角生物碱的方法主要有HPLC检测法,该种方法灵敏度较低,无法满足低剂量生物样本检测的要求[14-16]。本文建立的LC-MS/MS检测方法,单个样本分析仅需4 min即可完成,方法简便易行、准确可靠,定量下限(LLOQ)可达0.025 ng·mL-1,为肌注0.2 mg马来酸甲麦角新碱注射液的药动学研究提供有力保障。
1 仪器与材料 1.1 仪器美国Applied BiosystemSciex公司API 4000型串联四极杆质谱仪,配有电喷雾离子源(ESI)及Analyst 1.4.2数据处理系统;美国Agilent 1100高效液相色谱仪;CAPCELL CORE C18色谱柱(填料:十八烷基硅烷键合硅胶;2.1 mm×100 mm,2.7 μm,日本SHISEIDO公司)。
1.2 药品与试剂对照品马来酸甲麦角新碱(批号72621000213)、盐酸文拉法辛(批号100543-200401)购于中国食品药品检定研究院;马来酸甲麦角新碱注射液,规格为1 mL:0.2 mg,批号20140301,济南宏拓医药科技有限公司提供。乙酸铵:色谱纯,天津市科密欧化学试剂公司;乙酸:色谱纯,TEDIA公司;甲醇:色谱纯,Fisher公司;乙酸乙酯:分析纯,国药集团化学试剂有限公司。
2 方法 2.1 条件色谱条件:采用CAPCELL CORE C18色谱柱(2.1 mm×100 mm,2.7 μm),流动相为0.05%乙酸-水(5 mmol·L-1乙酸铵,0.05%乙酸)(65:35),流速0.35 mL·min-1,柱温35 ℃,进样量3μL。
质谱条件:离子源为电喷雾电离源(ESI);扫描方式为多反应监测(MRM),正离子扫描方式,电喷雾电压4.0 kV;离子源温度400 ℃;气帘气0.24 MPa;雾化气0.34 MPa;辅助气0.34 MPa;用于定量分析的甲麦角新碱离子对和文拉法辛(内标)的离子对分别为m/z 340.2→208.1和m/z 278.3→215.1;解簇电压分别为125 V,60 V;碰撞诱导解离电压为40 V,22 V。
2.2 溶液配制精密称取马来酸甲麦角新碱对照品13.46 mg,置于10 mL量瓶中,加入30%甲醇水溶解并定容至刻度,制得质量浓度为1 mg·mL-1的甲麦角新碱储备液;精密量取上述浓溶液1 mL,置于100 mL量瓶中,加入30%甲醇水溶解并定容至刻度,制得质量浓度为10 μg·mL-1的甲麦角新碱溶液,冰箱(2~8 ℃)内保存备用。
内标溶液:精密称取文拉法辛对照品10.09 mg,置于10 mL量瓶中,加入50%甲醇水溶解并定容至刻度,制得质量浓度为1.0 mg·mL-1的文拉法辛储备液;精密量取上述浓溶液1 mL,置于100 mL量瓶中,加入50%甲醇水溶解并定容至刻度,制得质量浓度为10μg·mL-1的文拉法辛浓溶液。精密量取10 μg·mL-1文拉法辛浓溶液1 mL于10 mL量瓶中,用30%甲醇水稀释成质量浓度为1 μg·mL-1的溶液,再取该溶液1 mL于100 mL量瓶中,用30%甲醇水稀释成10 ng·mL-1的文拉法辛内标液,冰箱(2~8 ℃)内保存备用。
2.3 样品处理方法取用药后血浆1 mL,依次加入30%甲醇水200 μL,内标溶液200 μL和1 mol·L-1氢氧化钠溶液100 μL,涡旋2 min,再加入乙酸乙酯3.5 mL,涡旋2 min,往复震荡15 min,4 000 r·min-1离心6 min,取上清,45 ℃水浴下吹干,加200μL 50%甲醇水复溶,涡旋2 min,14 000 r·min-1离心10 min,取上清3 μL进样。
2.4 样品采集与测定经山东大学第二医院伦理委员会批准,16名健康女性志愿者,年龄(24.2±1.6)岁,体重指数BMI(20.12±1.05),所有受试者均签署知情同意书,于试验前统一体格检查,肝肾功能正常,无急慢性疾病及家族遗传病史。试验前2周内无用药史,3月内分别未参加其他药物临床试验。所有受试者于试验前禁食10 h,试验当日单次肌肉注射0.2 mg马来酸甲麦角新碱注射液,并于用药前(0 h)和用药后5、10、20 min及0.5、0.75、1、1.5、2、3、4、5、6、8 h取肘静脉血4 mL,分离血浆,采用本文中建立的LC-MS/MS法测定血浆中甲麦角新碱浓度,DAS2.1.0分析其主要药动学参数。
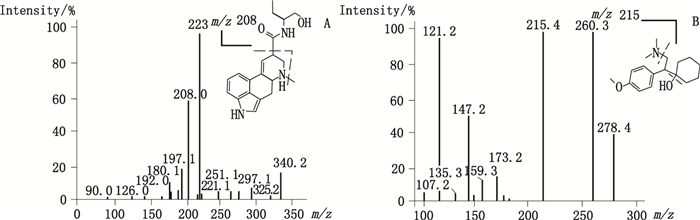
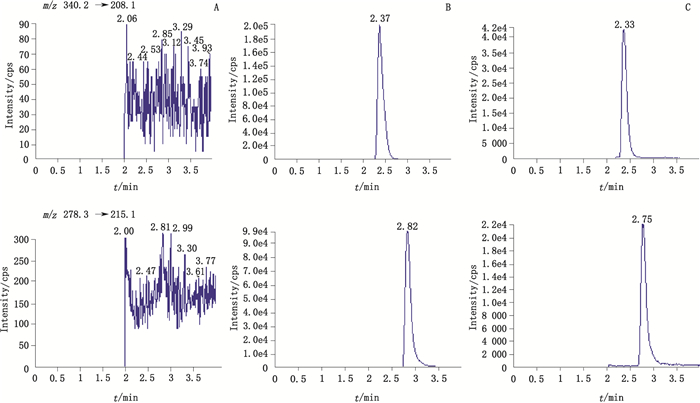
3 结果 3.1 方法专属性甲麦角新碱对照品和内标二级质谱图见图 2,空白血浆及志愿者血浆样本色谱图见图 3,结果表明血浆中内源物质无干扰。
|
图 2 甲麦角新碱(A)和内标(B)二级质谱图 Figure 2 Product ion mass-spectrogram of methylergonovine (A) and IS(B) |
|
A.空白血浆(blank plasma sample)B.空白血浆+甲麦角新碱(5.0 ng·mL-1)+内标(10.0 ng·mL-1)(blank plasma sample spiked with mifepristone at 5.0 ng·mL-1 and IS at 10.0 ng·mL-1)C.受试者药后血浆+内标(volunteer plasma sample after administration spiked with IS) 图 3 甲麦角新碱和内标的色谱图 Figure 3 Representative chromatograms for methylergonovine and IS in human plasma |
取空白血浆适量,分别加入定量的甲麦角新碱对照品溶液,配制系列标准血浆样品,其药物浓度为0.025、0.2、0.5、1、2、5、10 ng·mL-1;按照前述样品处理方法处理,采用加权(W=1/X2)最小二乘法进行线性回归,观察甲麦角新碱与内标的色谱图峰面积比与相应两者浓度比的相关性。甲麦角新碱的直线回归方程:
Y=1.29X+0.000 896 r=0.999 2
线性范围为0.025~10 ng·mL-1。本法定量下限为0.025 ng·mL-1(S/N > 10),该浓度质控样品(n=5)的精密度RSD为4.3%,准确度在101.6%~ 110.8%之间。
3.3 提取回收率和基质效应取空白血浆,加入适量甲麦角新碱溶液,配成甲麦角新碱的定量下限、低、中、高四浓度(0.025、0.05、1.0、8.0 ng·mL-1,下同)的标准血浆样品各5份,按“2.3”项下方法处理测得各浓度峰面积;取空白血浆,按“2.3”项下方法处理(将内标换成30%甲醇水),处理后分别加入200 μL含有相应浓度的甲麦角新碱溶液或内标溶液,测得峰面积;取适量甲麦角新碱溶液和内标溶液测定,得峰面积;基质效应和提取回收率结果见表 1。
|
|
表 1 血浆中甲麦角新碱基质效应和提取回收率(%,n=5) Table 1 Matrix effects and recovery of methylergonovine in plasma |
取定量下限、低、中、高四浓度的甲麦角新碱质控血浆,按照“2.3”项下方法处理后进样分析,计算精密度和准确度(n=5);1 d内测定5次,计算日内变异;连续测定5 d计算日间变异。结果见表 2。
|
|
表 2 血浆中甲麦角新碱精密度与准确度(n=5) Table 2 Accuracy and precision of methylergonovine in plasma |
取定量下限、低、中、高四浓度的甲麦角新碱质控血浆,考察-20 ℃存放30 d和2次冻融循环,室温放置6 h及样品处理后室温放置6 h对甲麦角新碱稳定性的影响,试验结果见表 3。
|
|
表 3 血浆中甲麦角新碱稳定性考察 Table 3 Stability test of methylergonovine in plasma |
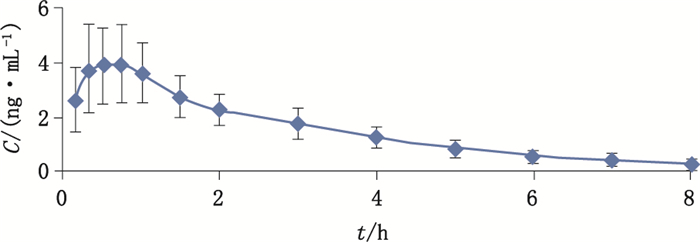
16名受试肌肉注射0.2 mg马来酸甲麦角新碱注射液后,甲麦角新碱药动学特点符合两室模型,主要统计矩参数见表 4。16名受试者平均血药浓度-时间曲线见图 4。研究结果显示马来酸甲麦角新碱肌注后吸收较快,0.5 h左右即可达峰;安全性观察发现部分受试者用药后发生恶心、呕吐及头痛等不良事件,但程度均为轻微。
|
|
表 4 16名受试者肌注0.2 mg马来酸甲麦角新碱后甲麦角新碱主要药动学参数 Table 4 Pharmacokinetic parameters for 16 subjects intramuscular injection of 0.2 mg methylergonovine maleate |
|
图 4 16名受试者单次肌注0.2 mg马来酸甲麦角新碱注射液后甲麦角新碱平均血药浓度-时间曲线 Figure 4 Mean plasma concentration-time curve of methylergonovine in 16 subjects after a single intramuscular injection of 0.2 mg methylergonovine maleate injection |
文献中关于生物样本中甲麦角新碱的分析测定方法主要为HPLC法,Nakamichi T等[4]采用固相萃取法处理乳汁样本后进行液相色谱分析,建立的分析方法灵敏度为0.05 ng·mL-1。本文建立的LC-MS/MS分析方法采用正离子模式检测血浆中甲麦角新碱,方法建立过程中,首先对流动相进行了优化,发现流动相中使用乙腈时,待测物离子化强度不稳定,改为甲醇后可有效改善,同时可获得较为理想的保留时间和峰形;此外为稳定流动相pH,在流动相中加入0.05%乙酸和5 mmol·L-1的乙酸铵,进一步提高测试条件的稳定性。为进一步提高分析方法的灵敏度,本文使用了液液萃取浓缩的方法,有效改善检测能力,方法最低定量下限可达0.025 ng·mL-1。
经方法学证实,文中建立的测试方法灵敏准确,简单易行,可用于甲麦角新碱低水平血药浓度的测定,适用于低剂量甲麦角新碱药代动力学研究。文献报道静脉给药0.2 mg甲麦角新碱后,其体内代谢特征符合两室模型,消除半衰期为(1.94±0.34)h(男)和(1.85±0.28)h(女),本研究中,16名受试者单次肌注0.2 mg马来酸甲麦角新碱注射液后,甲麦角新碱体内药动学特征与文献报道[13]一致。
| [1] |
AUCH-SCHWELK W, PAETSCH I, KRACKHARDT F, et al. Modulation of contractions to ergonovine and methylergonovine by nitric oxide and thromboxane A2 in the human coronary artery[J]. J Cardiovasc Pharmacol, 2000, 36(5): 631. DOI:10.1097/00005344-200011000-00013 |
| [2] |
de GROOT AN, van DONGEN PW, VREE TB, et al. Ergot alkaloids, current status and review of clinical pharmacology and therapeutic usecompared with other oxytocics in obstetrics and gynaecology[J]. Drugs, 1998, 56(4): 523. DOI:10.2165/00003495-199856040-00002 |
| [3] |
American College of Obstetricians Gynecologists. ACOG practice bulletin:clinical management guidelines for obstetrician-gynecologists, postpartum hemorrhage[J]. Obstet Gynecol, 2006, 108(4): 1039. DOI:10.1097/00006250-200610000-00046 |
| [4] |
SCHIFF PL. Ergot and its alkaloids[J]. Am J Pharm Educ, 2006, 15;70(5): 98. |
| [5] |
MANRIQUE MUNOZ S, MUNAR BAUZÀ F, FRANCES GONZALEZ S, et al. Update on the use of uterotonicagents[J]. Rev EspAnestesiol Reanim, 2012, 59(2): 91. DOI:10.1016/j.redar.2012.02.019 |
| [6] |
IGARASHI Y, YAMAZOE M, SHIBATA A. Effect of direct intracoronary administration of methylergonovine in patients with and without variant angina[J]. Am Heart J, 1991, 121(4 Pt 1): 1094. |
| [7] |
GRAFFRADFORD SB, BITTAR GT. The use of methylergonovine (methergine) inthe initial control of drug-induced refractory headache[J]. Headache, 1993, 33(7): 390. DOI:10.1111/hed.1993.33.issue-7 |
| [8] |
MUELLER L, GALLAGHER RM, CIERVO CA. Methylergonovine maleate as a clusterheadache prophylactic:a study and review[J]. Headache, 1997, 37(7): 437. DOI:10.1046/j.1526-4610.1997.3707437.x |
| [9] |
NIÑO-MALDONADO AI, CABALLERO-GARCÍA G, MERCADO-BOCHERO W, et al. Efficacy and tolerability of intravenous methylergonovine in migraine female patients attending the emergency department:a pilot open-label study[J]. Head Face Med, 2009, 8(5): 21. |
| [10] |
ZHAI D, JIN C, SATTERTHWAIT AC, et al. Comparison of chemical inhibitors of antiapoptotic Bcl-2-family proteins[J]. Cell Death Differ, 2006, 13(8): 1419. DOI:10.1038/sj.cdd.4401937 |
| [11] |
de GROOT AN, van DONGEN PW, VREE TB, et al. Oral administration of methylergometrine shows a late and unpredictable effect on the non-pregnant human menstruating uterus[J]. Eur J Obstet Gynecol Reprod Biol, 1995, 60(2): 101. DOI:10.1016/0028-2243(95)02100-7 |
| [12] |
de GROOTAN, VREETB, HEKSTERYA, et al. Comparison of the bioavailability and pharmacokinetics of oral methylergometrine in men and women[J]. Int J Clin Pharmacol Ther, 1995, 33(6): 328. |
| [13] |
MURDAY M, MCLEAN AM, SLAUGHTER E, et al. Determination of dihydroergotamine in human plasma by high-performance liquid chromatography with fluorescence detection[J]. J Chromatogr B Biomed SciAppl, 1999, 735(2): 151. DOI:10.1016/S0378-4347(99)00405-3 |
| [14] |
SMITH HT, MOLINARO NC. High-performance liquid-chromatographic method for the determination of methysergide and methylergonovine inhuman-plasma[J]. J Chromatogr, 1988, 424(2): 416. |
| [15] |
NAKAMICHI T, YAWATA A, HOJO H, et al. Chikuma, monitoring of methylergometrine in human breast milk by solid-phaseextraction and high-performance liquid chromatography with fluorimetricdetection[J]. Pharmazie, 2012, 67(6): 482. |
 2018, Vol. 38
2018, Vol. 38 
