2. 第三军医大学新桥医院内分泌科, 重庆 400037
2. Department of Endocrinology, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
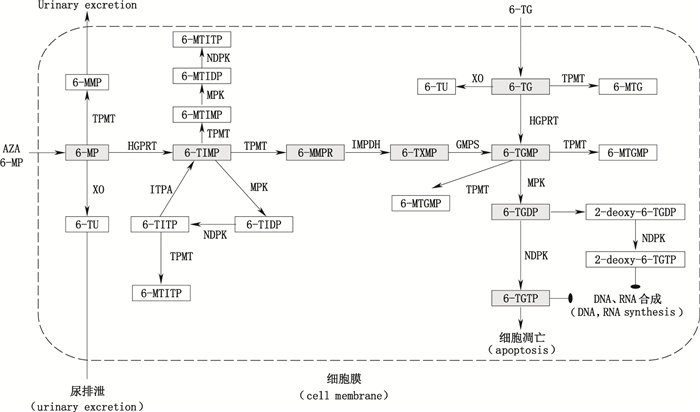
嘌呤类药物,包括硫唑嘌呤、6-巯基嘌呤及6-硫鸟嘌呤等,于临床应用已有50余年历史。近年来主要作为细胞周期特异性抗肿瘤药应用于急性淋巴细胞性白血病,或作为免疫抑制药应用于慢性炎症性肠病、自身免疫性疾病的治疗及器官移植后抗排斥反应等。嘌呤类药物治疗窗较窄,药物反应个体差异明显,不良反应发生率高达10%~30%[1],严重影响患者的生活质量,甚至威及生命。此类药物均为无活性的前体药物,其生物体内活性代谢物为6-硫鸟嘌呤核苷酸(6-thioguanine nucleotides,6-TGNs),包括6-硫鸟嘌呤核苷单磷酸(6-thioguanosine monophosphate,6-TGMP)、6-硫鸟嘌呤核苷二磷酸(6-thioguanosine diphosphate,6-TGDP)及6-硫鸟嘌呤核苷三磷酸(6-thioguanosine triphosphate,6-TGTP)。6-TGNs可通过整合至DNA或RNA分子上,抑制核酸生物合成并引起DNA损伤,引起细胞周期特异性凋亡,从而发挥药理作用或产生不良反应[2]。代谢途径见图 1 [2]。
|
图 1 嘌呤类药物体内代谢途径 Figure 1 Metabolic pathway of the purines drug in vivo |
本课题组前期研究发现,人类红细胞(red blood cell,RBC)内嘌呤类药物活性代谢物6-TGNs主要表现形式为6-TGTP[3]。Shin等[4]研究指出,6-TGTP可直接作用于T细胞Rac1靶基因,抑制其激活并导致T细胞凋亡从而发挥其免疫抑制作用。6-TGTP的体内生成依赖于代谢酶核苷二磷酸激酶(nucleoside diphosphate kinase,NDPK)。NDPK作为一种内源性管家酶,也是生物体内重要的药物代谢酶,广泛分布于人体心、肝、脾、肾、脑及RBC等各组织中,其最首要的生物功能为催化5′-二磷酸核苷(5′-nucleoside diphosphate,5′-NDP)的γ-磷酸化作用,维持体内二磷酸核苷与三磷酸核苷代谢平衡。通过此磷酸根转移反应,NDPK可催化6-TGDP转化为活性代谢物6-TGTP及2-脱氧-6-巯基鸟嘌呤三磷酸(2-dexoy-6-thioguanosine triphosphate,2-dexoy-TGTP),6-TGTP和2-dexoy-TGTP可结合到细胞内DNA及RNA上,通过抑制DNA的复制及RNA的表达,干扰其功能[5]。因此,本课题组推测NDPK在嘌呤类药物个体差异及不良反应中可能具有重要的研究价值。
目前国内外针对NDPK生物学活性的研究非常广泛,热点主要集中在:(1)对多种肿瘤表现出肿瘤转移抑制活性[6-7];(2)作为关键药物代谢酶参与多种药物的体内活化过程[8-9]。此外也有文献报道NDPK具有调节血管生成[10]、神经元保护[11]及胰岛素分泌调节作用[12]。作为三磷酸活性代谢物的关键催化酶,已有报道指出NDPK参与如下药物的磷酸化活化过程:包括前文所述的嘌呤类药物,细胞生长抑制剂阿糖胞苷[8],抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)药物替诺福韦、司他夫定、齐多夫定等[9]。但对以NDPK为靶标,研究嘌呤类药物不良反应相关性尚未见报道。考虑到NDPK在RBC内呈游离状态[3],与人体其他组织中浓度及活性密切相关[13],且其活性远大于胞内其他多磷酸核苷酸及核酸合成酶活性,测定可不受干扰[14],本课题组在前期工作中建立的反相离子对HPLC法测定人RBC内NDPK活性的方法学[15]基础上进行了改进,并在此基础上进行了NDPK酶学动力学研究,探究了温度、pH对NDPK活性的影响以及酶促反应机制,旨在为进一步研究NDPK活性水平与嘌呤类药物不良反应相关性提供良好的实验基础,为后续分子机制及临床应用提供理论依据。
1 仪器与试药 1.1 仪器岛津LC-20AT Prominence高效液相色谱仪,包括LC-20AT输液泵、SPD-M20A PDA检测器、SIL-20A自动进样器、LGC-1025M柱温箱、CBM-20Alite系统控制器、LC-solution色谱工作站(Version 1.24);Waters SymmetryShield TM RP18色谱柱(150 mm × 3.9 mm,5 μm;填料:十八烷基硅烷键合硅胶;Waters公司);BS-1500M电子天平(上海有声衡器有限公司);AUW-220D电子分析天平(岛津公司);PHS-3B精密PH计(REX);XW-80A型微型旋涡混合器(上海医科大学仪器厂);THZ-B型水域恒温振荡器(国旺仪器);SORVALL Legend MICRO 21R型超速低温冷冻离心机(赛默飞世尔科技公司);优普系列超纯水器(成都超纯科技有限公司);BCD-216T XZ型冰箱(青岛海尔有限公司);MDF-382E型超低温冷冻冰箱(日本三洋电器集团)。
1.2 试剂四丁基硫酸氢铵、肌苷、二硫苏糖醇、dGTP、dADP、dATP和dGDP均购自美国Sigma公司。磷酸二氢钾(北京精求化工有限责任公司)、磷酸氢二钾(国药集团化学试剂有限公司)、氯化镁(国药集团化学试剂有限公司)、氢氧化钾(国药集团化学试剂有限公司)、磷酸(武汉市中天化工有限公司)均为分析纯。实验用水为超纯水,乙腈为色谱纯(Fisher Scientific)。
2 方法与结果 2.1 相关溶液配制 2.1.1 dADP标准储备液用超纯水配制浓度为24 mmol·L-1的dADP标准储备液,-80 ℃保存。
2.1.2 dGTP标准储备液用超纯水配制浓度为12 mmol·L-1的dGTP标准储备液,-80 ℃保存。
2.1.3 dATP标准储备液用超纯水配制浓度为10 mmol·L-1的dATP标准储备液,-80 ℃保存。
2.1.4 dGDP标准储备液用超纯水配制浓度为10 mmol·L-1的dGDP标准储备液,-80 ℃保存。
2.1.5 内标溶液用超纯水配制浓度为1.0 mmol·L-1的内标(internal standard,IS)标准液,4 ℃保存。
2.2 血样处理方法 2.2.1 溶血产物的制备采集健康志愿者空腹外周静脉血2 mL,EDTA 4mg抗凝。4 ℃,3 000 r·min-1离心10 min后分离出浓缩RBC。等体积4 ℃预冷生理盐水洗涤浓缩RBC 2次。后4 ℃预冷PBS(0.02 mol·L-1,pH 7.40)稀释浓缩RBC至1:20稀释液,得RBC裂解液,-80 ℃冻存。本研究经华中科技大学医学伦理委员会审核后进行,所有健康志愿者均自愿参加试验并签署知情同意书。
2.2.2 标准反应混合液配制于1.5 mL离心管中精密加入1.5 mmol·L-1 MgCl2溶液50 μL,3 mmol·L-1DTT溶液10 μL,0.4 mol·L-1 NH4H2PO4溶液(pH 7.00)200 μL,反应底物20 μL(3 mmol·L-1 dGTP标准溶液10 μL,6 mmol·L-1 dADP标准溶液10 μL),最后加入稀释RBC裂解液10 μL,混匀,以上步骤均在冰上操作。
2.2.3 样品处理方法反应混合液于37 ℃水浴5 min后,100 ℃沸水浴10 min以终止酶促反应。冰上冷却15 min,加入1 mmol·L-1内标溶液10 μL,混匀,13 000 r·min-1离心10 min,取上清液以超纯水1:1稀释,10 μL进样分析。
2.2.4 NDPK活性计算参照相关文献[3],并在此基础上进行改进,NDPK活性单位定义为:在37 ℃、pH 7.0、反应时间1 min条件下,含1 g血红蛋白的RBC裂解液催化反应底物dADP生成dGDP的分子摩尔数。计算公式:NDPK活性(μmol·min-1·g-1)=测定dGDP浓度(μmol·L-1)×体积(L)×RBC压积(%)×血红蛋白(g-1)×时间(min-1)。
2.3 色谱条件参照方法学文献[15]建立、改进色谱条件并进行系统论证。色谱柱:Waters SymmetryShield TM RP18(150 mm × 3.9 mm,5 μm);流动相:流动相A为20 mmol·L-1KH2PO4-K2HPO4缓冲液(加入5 mmol·L-1离子对试剂四丁基硫酸氢铵),流动相B为乙腈,采用梯度洗脱(0~2.0 min,6%B→13%B,流速0.50 mL·min-1;2.0~7.0 min,13%B,流速0.50 mL·min-1;7~30 min,13%B,流速0.80 mL·min-1;30~40 min,6%B,流速0.50 mL·min-1);柱温:25 ℃;检测波长:260 nm;进样体积:10 μL。
2.4 统计方法采用GraphPad Prism 5软件进行Michaelis-Menten方程参数、竞争性抑制模型、非竞争性抑制模型拟合分析及Linewever-Burk双倒数图斜率差异性分析。
2.5 温度对NDPK活性的影响 2.5.1 反应温度对NDPK活性按照NDPK活性测定方法,在相同反应时间、pH、底物浓度条件下进行酶反应,中止后分别测定不同反应温度下(20、30、37、45、55、65、80 ℃)dGDP生成量,计算NDPK活性。所有样品均平行操作3次,取其均值。
2.5.2 NDPK热稳定性取同一稀释RBC裂解液,均分7份,分别于0、30、37、45、55、65、80 ℃下水浴2 h,以0 ℃、2 h后酶活性作为参照活性,测30、37、45、55、65、80 ℃下2 h后NDPK残余活性并计算残余率。残余率计算公式为:残余率=残余活性(μmol ·min-1·g-1)/参照活性(μmol min-1·g-1)× 100%。所有样品均平行操作3次,取其均值。
2.6 pH对NDPK活性的影响按照NDPK活性测定方法,在相同反应时间、反应温度、底物浓度条件下进行酶反应,中止后分别测定不同pH(3.0、4.0、5.0、6.0、6.5、7.0、7.5、8.0、9.0)条件下dGDP生成量,计算NDPK活性。所有样品均平行操作3次,取其均值。
2.7 底物动力学固定反应液中dGTP浓度依次为0.025、0.050、0.100、0.200、0.400 mmol·L-1,测定不同dADP浓度(0.05、0.10、0.20、0.40、0.80 mmol·L-1)时NDPK活性。同理,固定反应液中dADP浓度依次为0.05、0.10、0.20、0.40、0.80 mmol·L-1,测定不同dGTP浓度(0.05、0.10、0.20、0.40 mmol·L-1)时NDPK活性。所有样品均平行操作3次,取其均值。
2.8 产物抑制动力学固定dGTP浓度为0.1 mmol·L-1,依次改变dADP浓度为0.1、0.2、0.4、0.8 mmol·L-1,或固定dADP浓度为0.2 mmol·L-1,依次改变dGTP浓度为0.05、0.10、0.20、0.40 mmol·L-1,测定加入不同浓度dATP(0、0.5、1.0、2.0 mmol·L-1)时NDPK活性。所有样品均平行操作3次,取其均值。
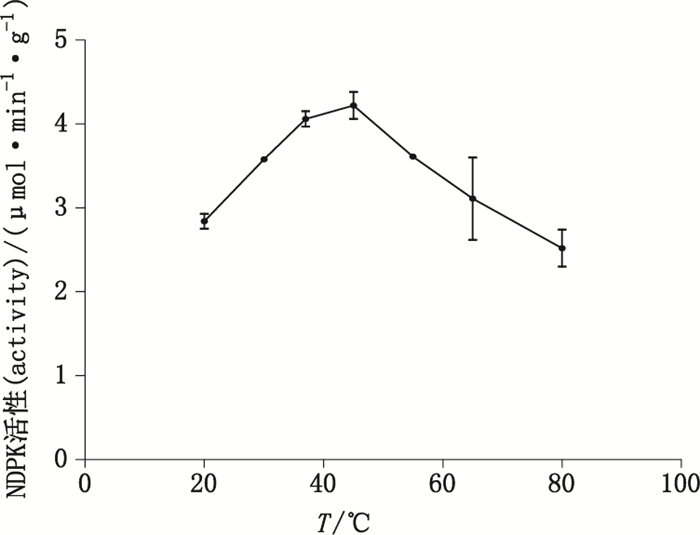
3 结果与讨论 3.1 温度对NDPK活性的影响 3.1.1 反应温度NDPK活性在20~45 ℃范围内随反应温度升高而增高,并在45 ℃时达峰值。当温度超过45 ℃时,活性急剧下降,65~80 ℃时NDPK活性显著降低(见图 2)。
|
图 2 反应温度对NDPK催化活性的影响(n=3) Figure 2 Effect of temperature on NDPK activity |
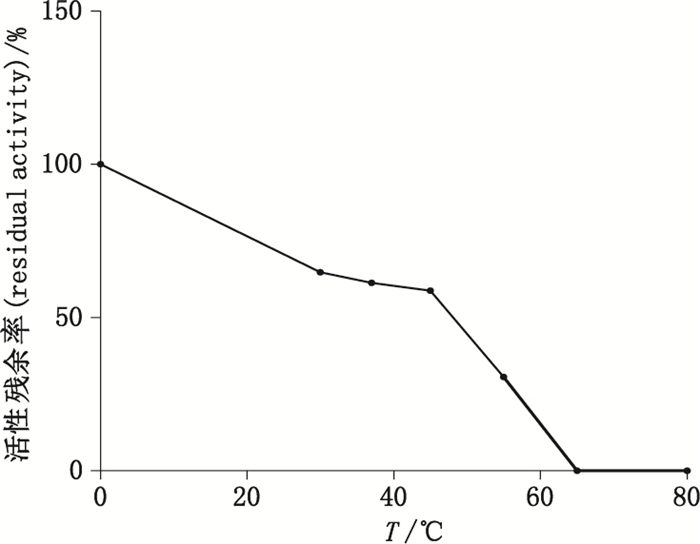
以0 ℃、2 h后酶活性作为参照,当温度上升为30~45 ℃时,酶活性显著下降但存在一个相对稳定的“平台期”,其残余率在58.80%~64.80%之间,当温度上升为55 ℃时,酶活性残余率急剧降低至30.64%,而当温度达到65~80 ℃时,酶活性全部丧失(见图 3)。说明NDPK热稳定性不好,45~80 ℃时NDPK极不稳定。
|
图 3 NDPK在不同温度下处理2 h后的活性残余率(n=3) Figure 3 Activity residual of NDPK after 2 h at different temperatures |
如图 4,pH 3.0时,NDPK活性完全丧失,pH 4.0~5.0时,酶活性较低,pH 6.0~9.0处酶活性较大且在6.0时达峰值,pH 8.0~9.0时,NDPK仍保持着相当高的催化活性,说明NDPK最适宜环境为中性或弱碱性,其在酸性条件下不稳定,但在碱性环境中稳定性较好。

|
图 4 pH对NDPK活性的影响(n=3) Figure 4 Effect of pH on NDPK activity |
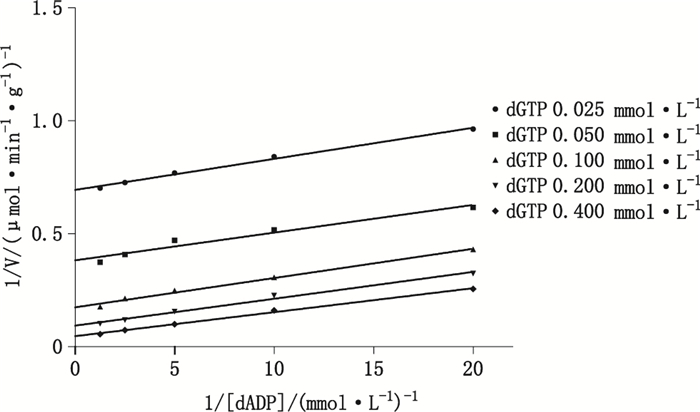
Michaelis-Menten非线性拟合分析显示,随dGTP浓度的增加,酶促反应最大反应速度Vmax及dADP的表观米氏常数Km均增加。Linewever-Burk双倒数图斜率差异性分析P=0.166 5(见图 5)。以Km/V值为纵坐标,dGTP浓度倒数为横坐标,二次作图得水平直线(P=0.344 5)(见图 6),说明Linewever-Burk图(图 5)为一组平行线,符合乒乓机制的特征。取图 5中1/V截距为纵坐标,dGTP浓度倒数为横坐标,线性回归分析得回归方程:
|
图 5 dADP浓度对NDPK酶促反应速度的双倒数图(n=3) Figure 5 Linewever-Burk double-reciprocal plot of the initial velocities versus concentrations of dADP |

|
图 6 二次作图—1/[dGTP]对Km/V线性回归图 Figure 6 Secondary plotting of Km/V versus 1/[dGTP] |
Y=0.017 39X+0.008 976 r=0.998 4
其在Y轴截距等于1/Vmax,X轴截距为-1/KmdGTP,斜率等于KmdGTP/Vmax。经计算得出:Vmax=111.41 μmol·min-1·g-1,KmdGTP=1.94 mmol·L-1。
同理,随dADP浓度的增加,Vmax及dGTP表观Km均增加。Linewever-Burk双倒数作图得一组平行线(P=0.647 8)(图 7)。二次作图线性回归分析得水平直线(P=0.190 0)(图 8),进一步验证此酶促反应机制为乒乓机制。二次作图得回归方程:
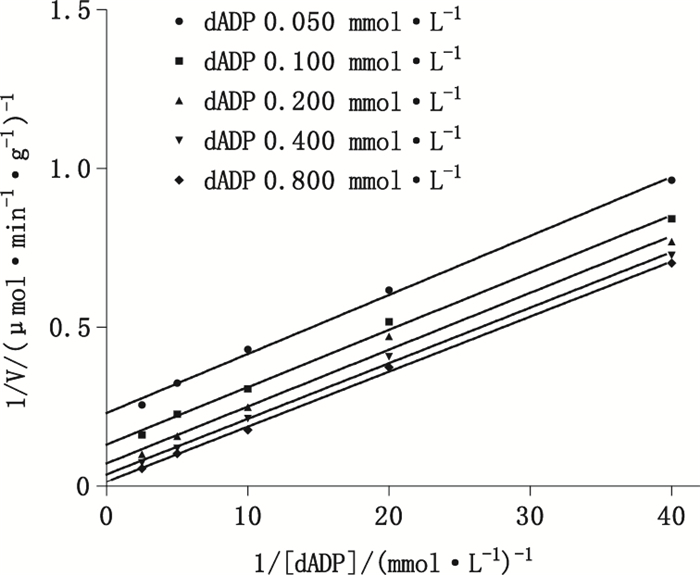
|
图 7 dGTP浓度对NDPK酶促反应速度的双倒数图(n=3) Figure 7 Linewever-Burk double-reciprocal plot of the initial velocities versus concentrations of dGTP |
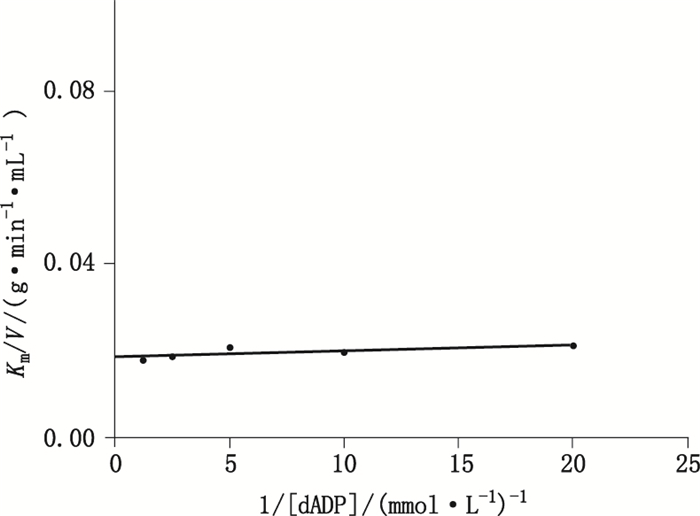
|
图 8 二次作图—1/[dADP]对Km/V线性回归图 Figure 8 Secondary plotting of Km/V versus 1/ [dADP] |
Y=0.011 33X+0.008 981 r=0.996 2
经计算得出:Vmax=111.35 μmol·min-1·g-1,KmdADP=1.26 mmol·L-1。
3.4 产物抑制动力学以1/[dADP]为横坐标,1/V为纵坐标作图,得相交于X轴的1组直线(见图 9),说明固定dGTP浓度,改变dADP浓度,当抑制剂dATP浓度不同时,dADP的Km值不变,Vmax随抑制剂浓度增加而减小,表现为非竞争性抑制作用。同理,以1/[dGTP]为横坐标,1/V为纵坐标作图,Linewever-Burk双倒数图为相交于Y轴的一组直线(见图 10),说明固定dADP浓度,改变dGTP浓度,当抑制剂dATP浓度不同时,Vmax不变,dGTP的Km值随抑制剂浓度增加而增加,此时dATP与dGTP共同竞争酶的活性中心,阻碍底物与酶形成中间产物,抑制酶的活性,表现为竞争性抑制作用。应用Cleland规则,判断此反应符合乒乓双双机制的产物抑制作用特点,此结果与以往研究[14, 16]一致。
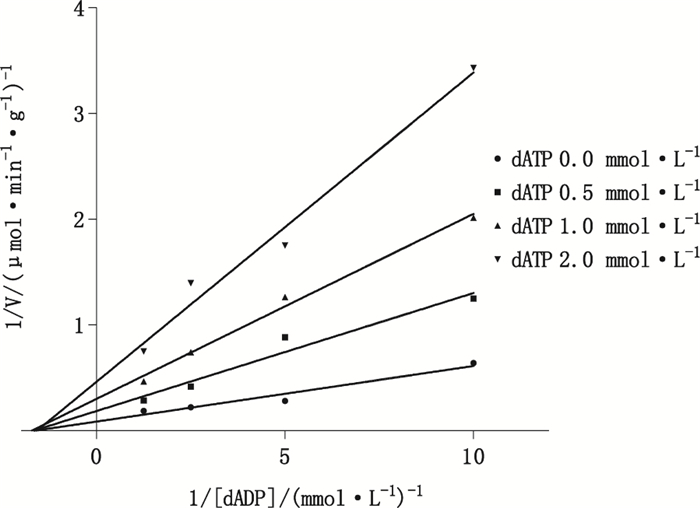
|
图 9 加入不同浓度抑制剂dATP时dADP浓度对NDPK酶促反应速度的双倒数图(n=3) Figure 9 Linewever-Burk double-reciprocal plot of the initial velocities versus concentrations of dADP when inhibited by different concentrations of dATP |
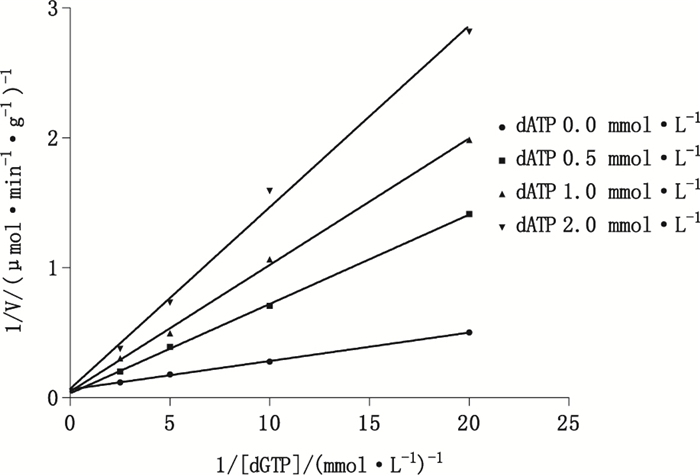
|
图 10 加入不同浓度抑制剂dATP时dGTP浓度对NDPK酶促反应速度的双倒数图(n=3) Figure 10 Linewever-Burk double-reciprocal plot of the initial velocities versus concentrations of dGTP when inhibited by different concentrations of dATP |
GraphPad Prism 5抑制模型拟合分析得出:实验条件下,当dGTP浓度为0.1 mmol·L-1,Vmax为8.322 μmol·min-1·(gHb)-1,dADP的Km为0.362 8 mmol·L-1。dATPKi为0.675 0 mmol·L-1。当dADP浓度为0.2 mmol·L-1,Vmax为16.46 μmol·min-1·g-1,dGTP的Km为0.378 0 mmol·L-1。dATP Ki为0.338 5 mmol·L-1。根据乒乓机制底物动力学方程计算得出,在实验条件下,此酶促反应最大速度Vmax约为110 μmol·min-1·g-1,KmdADP=1.26 mmol·L-1,KmdGTP=1.94 mmol·L-1。
4 讨论NDPK广泛分布于人体各组织中,其活性涉及细胞生理及病理过程的诸多方面,如调节细胞生长、分化、增殖、凋亡,介导G蛋白信号转导、微管聚合动力学、纤毛功能及调节RNA转录等[17-18]。目前研究发现NDPK为多种药物体内活化的重要代谢酶[8-9],包括嘌呤类药物[3]。人体内NDPK活性可直接影响嘌呤类药物活性代谢物6-TGTP的体内浓度[3]。因此,对于NDPK活性及酶学性质的研究具有十分重要的意义。
NDPK酶学动力学的研究最早可追朔到20世纪五六十年代,多项研究表明:NDPK在结构和功能上均具高度保守性,表现为特异性催化非专一性底物NTP的γ-磷酸作用[13, 18]。目前发现NDPK蛋白家族至少含5种具NDPK活性的亚型。由于序列及功能的高保守性,不同NDPK亚型间具有相同的动力学参数。人类RBC内的NDPK主要包括NDPK-A和-B 2种亚型[13],2种亚型通过随机组合形成相对分子质量约为1×105、等电点不同的同或异六聚体活性同工酶[19]。以往对NDPK酶学性质的研究均是在重组提纯蛋白的基础上,忽视了人体内环境中不同同工酶的混合效应。本实验以RBC为研究对象考察NDPK酶学性质,更加符合人体内环境中NDPK催化嘌呤类药物体内代谢活化过程。
实验结果表明,NDPK最适反应温度为37~45 ℃,最适pH为6.0~8.0,其酶促反应遵循乒乓机制。在文中实验条件下,NDPK酶促反应Vmax约为110 μmol·min-1·g-1,KmdADP为1.26 mmol·L-1,KmdADP为1.94 mmol·L-1。抑制剂dATP Ki约为0.34~0.68 mmol·L-1。相关文献表明[13],NDPK-A和NDPK-B在60~65 ℃温度下极不稳定,Erent等[20]的研究发现:NDPK-A、B变性温度Tm为50~60 ℃。本研究中,当温度在30~45 ℃时,酶活性残余率为58.80%~64.80%之间,当温度上升为55 ℃时,残余活性为30.64%,而当温度达到65~80℃时,酶活性完全丧失,进一步补充了文献数据。比较反应温度及热处理温度对NDPK活性的影响作用,发现反应温度为65~80 ℃时,NDPK仍有相当大活性,而经65或80 ℃,2 h热处理后,NDPK活性全部丧失,提示NDPK催化dADP+dGTP↔dATP+dGDP反应初速度较大,为一种快速、高亲和性的催化酶。综合底物动力学及产物抑制动力学结果,得出NDPK催化dADP+dGTP↔dATP+dGDP反应符合乒乓机制(或双置换反应)特点,与Mourad等[14]的同位素标记法研究结果一致。本次研究系统考察了人RBC内NDPK的酶学性质及动力学特点,补充了相关文献数据,并为进一步考察NDPK活性与嘌呤类药物不良反应的相关性提供了试验基础。
| [1] |
BERINGER A, CITTERIO-QUENTIN A, OTERO RO, et al. Determination of inosine 5'-monophosphate dehydrogenase activity in red blood cells of thiopurine-treated patients using HPLC[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2017, 1044-1045(2): 194. |
| [2] |
SAHASRANAMAN S, HOWARD D, ROY S. Clinical pharmacology and pharmacogenetics of thiopurines[J]. Eur J Clin Pharmacol, 2008, 64(8): 753. DOI:10.1007/s00228-008-0478-6 |
| [3] |
KARNER S, SHI S, FISCHER C, et al. Determination of 6-thioguanosine diphosphate and triphosphate and nucleoside diphosphate ainase activity in erythrocytes:novel targets for thiopurine therapy?[J]. Drug Monit, 2012, 32(2): 119. |
| [4] |
SHIN JY, WEY M, UMUTESI HG, et al. Thiopurine prodrugs mediate immunosuppressive effects by interfering with Rac1 protein Function[J]. J Biol Chem, 2016, 291(26): 13699. DOI:10.1074/jbc.M115.694422 |
| [5] |
DEWIT O, STARKEL P, ROBLIN X. Thiopurine metabolism monitoring:implications in inflammatory bowel diseases[J]. Eur J Clin Invest, 2010, 40(11): 1037. DOI:10.1111/eci.2010.40.issue-11 |
| [6] |
PRABHU VV, SIDDIKUZZAMAN, GRACE VM, et al. Targeting tumor metastasis by regulating Nm23 gene expression[J]. Asian Pac J Cancer Prev, 2012, 13(8): 3539. DOI:10.7314/APJCP.2012.13.8.3539 |
| [7] |
TONG Y, YUNG LY, WONG YH. Metastasis suppressors Nm23H1 and Nm23H2 differentially regulate neoplastic transformation and tumorigenesis[J]. Cancer Lett, 2015, 361(2): 207. DOI:10.1016/j.canlet.2015.02.050 |
| [8] |
BRAUNAGEL D, SCHAICH M, KRAMER M, et al. The T_T genotype within the NME1 promoter single nucleotide polymorphism-835 C/T is associated with an increased risk of cytarabine induced neurotoxicity in patients with acute myeloid leukemia[J]. Leuk Lymphoma, 2012, 53(5): 952. DOI:10.3109/10428194.2011.635862 |
| [9] |
VARGA A, GRACZER E, CHALOIN L, et al. Selectivity of kinases on the activation of tenofovir, an anti-HIV agent[J]. Eur J Pharm Sci, 2013, 48(1-2): 307. DOI:10.1016/j.ejps.2012.11.007 |
| [10] |
GROSS S, DEVRAJ K, FENG Y, et al. Nucleoside diphosphate kinase B regulates angiogenic responses in the endothelium via caveolae formation and c-Src-mediated caveolin-1 phosphorylation[J]. J Cereb Blood Flow Metab, 2017, 37(7): 2471. DOI:10.1177/0271678X16669365 |
| [11] |
TEOH J, BOULOS S, CHIENG J, et al. Erythropoietin increases neuronal NDPKA expression, and NDPKA up-regulation as well as exogenous application protects cortical neurons from in vitro ischemia-related insults[J]. Cell Mol Neurobiol, 2014, 34(3): 379. DOI:10.1007/s10571-013-0023-8 |
| [12] |
VELUTHAKAL R, KAETZEL D, KOWLURU A. Nm23-H1 regulates glucose-stimulated insulin secretion in pancreatic β-cells via Arf6-Rac1 signaling axis[J]. Cell Physiol Biochem, 2013, 32(3): 533. DOI:10.1159/000354457 |
| [13] |
BOSNAR MH, BAGO R, CETKOVIC H. Subcellular localization of nm23/NDPK A and B isoforms:a reflection of their biological function[J]. Mol Cell Biochem, 2009, 329(1-2): 63. DOI:10.1007/s11010-009-0107-4 |
| [14] |
MOURAD N, PARKS RE. Erythrocytic nucleoside diphosphokinase Ⅱ.Isolation and kinetics[J]. J Biol Chem, 1966, 241(2): 271. |
| [15] |
沈如飞, 刘亚妮, 曾繁典, 等. 离子对高效液相色谱法测定人体红细胞内核苷二磷酸激酶活性[J]. 中国医院药学杂志, 2012, 32(4): 252. SHEN RF, LIU YN, ZENG FD, et al. Determination of the activity of nucleoside diphosphate kinase in human red blood cell by reversed phase ion-pair HPLC[J]. Chin Hosp Pharm J, 2012, 32(4): 252. |
| [16] |
LASCU I, GONIN P. The catalytic mechanism of nucleoside diphosphate kinases[J]. J Bioenerg Biomembr, 2000, 32(3): 215. DOI:10.1023/A:1005528811303 |
| [17] |
TAKACS-VELLAI K, VELLAI T, FARKAS Z, et al. Nucleoside diphosphate kinases (NDPKs) in animal development[J]. Cell Mol Life Sci, 2015, 72(8): 1447. DOI:10.1007/s00018-014-1803-0 |
| [18] |
BOISSAN M, DABERNAT S, PEUCHANT E, et al. The mammalian Nm23/NDPK family:from metastasis control to cilia movement[J]. Mol Cell Biochem, 2009, 329(1-2): 51. DOI:10.1007/s11010-009-0120-7 |
| [19] |
PERINA D, BOSNAR MH, BAGO R, et al. Sponge non-metastatic group I Nme gene/protein-structure and function is conserved from sponges to humans[J]. BMC Evol Biol, 2011, 11(4): 87. |
| [20] |
ERENT M, GONIN P, CHERFILS J, et al. Structural and catalytic properties and homology modelling of the human nucleoside diphosphate kinase C, product of the DRnm23 gene[J]. Eur J Biochem, 2001, 268(7): 1972. DOI:10.1046/j.1432-1327.2001.2076.doc.x |
 2018, Vol. 38
2018, Vol. 38 
