2. 中国药科大学, 南京 211198
2. China Pharmaceutical University, Nanjing 211198, China
多糖(polysaccharide)是以糖苷键结合的糖链,由至少10个单糖结合而成的聚合糖链的高分子碳水化合物,可用通式(C6H10O5)n表示。当多糖仅由1种单糖聚合时称为均多糖,由2种或2种以上单糖聚合时称为杂多糖[1]。多糖在自然界分布极广,高等植物、藻类、菌类及动物体内均有存在,是自然界含量最丰富的生物活性聚合物[2],也是维持生命所必需的结构物质。多糖来源广泛,由于具有良好的生物相容性、生物可降解性、非免疫原性、抗癌、提高免疫功能、美容、乳化等特点在药物制剂中应用日趋广泛[3-8]。多糖是大分子物质,其性质和单糖、低聚糖不同[9]。一般来说,多糖片段分子质量在100~200 kDa范围内时有较高的生物活性[10]。有研究表明,透明质酸钠因分子质量差异具有不同的生理功能和生物活性,中国的透明质酸钠国家药品标准(WS1-(x072)2011Z)中规定,分子质量大于4×105 g·mol-1的透明质酸钠可以用于滴眼剂,分子质量在6×105~1.5×106 g·mol-1可以用于骨科,分子质量为106~2×106 g·mol-1可以用于眼科手术等,由此可说明透明质酸钠的生理功能与其分子质量紧密相关[11]。因此多糖类物质的分子质量测定是多糖分离纯化和进一步应用研究的基础手段,本文将对近20年来多糖类药用辅料分子质量的测定方法及其适用范围进行总结分析。
1 多糖类分子质量及分子质量分布简介多糖是高分子化合物,分子质量及分子质量分布是表征高分子物质的最基本参数之一,也是高分子性能研究和生产过程中需要控制的重要参数。通常可用4种分子质量表示方式表征高分子分子质量大小:数均分子质量(Mn)、重均分子质量(Mw)、Z均分子质量(Mz)和黏均分子质量(Mη)。一般来说,分子质量不均一的高分子分子质量Mz > Mw > Mη > Mn。仅基于高分子的统计平均分子质量,尚无法准确了解体系内分子质量的多分散程度,为了更加全面地描述高分子分子质量的大小,还需要研究其分子质量分布。一般分子质量分布用PD表示,即Mw与Mn的比值(PD=Mw/Mn)[9],PD值越大,表明分子质量分布越宽,当PD=1时,说明体系的分子质量均一。一般大分子多糖其分子链长短可以不同,在衡量分子质量时,往往是一个平均数[9],分子质量只代表相似链长的平均分配,即使是同一种多糖,其Mw与Mn也会有差异[12]。一般文献中所报道的多糖分子质量为Mw。为了更加全面而准确地反应高分子多糖的性质,可采用数均、重均、黏均等分子质量及分布指数来综合反应其分子质量[13]。
2 多糖类分子质量及分子质量分布的测定方法 2.1 黏度法黏度法是利用高分子物质的流变学性质来计算其相对分子质量[14-16]。该法用于多糖相对分子质量测定历史悠久,是实验室常用的一种相对方法。通常用于研究或生产过程中对多糖相对分子质量的监控。特性黏度([η])是指在一定条件将溶液无限稀释使溶液内部仅存在高分子与溶剂分子之间的内摩擦,此时的黏度即为特性黏度。在稀溶液中,线性分子的[η]可体现该分子的内在本质,和其相对分子质量正相关。当实验温度、溶剂和多糖种类确定后,多糖的[η]值取决于该多糖的相对分子质量,常用马克-豪温(Mark-Howwink)方程[η]=KMηα来表示两者的相关性。
计算[η]主要有以下2种方法:(1)稀释法又称外推法,一般需要测定5个左右不同浓度的相对黏度,作图计算其[η]。(2)一点法只需测1个较低浓度溶液的黏度值,便可计算出高分子的分子质量。有文献[17]报道,在满足一定条件时,可用一点法代替外推法测定高分子聚合物的[η]。刘爱华等[18]采用一点法和稀释法测定透明质酸钠的[η],并对其结果进行比较,发现当溶剂和溶液流出时间大于100 s,且相对黏度ηr为1.30~1.50时,2种方法的测定结果无显著性差异。但有文献指出测量时溶液要稀释充分,以避免大分子间的相互作用而导致的结果误差[19]。对比2种方法可看出,一点法操作简单,只需选定1个合适的样品浓度,测定样品和空白溶剂的流出时间,通过公式计算相对分子质量,适用于较多批次的样品的常规测定,能够快速测定,节省测量时间。[η]仅能间接计算样品的相对分子质量,但不能获得相对分子质量分布信息。
2.2 凝胶渗透色谱法凝胶渗透色谱法(gel permeation chromatography,GPC)又称为体积排阻法(size exclusion chromatogr-aphy,SEC)是根据聚合物分子尺寸,在多孔性凝胶色谱柱中,由大到小对聚合物进行分离,再用检测器对分离出的物质进行检测的方法[20]。一般测定多糖类相对分子质量,除选用合适的色谱柱外,还可根据待测物性质不同选用不同的检测器进行测定。
2.2.1 凝胶渗透色谱-示差折光检测器(GPC-RI)凝胶渗透色谱与示差折光检测器联用是常用的多糖分子质量测定方法。示差折光检测器(RI)为单一浓度型检测器,其原理为在一定相对分子质量范围内,高分子的相对分子质量对数(logM)与其在凝胶渗透色谱上的保留时间(tR)呈线性关系。可配制一系列已知相对分子质量的标准溶液,用logM对其tR作标准曲线,在相同条件下测得待测物质的保留时间,代入标准曲线可得到该物质的相对分子质量。每次测定流动相和流速均需一致,否则产生较大的误差。李楠等[21]采用该法测定白芨多糖相对分子质量和含量,在控制好柱温、流速,选用合适的流动相后,发现实验重复性好,结果准确,且该法操作简便快速,可认为SEC是测定白芨多糖相对分子质量的有效方法。该法优点是克服了以前因技术因素的限制,无合适高效的检测器,而使实验研究进行困难的局面,近几年出现的示差折光检测器可较好地补充这项技术的空白[22]。但该法要求标准物质和样品化学性质和结构相似。虽然RI能测定柱子上洗脱分子的浓度,但不能得到聚合物其他信息,如聚合物的尺寸,因此常规GPC信息技术还需要丰富,而且RI是浓度型检测器,只能感知浓度。如果高分子含有支化结构,RI无法测定,也无法测定分子链的形态。
2.2.2 凝胶渗透色谱-多检测器联用多检测器GPC最常见的形式是RI与黏度检测器(VS)联用,VS同RI给出的浓度信息结合,能够深入地了解溶液中聚合物分子的行为,如分子的尺寸(Rh)、构造和形态[23-30],还可得到准确相对分子质量,不过仍然需要作普适校正曲线。普适校正利用[η]和相对分子质量(Mr)都与溶液中分子大小有关的现象:流体动力学体积=K·Mr·[η],流体动力学体积是测量分子大小的指标,以log(Mr·[η])对tR作图绘制标准曲线,相当于以log分子尺寸对tR作图,即不管何种标准物质,都将产生同样的校准曲线,即普适校正。
对于给定Mr的高分子,[η]大,意味着分子支化度低,[η]小,意味着分子支化度高。VS测得的值是样品的增比黏度(ηsp),在GPC中,柱上样品的浓度非常低,因此可将其转换为[η],ηsp=4DP/(IP-2DP),其中IP为入口压力,DP为压差。IV=ηsp/浓度。根据Mark-Houwink曲线,可以确定多糖的构造和形态。曲线斜率小,支化程度大。Mark-Houwink方程:[η]=KMa,根据a值的不同,一般聚合物可分3种形态,a=0.5时为紧缩线团,a=0.7时为松懈线团,a=1.5时为刚性棒;Flory特性黏度理论:
对于难以得到对照品的多糖,此时多检测器GPC可联用光散射检测器(LS),可测得多糖的绝对分子质量,不依赖色谱柱校准提供分子质量,不需要校正曲线,还可获得分子的尺寸(Rg)、构造和形态,高分子支化度等信息。
一般使用的“光散射”指的是经典或静态光散射(static light scattering)[31-32],即瑞利(Rayleigh)光散射。散射光强度测量的是瑞利比R(θ),R(θ)为散射角为θ时的瑞利比;P(θ)为散射因子,它是高分子尺寸和散射角的函数;聚合物稀溶液的光散射强度与其Mr和均方根半径(Rg)的基本关系式如下[33]:
| $R\left( \theta \right) = CM{\left( {\frac{{{\rm{d}}n}}{{{\rm{d}}c}}} \right)^2}P\left( \theta \right)K$ | (1) |
| $P\left( \theta \right) = 1-R_{\rm{g}}^2\frac{{16{{\rm{ \mathit{ π} }}^{\rm{2}}}}}{{3{{\left( \lambda \right)}^2}}}{\sin ^2}\left( {\frac{\theta }{2}} \right) + \cdots $ | (2) |
其中M为重均分子质量,λ为光的波长,θ为采集角度,Rg2为聚合物Z旋转半径,通常简称为回转半径,dn/dc为折射率增量。
由公式(1)看出样品溶液的光散射强度正比于M,即M的测定不依赖柱组校正。由公式(2)可得到多糖的尺寸(Rg)均方回转半径。将公式(1)(2)联合整理,可近似得Rg=KMv,由Rg-M曲线可确定多糖的构造和形态,曲线斜率小,则支化程度高。根据v值的不同,多糖可分3种形态:v=0.33时为紧缩线团,v=0.5时为松懈不规则线团,v=1时为刚性棒。由公式(1)也可看出,光散射强度与dn/dc值的平方和M成正比,如果低Nh或低dn/dc样品与溶剂组合,则光散射数据较差。因此dn/dc值在光散射计算中至关重要,需要测定样品的dn/dc值。在dn/dc值的测定过程中应该尽量减少和避免各种原因造成的误差[34],影响dn/dc值的因素很多,①溶剂不同,同种物质在不同溶剂中的dn/dc值不同;②各公司仪器波长不同,dn/dc值会随波长的增加而减小,相应的dn/dc值也会变化,测定dn/dc值条件下的波长应与MALLS波长一致;③摩尔质量,例如聚乙二醇(PEG),在Mw < 1 000 g·mol-1时,其dn/dc值不固定。
dn/dc值可用RI测定,公式如(3)
| ${A_{{\rm{RI}}}} = K \times {\rm{d}}n/{\rm{d}}c \times C$ | (3) |
示差检测器可测定样品的dn/dc值,但需要保证在多糖洗脱体积范围内,dn/dc值是不变的,因而LS不适用于共聚物,最常用于均聚物的分析。
可单独用静态光散射检测器测定分子质量和分子质量分布,如黄志萍等[35]用光散射法测定高能推进剂新型键合剂(BAG)分子质量及其分子质量分布,发现实验结果准确度和精密度较好,是一种常规的测定高能推进剂新型键合剂(BAG)分子质量及其分布的方法。Laurent和Gergely等[31]利用静态光散射法(static light scattering),对透明质酸钠(HA)进行了早期的光散射研究,得到了透明质酸钠(HA)的重均分子质量(Mw)和回转半径(Rg)。
有实验室将示差和多角度激光光散射检测器联用,如吴杨兰等[34]用GPC-RI-MALLS技术测定羟乙基淀粉的相对分子质量及相对分子质量分布,并测定折光指数增量(dn/dc)值,对相对分子质量和相对分子质量分布的实验步骤和方法进行考察,发现该法具有较高的准确性和重复性,可用于相对分子质量对照品的标定,在质量控制和应用研究方面具有广阔的前景[36]。但该法不适用于相对分子质量较低的物质,分子质量越低(Mw < 104 g·mol-1),用SEC-MALLS法测试误差越大,可能是随着相对分子质量的减小,影响测定的因素增多所致[37]。
2.2.2.2 凝胶渗透色谱-多角度光散射-黏度检测器联用(GPC-RI-MALLS-VS)前面介绍了检测器单用和两者联用的情况,还可三检测器联用,即RI、MALLS、VS进行聚合物GPC分析。三检测器联用具有明显的优势,即可测相对分子质量,又可测量特性黏度,不仅可以检测分子大小或[η]的变化,还可评估支化度,由于支化点的存在,支链分子的Rg和[η]值比直链类似物低,因为该法是三检测器联用,获知化合物的信息较为全面,聚集了VS和MALLS的优点,是聚合物表征的最高级配置,也是多检测器GPC的最先进形式。戴晨伟[38]等采用GPC-多检测联用技术测定聚乙内酯(PCL)分子质量及其分布,该法可准确测定物质的分子质量及其分布、Mark-Houwink方程系数中的K,a值,及高分子尺寸Rg等重要参数。并且对聚苯乙烯(PS)标样分子质量进行测定后,发现测定结果相对误差在1%之内,误差较小。
2.3 场流法场流分级分离(field flow fractionation,FFF)可适用于大分子、微粒、胶束分离,是一种分离范围十分广泛的技术,可用于分离尺寸在1 nm~100 μm范围的化合物[39-41],也可测定物质的物理特性参数,如质量、电荷、密度等[39]。其原理是利用物理场使物质在流经一个空的柱状槽时,因扩散系数、质量、电荷、体积等物理性质的差异而分离的技术。该法不需要填料,所以不存在固定相。一般由四部分组成:载液及样品注入装置、分离系统、检测分析系统、收集系统等,其中分离系统由分离场与分离流道装置组成,检测系统可由光散射仪和计算机共同组成[42]。1966年Giddingns博士最早提出了这个新技术的分离原理[43],之后又为其发展和完善做了大量工作。分离需要外加场或梯度,它是在外加场的诱导下与流体联合作用进行的。通常系统中矩形微流道的高宽比大于1:100 [39],由此可看出FFF流道高度很低,一般样品扩散很短的距离时,场力和扩散力即可达到平衡,因此在实验研究时,设定场强应比参考方法的场强小[42]。
| $R = 6\lambda \left[{\coth \left( {1/2\lambda } \right)-2\lambda } \right]$ | (1) |
R是空时间(空体积)与洗提时间(洗提体积)的比;λ是无纲参数:
| $\lambda = D/\left( {Uw} \right)$ | (2) |
w是流道高度,D是粒子的扩散系数,U为粒子横向漂移速度。
Einstein方程可求扩散系数D:
| $D = {\rm{k}}T/\left( {3{\rm{ \mathit{ π} }}\eta d} \right)$ | (3) |
k为Boltzmann常数,T为绝对温度,η为黏度,d为粒子直径。
FFF是一个分离技术的大家族,包含多种分支技术,根据施加的分离场的不同,FFF可分为4类:(1)热力场流分离、(2)流动场流分离、(3)电力场流分离、(4)沉淀场流分离等。下面主要总结多糖分离分析中常用的热力场流分级分离(Thermal FFF,ThFFF)和流动场流分级分离(flow-FFF,F|FFF)技术在已知结构的多糖如普鲁兰多糖、葡聚糖等进行的研究探索[46]。
2.3.1 热力场流分离(ThFFF)也可用于多糖的分离,和SEC法相比,它更适合分离分子质量在105 g·mol-1以上的组分[47],ThFFF分离是靠热力扩散和载流联合实现的。Lou等[48]以二甲基亚砜(DMSO)为载流,以0.2 mL·min-1的流速,将普鲁兰多糖、右旋糖苷等溶于DMSO中,将ThFFF和蒸发光散射检测器联用,进行分离分析。因该技术选择性高,从Lou的实验结果看,多糖样品的分子质量分布峰比SEC法得到的要宽。但ThFFF若用水做载流,多糖的保留很弱,水溶性系统的样品热力学差异表现不明显。尽管ThFFF分离潜力大,但对多糖的研究还是比较少的,且对液体中热扩散过程还不太清楚,很多公式只是近似估算,不能像流动场流分离一样预测组分的保留行为,此法还需完善。
2.3.2 流动场流分离(F|FFF)相对其他场流应用较广泛些,它可分离相对分子质量范围104~1012 g·mol-1的多糖[49]。它的通道是多孔膜层,功能和半透膜相似,在垂直于层流的方向上交叉流会穿过通道壁,在交叉流和层流共同作用下,物质在通道内分配平衡。扩散力和场力的作用相反,小分子由于扩散系数大,分布在通道壁上方,而大分子相反,分布在积聚壁附近。因此,多糖小分子先洗脱出来,大分子后出来[50]。Roessner等[51]首次将F|FFF和LS联用,用分子质量分布较宽的右旋糖酐对该实验装置进行了效能验证,结果较好,可得到分子质量和分子半径等参数。
根据分离通道形状和载流形成方式的不同,F|FFF又可分为3种类型:对称系统、中空纤维管、不对称系统。(1)对称系统流场流的通道的上下两壁均是多孔膜层,具有渗透性,交叉流依靠泵进入并穿过膜层,膜层的上下壁渗透性要相同,即要求交叉流是均匀的,这对膜层的要求较高,需要较高的设计技术[46]。(2)中空纤维管分离是在半渗透的中空纤维管中进行的[50]。Wijnhoven等[50]用中空纤维管F|FFF分离了普鲁兰多糖等水溶性物质,并对进样量大小、载流离子强度对样品保留行为的影响进行了研究。(3)不对称系统流场流(asymmetric flow-FFF,AF|FFF)则把上壁更换为无渗透性的固体壁,和对称系统流场流的膜层相比,降低技术难度,交叉流体是垂直于层流的,也是轴向载流的一部分。多糖分离常使用AF|FFF,该法与凝胶渗透色谱分离技术相似,但因无柱填料,在分离过程中仅依靠流动相进行分离,因此也有人将其称为单相色谱。
从图 1看出,AF|FFF是在2个不同流向的流体的共同作用下实现的,即交叉流和层流。垂直于分离通道轴向的称为交叉流,平行于分离通道轴向的称为层流,不同分子质量的高分子受交叉流和层流的作用不同进而分离[33]。层流起到洗脱的作用,而交叉流可提供1个场力,通过层流和交叉流调节流速,起到分离样品的作用。
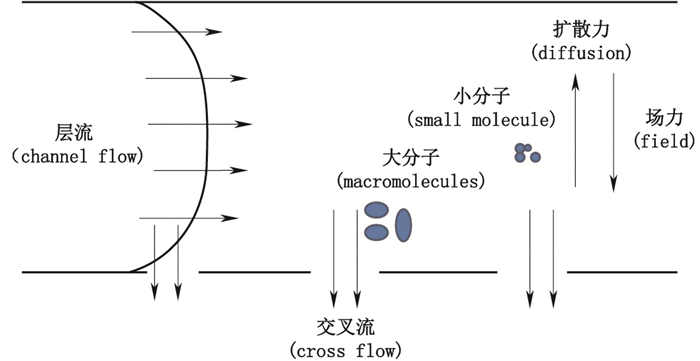
|
图 1 不对称流场流分离示意图 Figure 1 Schematic dliagram of asymmetric flow field separation |
在交叉流的作用下,样品中组分因分子质量的差异,高分子向分离通道的下壁积聚,而分子本身的扩散作用和布朗运动又成为抵抗交叉流的反作用力,当场力和扩散力达到平衡时,物质将处于通道内一定的位置上,此时流动相在分离通道中呈层流状态,液体流速近似呈抛物线形状,中心处的流速比流道壁附近的大,利用零滑移假设,可假设流速在流道壁处趋近于零。分子质量不同的分子具有不同的扩散系数和布朗运动特性,则它们受交叉流场的影响也就不同,分子质量大的组分受交叉流场影响较强,距聚集面较近,流速较小,在距离聚集面较近的位置达到平衡;而分子质量小的组分正好相反在距离聚集面较远的位置达到平衡,因此分子质量是由小到大依次被洗脱出来[33]。因流速的差异,样品通过通道所用时间也就不同。样品所用时间与组分的特性有关,分离就是利用样品中不同组分的特性来实现的,因而,分子将按分子质量大小,依次被洗脱出来。与其它FFF相比,AF|FFF应用范围广,分离效果更优。
不对称流场流(AF|FFF)与常规聚合物分离手段相比,有很多优势。(1)它可分离复杂样品无需样品预处理,可直接进样,保持样品原有活性;(2)对于质量大的样品,可分析其动态范围,适用于复杂样品的分离;(3)无需色谱填料,避免了色谱填料与样品间的吸附,仅依靠控制流动相实现高分子化合物的分离;(4)剪切力最小化,避免降解、柱堵塞等问题[49];(5)分离过程简单,分析速度快;(6)不存在排阻极限,能很好地控制样品吸附的问题,回收率高,分辨率高,人为因素影响最小;(7)AF|FFF分离池表面积大约为30 cm2,SEC色谱柱表面积大约为30 000 cm2,因此样品在AF|FFF中的相互吸附作用更小;(8)在进样过程中样品可自动浓缩;(9)因检测器和流动相缓冲液范围宽[52],条件控制灵活,选择性高,分离方法灵活多变,且分离出的各部分可以收集后,供进一步的分析或制备。
不对称流场流(AF|FFF)主要是一种分离的手段,它可与凝胶液相色谱常用的检测器兼容,如示差折光检测器、光散射检测器、蒸发光散射检测器及黏度等检测器联用,进行聚合物大分子样品的分离表征[49]。在多糖实验中,可将AF|FFF和MALLS联用(AF|FFF—MALLS),直接测得分子质量及其分布等参数。AF|FFF结合MALLS,该法适合超高分子质量的弱刚性链的分离,且流速和样品浓度对测定的结果影响较大,需要控制操作条件,对条件进行优化。AF|FFF分离多糖时有下限要求,这由通道壁决定,如果分子质量小于通道壁孔隙,会渗出通道壁,使测得的分子质量比实际值高。与SEC系统相比,AF|FFF技术在欧美,日本等国应用较广泛,但中国应用有限,后面还需要多加投入研究,该项技术是分离聚合物的理想手段,今后在超高分子、凝胶等分析中应用越来越多[53]。AF|FFF联用MALLS是一种非常有潜力的高分子分离及分子质量测定方法。Wittgren等[54]用AF|FFF-MALLS分别测定了葡聚糖(dextran)和普鲁兰多糖(pulluan)的平均分子质量、Rg和结构,载流为纯水和0.1 mol·L-1氯化钠2种溶液,得到了可靠的结果,并且在水和氯化钠溶液中,葡聚糖的结构比普鲁兰多糖的更紧密。Takahashi等[55]用AF|FFF-MALLS对HA进行了研究,发现AF|FFF交叉流的流速是分离过程中最重要的参数,如果交叉流过大,分子质量大的组分无法洗脱出来,而且样品的分离时间会变得非常长。因此交叉流通常采用0.25 mL·min-1或略低的速率。通道流对结果影响较小,但通道流如果过高会影响分离的稳定性,过低会延长分离时间。因此通道流通常采用1 mL·min-1的速率[33]。
综上,每种检测方法各有优缺点及其适用范围,本文针对常用的黏度法、凝胶渗透色谱法、凝胶渗透色谱联用光散射法、场流分析法进行总结(表 1)。
|
|
表 1 多糖类辅料常用的分子质量测定方法比较 Table 1 Comparison of molecular weight determination methods for polysaccharide macromolecular excipients |
多糖类辅料在药物制剂方面应用日益广泛,亟需建立合适准确的分子质量检测方法。目前对于多糖类辅料结构复杂性和多样性的质量控制还不深入,2015年版中国药典中尚未收录多糖类辅料的分子质量测定方法,多糖辅料行业中分子质量内控标准各异,因此需要根据多糖的自身性质选择相对准确的测定方法。一般而言,测定大分子辅料的分子质量及其分布,常选用凝胶渗透色谱法,但实验中很难获得结构相似或一致的对照品用于制备标准曲线计算相对分子质量,因此建议选用凝胶渗透色谱联用光散射法测定绝对分子质量,以验证凝胶渗透色谱法得到的相对分子质量测定结果。避免实验中对照品与供试品色谱洗脱行为不一致,或对照品分子质量无法完全覆盖供试品分子质量范围导致的测定结果偏差。对于无合适色谱柱分离的大分子药用辅料,可尝试选用AF|FFF-MALLS,避免色谱填料引入的测定偏差。本文对多糖类辅料分子质量测定常用的方法和技术进行了总结,分析了各种方法的优缺点及其适用范围,为多糖类辅料的分子质量测定研究提供参考依据。
| [1] |
张群, 雷林生, 吴曙光. 多糖类药物作用的受体及信号转导机制的研究进展[J]. 中草药, 2005, 36(4): 614. ZHANG Q, LEI LS, WU SG. Receptor and signal transduction mechanism involved in biological effects of polysaccharides[J]. Chin Tradit Herb Drugs, 2005, 36(4): 614. |
| [2] |
高小荣, 刘培勋. 多糖构效关系研究进展[J]. 中草药, 2004, 35(2): 229. GAO XR, LIU PX. Polysaccharide structure activity relationship research progress[J]. Chin Tradit Herb Drugs, 2004, 35(2): 229. |
| [3] |
KHAN MTH, ATHER A, THROMPSON KD, et al. Extracts and molecules from medicinal plants against herpes simplex viruses[J]. Antiviral Res, 2005, 67(2): 107. DOI:10.1016/j.antiviral.2005.05.002 |
| [4] |
YANG XP, GUO DY, ZHANG JM, et al. Characterization and antitumor activity of pollen polysaccharide[J]. Int Immunopharmacol, 2007, 7(4): 427. DOI:10.1016/j.intimp.2006.10.003 |
| [5] |
LI SP, ZHANG GH, ZENG Q, et al. Hypoglycemic activity of polysaccharide with antioxidation, isolated from cultured cordycepsmycelia[J]. Phytomedicine, 2006, 13(6): 428. DOI:10.1016/j.phymed.2005.02.002 |
| [6] |
YANG TH, JIA M, MENG J, et al. Immunomodulatory activity of polysaccharide isolated from Angelica sinensis[J]. Int J Biol Macromol, 2006, 39(4/5): 179. |
| [7] |
SCHEPETKIN AI, QUINN TM. Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J]. Int Immunopharmacol, 2006, 6(3): 317. DOI:10.1016/j.intimp.2005.10.005 |
| [8] |
RAEMDONCK K, MARTENS TF, BRAECKMANS K, et al. Polysaccharide-based nucleic acid nanoformulations[J]. Adv Drug Deliv Rev, 2013, 65(9): 1123. DOI:10.1016/j.addr.2013.05.002 |
| [9] |
封聚强, 赵骏. 中药多糖的相对分子质量及结构研究进展[J]. 时珍国医国药, 2008, 19(3): 624. FENG JQ, ZHAO J. Advancement on molecular weight and constitution of polysaccharides of traditional Chinese drug[J]. Lishizhen Med Mater Med Res, 2008, 19(3): 624. |
| [10] |
林白全, 于晓斌, 洪玉涛. 桑黄液态发酵培养基研究及其多糖相对分子质量测定[C]//第四次全国发酵工程学术讨论会. 2006: 476 LIN BJ, YU XB, HONG YT. Research on liquid fermentation medium of Phellinus igniarius and its molecular weight determination[C]//Fourth National Fermentation Engineering Symposium. 2006: 476 |
| [11] |
WS1-(X-058)-2006Z. 2006玻璃酸钠注射液 WS1-(X-058)-2006Z. 2006 Sodium Hyaluronate Injection |
| [12] |
刘欣, 刘彩芬, 程海瑞. 多糖理化性质及其生物活性研究现状[J]. 科技视野, 2014, 14: 26. LIU X, LIU CF, CHENG HR. Physicochemical properties of polysaccharides and their bioactivities[J]. Sci Technol Vis, 2014, 14: 26. |
| [13] |
李计萍. 中药多糖有效部位研究中相对分子质量及分布研究相关问题[J]. 药物分析杂志, 2009, 29(10): 1768. LI JP. Discussion on relative molecular mass and distribution study of polysaccharide in active fraction of traditional Chinese medicines[J]. Chin J Pharm Anal, 2009, 29(10): 1768. |
| [14] |
TAKAHASHI R, AL-ASSAF S, WILLIAMS PA, et al. Asymmetrical-flow field-flow fractionation with on-line multi-angle light scattering detection1 application to worm-like chain analysis of weakly stiff polymer chains[J]. Biomacromolecules, 2003, 4(2): 404. DOI:10.1021/bm025706v |
| [15] |
CLELAND RL. The persistence length of hyaluronic acid:an estimate from small angle X-ray scattering and intrinsic viscosity[J]. Arch Biochem Biophys, 1977, 180(1): 57. DOI:10.1016/0003-9861(77)90008-X |
| [16] |
MILAS M, RINAUDO M, ROURE I, et al. Comparative rheological behavior of hyaluronan from bacterial and animal sources with cross-linked hyaluronan (hylan) in aqueous solution[J]. Biopolymers, 2001, 59(4): 191. DOI:10.1002/(ISSN)1097-0282 |
| [17] |
金日光, 华幼卿. 高分子物理[M]. 北京: 化学工业出版社, 2000, 89. JIN RG, HUA YQ. Polymer Physics[M]. Beijing: Chemical Industry Press, 2000, 89. |
| [18] |
刘爱华, 郭学平, 刘丽. 透明质酸钠特性黏度的一点法测定[J]. 中国医药工业杂志, 2004, 35(3): 164. LIU AH, GUO XP, LIU L. Determination of intrinsic viscosity of sodium hyaluronate by one-point method[J]. Chin J Pharm, 2004, 35(3): 164. |
| [19] |
COWMAN MK, MATSUOKA S. Experimental approaches to hyaluronan structure[J]. Carbohydr Res, 2005, 340(5): 791. DOI:10.1016/j.carres.2005.01.022 |
| [20] |
COWMAN MK, SLAHETKA MF, HITTNER DM, et al. Polyacrylamidegel electrophoresis and Alcian Blue staining of sulphated glycosaminoglycan oligosaccharides[J]. Biochem J, 1984, 221(3): 707. DOI:10.1042/bj2210707 |
| [21] |
李楠, 李卓, 张燕, 等. 高效分子排阻色谱法同时测定白及多糖相对分子质量和含量[J]. 药物分析杂志, 2012, 32(10): 1801. LI N, LI Z, ZHANG Y, et al. Determination of molecular weight and content of Bletilla striata glucomannan by high performance size exclusion chromatography[J]. Chin J Pharm Anal, 2012, 32(10): 1801. |
| [22] |
霍芳, 张志美, 王建军, 等. 高效液相色谱-示差折光检测技术研究进展[J]. 家蓄生态学报, 2013, 34(7): 81. HUO F, ZHANG ZM, WANG JJ, et al. High performonce liquid chromatography-refractive index detection[J]. Act Ecol Anim Domast, 2013, 34(7): 81. |
| [23] |
SHAKUNM, MAIER H, HEINZE T, et al. Molar mass characterization of sodium carboxymethyl cellulose by SEC-MALLS[J]. Carbohydr Polym, 2013, 95(1): 550. DOI:10.1016/j.carbpol.2013.03.028 |
| [24] |
GRCEV S, SCHOENMAKERS P, IEDEMA P. Determination of molecular weight and size distribution and branching characteristics of PVAc by means of size exclusion chromatography/multi-angle laser light scattering(SEC/MALLS)[J]. Polymer, 2004, 45: 39. DOI:10.1016/j.polymer.2003.10.077 |
| [25] |
ZHANG MJ, SU RX, QI W. Enzymatic hydrolysis of cellulose with different crystallinities studied by means of SEC-MALLS[J]. Chin J Chem Eng, 2011, 19(5): 773. DOI:10.1016/S1004-9541(11)60055-4 |
| [26] |
ASTRA V. Users Guide[Z]. Santa Barbara CA, USA: Wyatt Technology Corporation, 2004: 118
|
| [27] |
LI Y, WEISS WF, ROBERTS CJ. Characterization of high-molecular-weight nonnative aggregates and aggregation kinetics by size exclusion chromatography with inline multiangle laser light scattering[J]. J Pharm Sci, 2009, 98(11): 3997. DOI:10.1002/jps.21726 |
| [28] |
STEELE BL, ALVAREZ-VERONESI MC, SCHMIDT TA. Molecular weight characterization of PRG4 proteins using multi-angle laser light scattering(MALLS)[J]. Osteoarthritis Cartilage, 2013, 21(3): 498. DOI:10.1016/j.joca.2012.12.002 |
| [29] |
MENDICHI R, FISICHELLA S, SAVARINO A. Molecular weight size distribution and conformation of glutenin from different wheat cultivars by SEC-MALLS[J]. J Cereal Sci, 2008, 48: 486. DOI:10.1016/j.jcs.2007.11.006 |
| [30] |
张卫东, 胡川梅, 郑璐侠, 等. SEC-MALLS法测定普鲁兰糖相对分子质量及分子质量分布[J]. 药物分析杂志, 2015, 35(7): 1213. ZHANG WD, HU CM, ZHENG LX, et al. Determination of relative molecular mass and molecular mass distribution of pullulan by means of SEC-MALLS[J]. Chin J Pharm Anal, 2015, 35(7): 1213. |
| [31] |
LAURENT T C, GERGELY J. Light scattering studies on hyaluronic acid[J]. J Biol Chem, 1955, 212(1): 325. |
| [32] |
TERBOJEICH M, COSANI A, PALUMBO M. Structural propeties of hyaluronic acid in moderately concentrated solutions[J]. Carbohydr Res, 1986, 149(2): 363. DOI:10.1016/S0008-6215(00)90058-2 |
| [33] |
栾途. 透明质酸粘多糖的分子表征、流变学性质及其物理凝胶的研究[D]. 上海: 上海交通大学, 2011 LUAN T. Study on the Molecular Characterization Rheological Propertis and Physical Cryogel of Mucopolysaccharide Hyaluronan[D]. Shanghai: Shanghai Jiaotong University, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10248-1012016640.htm |
| [34] |
吴扬兰, 王远亮. GPC-RI-MALLS技术测定羟乙基淀粉的相对分子质量及子量分布[J]. 重庆大学学报, 2007, 30(7): 121 WU YL, WANG YL, XU SR. Determination of molecular weight and molecular weight distribution of hydroxyethyl starch by means of GPC-RI-MALLS[J]. J Chongqing Univ, 2007, 30(7): 121 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=five200707026&dbname=CJFD&dbcode=CJFQ |
| [35] |
黄志平, 马新刚, 蒋根杰, 等. 激光光散射法测定BAG相对分子质量及其相对分子质量分布[J]. 固体火技术, 2004, 27(3): 233. HUANG ZP, MA XG, JIANG GJ, et al. Measurement of BAG molecular weight and its distribution using laser light scattering method[J]. J Solid Rock Technol, 2004, 27(3): 233. |
| [36] |
阚微娜, 滕艳坤, 杨宏伟. 高效体积排阻色谱-示差折光检测器-多角激光光散射仪联用测定右旋糖酐70原料药的分子质量[J]. 中国药房, 2014, 25(9): 843. KAN WN, TENG YK, YANG HW. Determination of molecular weight of dextran 70 raw material by high performance size exclusion chromatography with differential refraction detector and multi-angle laser light scatter[J]. China Pharm, 2014, 25(9): 843. DOI:10.6039/j.issn.1001-0408.2014.09.26 |
| [37] |
程广文, 范晓东, 周志勇, 等. 凝胶渗透色谱-多角度激光散射测定聚乙二醇分子量[J]. 高分子材料科学与工程, 2008, 24(10): 127. CHENG GW, FAN XD, ZHOU ZY, et al. Determination of polyethylene glycol molecular weight by gel permeation chromagraphy-multi angle laser light scattering[J]. Poly Mater Sci Engin, 2008, 24(10): 127. DOI:10.3321/j.issn:1000-7555.2008.10.033 |
| [38] |
戴晨伟, 徐洪耀, 杨捷, 等. GPC-多检测联用技术测定聚己内酯相对分子质量及其分布[J]. 化学分析计量, 2009, 18(1): 29. DAI CW, XU HY, YANG J, et al. Determination of polycaprolactone molecular weight and its distribution by GPC-multiple assay[J]. Chem Anal Meas, 2009, 18(1): 29. |
| [39] |
RATANATHANAWONGS SK, SHIUNDU PM, GIDDINGS JC. Size and compositional studies of coreshell latexes using flow and thermal field-flow fractionation[J]. Colloids Surf A Physicochem Eng Asp, 1995, 105: 243. DOI:10.1016/0927-7757(95)03315-7 |
| [40] |
SHIUNDU PM, WILLIAMS PS, GIDDINGS JC. Magnitude and direction of thermal diffusion of colloidal particles measured by thermal field-flow fraction[J]. J Colloid Interface Sci, 2003, 266: 366. DOI:10.1016/S0021-9797(03)00529-0 |
| [41] |
GIDDINGS JC. Field flow fractionation:separation and characterization of macromolecular colloidal, and particulate materials[J]. Science, 1993, 260: 1456. DOI:10.1126/science.8502990 |
| [42] |
张学军, 左春柽, 文伟力. 场流分离理论的研究现状及发展趋势[J]. 精细化工, 2005, 22(10): 773. ZHANG XJ, ZUO CC, WEN WL. Research status and development trend of field flow separation theory[J]. Fine Chem, 2005, 22(10): 773. DOI:10.3321/j.issn:1003-5214.2005.10.015 |
| [43] |
GIDDINGS JC. A new separation conceptbased on a coupling of concentration and flow nonuniformities[J]. Sep Sci, 1966, l1: 123. |
| [44] |
CALDWELL KD. Field-flow fractionation[J]. Anal Chem, 1988, 60A: 959. |
| [45] |
GALE BK, CALDWELL KD, FRAZIER AB. Geometric scaling effects in electrical field flow fractionation theoretical analysis[J]. Anal Chem, 2001, 73: 2345. DOI:10.1021/ac001463q |
| [46] |
吴春勇, 刘文英, 杭太俊, 等. 场流分级分离及其在多糖分析中的应用[J]. 中国药品标准, 2000, 1(2): 7. WU CY, LIU WY, HANG TJ, et al. Field Flow separation and its application in polysaccharide analysis[J]. Drug Stand China, 2000, 1(2): 7. |
| [47] |
XU J, RUE CA, SCHIMPF ME. Effect of channel orientation on thermal diffusion and polymer retention in thermal field-flow fractionation[J]. J Liq Chromatogr Relat Technol, 1997, 20(16-17): 2703. DOI:10.1080/10826079708005588 |
| [48] |
LOU J, MYERS MN, GIDDINGS JC. Separation of polysaccharides by thermal field-flow fractionation[J]. J Liq Chromatogr Relat Technol, 1994, 17(14-15): 3239. DOI:10.1080/10826079408013201 |
| [49] |
KIRLAND JJ, DILKS CH, REMENTER SW. Molecular weight distribution of water soluble polymers by flow field-flow fractionation[J]. Anal Chem, 1992, 64(11): 1295. DOI:10.1021/ac00035a018 |
| [50] |
WIJNHOVEN JEGJ, KOOM JP, POPPE H, et al. Infloence of injected mass and iome strength on retention of water soluble polymers and protems in hollow fibre flow field-flow fractionation[J]. J Chromatogr A, 1996, 732(2): 307. DOI:10.1016/0021-9673(95)01263-X |
| [51] |
ROESSNER D, KULICKE WM. On-line coupling of flow field-flow fractionation and multi-angle light scattering[J]. J Chromatogr A, 1994, 687(2): 249. DOI:10.1016/0021-9673(94)00818-3 |
| [52] |
于志勇. 非对称流场流技术在聚合物分析中的应用[J]. 高分子通报, 2008, 10(8): 65. YU ZY. Application of asymmetric flow field technique in polymer analysis[J]. Polym Bull, 2008, 10(8): 65. |
| [53] |
高立勤. 场流分离及其在大分子分离中的应用[J]. 国外医学药学分册, 1993, 20(5): 257. GAO LQ. Field flow separation and its application in macromolecule separation[J]. Foreign Med Sci, 1993, 20(5): 257. |
| [54] |
WITTGREN B, WAHLUND KG. Fast molecular mass and size characterization of polysaccharides using asymmetrical flow field flow fractionation-multiangle light scattering[J]. J Chromacogr A, 1997, 760(2): 205. DOI:10.1016/S0021-9673(96)00777-7 |
| [55] |
TAKAHASHI R, KUBOTA K, KAWADA M, et al. Effect of molecular weight distribution on the solution properties of sodium hyaluronate in solution[J]. Biopolymers, 1999, 50(1): 87. DOI:10.1002/(ISSN)1097-0282 |
 2018, Vol. 38
2018, Vol. 38 
