药品杂质限度控制是药物质量标准研究的重要内容。近年来,国际上对药物杂质的遗传毒性越来越重视,EMA、美国FDA等先后颁布了遗传毒性杂质(genotoxic impurities,GTIs)控制的指导原则[1-3],2014年,ICH正式发布了M7指导原则:为控制潜在的致癌风险的DNA反应性(致突变性)药物杂质的评价和控制,对具有DNA活性(致突变性)的杂质的控制提出了通用的要求,目前已在各成员国药品注册中使用[4]。根据国家药典会的研究项目安排,本实验室按照ICH M7指导原则的要求,采用(定量)构效关系计算机模型((Q)SAR)技术对中国药典2015年版二部中收载的已知杂质进行了筛查,发现2个分类为1类的杂质,分别为左羟丙哌嗪的杂质缩水甘油(glycidol)、羟苯磺酸钙的杂质Ⅰ(氢醌,hydroquinone),并结合其质控限度的合理性,对遗传毒性杂质的评价和控制进行分析。
1 (Q)SAR评价软件 1.1 Derek版本:Derek Nexus:5.0.1,数据库(Knowledge):Derek KB 2015 1.0,数据库版本:1.0,数据库日期:2015年12月7日,英国Lhasa公司研制(http://www.lhasalimited,org/)。
Derek是经典的SAR毒理学预测软件,可以对包括遗传毒性、致癌性等在内的59个毒理学预测终点进行评价,并提供触发的警戒结构信息。Derek作为基于专家知识的评价系统用于杂质遗传毒性预测,在EMA、美国FDA相关指导原则中均为被推荐的软件之一。Derek用于杂质遗传毒性预测,基本设置为:物种设为细菌,预测终点设置为遗传毒性项下的致突变性。
1.2 Sarah版本:Sarah Nexus:2.0.1,模型:Sarah Model 1.1.19,模型版本:2.0.1。英国Lhasa公司研制(http://www.lhasalimited,org/)。
Sarah是基于统计的(Q)SAR软件,主要是配合专家知识规则的软件,对药物杂质的致突变性进行预测。
1.3 Nexus版本Nexus:2.1.0,英国Lhasa公司(http://www.lhasalimited,org/)旗下Derek、Sarah、Vitic、Meteor、Zeneth等软件的整合平台。
在Nexus系统中,使用Derek和Sarah进行遗传毒性评价,也可以分别使用2个软件。同时,Nexus系统中已固化了组合的ICH M7模式(ICH M7 Prediction),并能够采用ICH M7分类模式(ICH M7 Batch Classifcation)对杂质遗传毒性进行预测和分类。
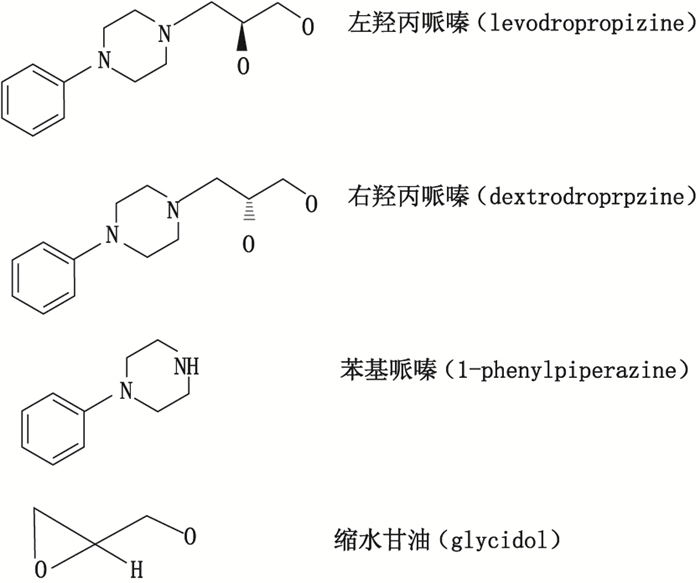
2 评价方法和结果 2.1 评价方法采用Chemdraw 12.0绘制药物活性成分(API)及杂质的化学结构图,分别为左羟丙哌嗪及其3个杂质右羟丙哌嗪、苯基哌嗪、缩水甘油(见图 1),羟苯磺酸钙及其杂质Ⅰ(氢醌)结构式(见图 2),输入Nexus 2.1.0(整合了Derek和Sarah等软件的综合软件)。
|
图 1 左羟丙哌嗪、右羟丙哌嗪、苯基哌嗪、缩水甘油结构 Figure 1 Structures of levodropropizine, dextrodropropzine, 1-phenyl-piperazine and glycidol |

|
图 2 羟苯磺酸钙、氢醌的结构 Figure 2 Structures of calcium dobesilate and hydroquinone |
采用ICH M7模式和ICH M7分类模式,对左羟丙哌嗪及3个杂质、羟苯磺酸钙及其杂质Ⅰ进行遗传毒性预测。
2.2 结果评价结果综合于表 1中。右羟丙哌嗪和苯基哌嗪Derek和Sarah预测结果均为阴性,分类为5类。缩水甘油Derek和Sarah预测结果均为阳性,ICH M7分类为1类。缩水甘油Derek预测触发的警戒结构为019环氧化物。在Sarah预测时,基于数据库中化合物结构精确匹配(已有文献资料)及表 2中所列3个支持性结构,缩水甘油遗传毒性阳性的可信度为100%。
|
|
表 1 杂质遗传毒性[Q]SAR预测结果 Table 1 [Q]SAR prediction summary for the genotoxicity of the impurities |
|
|
表 2 缩水甘油及氢醌Sarah阳性预测详细信息 Table 2 Sarah prediction details for the positive results of glycidol and hydroquinone |
氢醌Derek预测结果为阴性,Sarah预测结果为阳性,分类为1类。在Sarah预测时,基于数据库中化合物结构精确匹配(已有文献资料)及表 2中所列1个支持性结构,该化合物遗传毒性阳性的可信度为100%。
3 遗传毒性杂质控制的基本要求根据杂质的诱变性和致癌性以及其应控制的措施,ICH M7指导原则将药物杂质分为5类,见表 3。
|
|
表 3 ICH M7基于杂质遗传毒性和致癌性对杂质的分类和控制策略 Table 3 Impurity classification with respect to mutagenic and carcinogenic potential and resulting control actions(in ICH M7) |
对于遗传毒性杂质的控制,M7指导原则引入了TTC(a threshold of toxicological concern)的概念,一个具有遗传毒性的杂质,每人每天摄入1.5 μg时其风险被认为可以忽略(终生暴露的情况下理论的患癌风险小于十万分之一)[5]。一般长期用药(≥10年)的药物遗传毒性杂质,且无致癌试验数据(2类和3类),可以采用TTC作为默认的可以接受的标准。
根据TTC计算遗传毒性杂质限度公式如下(1 ppm相当于1 μg·g-1):
| $ {\rm{杂质限度(ppm) = }}\frac{{{\rm{TTC}}(1.5{\rm{ \mathsf{ μ} g}} \cdot {{\rm{d}}^{ - 1}})}}{{{\rm{每日剂量(g}} \cdot {{\rm{d}}^{ - 1}}{\rm{)}}}} $ |
另外,也可根据化合物特定的风险评估计算其可接受摄入量(acceptable intakes,AIs)。如对于有阳性致癌数据的杂质,可以采用线性计算方法;对于有实际阈值证据的遗传毒性杂质,可以根据其阈值计算日允许暴露量(permissible daily exposures,PDEs)等。2015年,ICH颁布了M7指导原则的增补(ICH M7 R1),对于15个(类)遗传毒性或致癌性明确的化合物进行了AIs或PDEs的计算和规定[6]。其中包括缩水甘油,根据其TD50计算AI为每天4 μg。
4 讨论采用(Q)SAR评价通过警戒结构(structural alerts)预测化合物的遗传毒性已经有30多年的历史[7]。ICH M7指导原则最显著的特点之一是引入了(Q)SAR评价的概念。对于杂质的遗传毒性评价,一般进行细菌的基因突变评价即可。M7指导原则中规定,应采用(Q)SAR技术对杂质毒性进行计算机评价,以预测细菌基因突变的结果。对于2B和3期临床试验的药品,申报时要提供一份(Q)SAR评估的杂质清单,所有实际存在或潜在的1、2、3类要提供控制方案。
不同于EMA和美国FDA以前对于遗传毒性杂质评价的要求,ICH M7要求使用两类互补的(Q)SAR评价体系,一类是基于专家知识规则的,另一类是基于统计学的。如果2个互补的(Q)SAR评价体系均没有发现警戒结构(评价结果为阴性),则足以说明该杂质没有遗传毒性,不需要进一步检测。无论哪类软件预测提示有警戒结构,均需要按照指导原则的程序进行杂质分类和控制。但可以经有经验的专家对(Q)SAR结果进行评价和解读,甚至推翻其结论[8]。ICH M7是目前唯一将(Q)SAR评价结果作为以注册为目的的申报资料的最终结论的法规性文件。已有研究对包括Derek、Sarah等软件组合的预测效果进行评价[9-10],Derek和Sarah的组合符合OECD的认证体系,并为美国FDA等认可。
本次评价发现的2个遗传毒性阳性的杂质,实际上均为明确的致突变或致癌物质。缩水甘油,CAS号为000556-52-5,2000年被世界卫生组织下属的国际癌症研究所(IARC)列为2A类致癌物[11, 12]。氢醌(hydroquinone),CAS号为000123-31-9,1999年被IARC列为3类致癌物[13]。两者采用符合ICH M7指导原则的[Q]SAR模型评价结果均为阳性,且分类为1类,因此其质控限度应严格按照遗传毒性杂质的限度制定。
缩水甘油作为左羟丙哌嗪的杂质,左羟丙哌嗪为镇咳药[14],收载于中国药典2015年版二部和欧洲药典8.0,作为有关物质的限度分别为5 μg·g-1和10 μg·g-1[15]156,[16]2610。根据药品说明书,本品临床每日最大用量为180 mg(每次60 mg,每日3次)。按照上述标准,每日暴露量为0.9 μg(中国药典)和1.8 μg(欧洲药典),均低于ICH M7指导原则补充件规定的4 μg,因此其限度制定是合理的。
氢醌作为羟苯磺酸钙的杂质,羟苯磺酸钙为毛细血管保护药[17],也收载于中国药典2015年版二部和欧洲药典8.0,作为有关物质的限度均为0.1%[15]1225,[16]1733。本品临床1 d最大用量为3 g(每次1 g,每日3次)。按0.1%计算,每日暴露量为3 mg,该暴露量较高,存在较大的安全隐患,因此,建议从严修订羟苯磺酸钙中杂质Ⅰ(氢醌)的限值。如参考TTC(1.5 μg·d-1)计算的限值,为0.5 ppm(μg·g-1)。但TTC是一个高度保守的暴露量,另外,TTC一般用于2类、3类杂质的控制。对于1类杂质,一般通过文献资料或实验研究,提供充分的实验证据,根据其作用机制、50%致癌剂量(TD50)、最大无毒剂量(NOEL)等数据计算可以接受的暴露量,然后计算杂质质量标准的限值。根据NIH公开的氢醌致癌性资料,氢醌致癌性TD50为大鼠82.8 mg·kg-1·d-1、小鼠225 mg·kg-1·d-1[18]。按照ICH M7(R1)推荐的可接受摄入量(AI)计算公式[6]:
| $ {\rm{AI}} = {\rm{T}}{{\rm{D}}_{50}}/50\;000 \times 50{\rm{kg}} $ |
以82.8 mg·kg-1·d-1计算氢醌AI为82.8 μg·d-1,对应杂质限度为27.6 ppm(μg·g-1),因此,建议修订羟苯磺酸钙中杂质Ⅰ(氢醌)的限值为30 ppm(μg·g-1)。当然,过于严格的标准会增加生产工艺的难度,提高生产成本,对于致突变杂质的控制还要考虑生产工艺和检测方法的可行性。
| [1] |
EMA. EUROPEAN MEDICINES AGENCY(EMA). Guideline on the Limits of Genotoxic Impurities[EB/OL]. 2006. [2017-05-18]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf
|
| [2] |
EUROPEAN MEDICINES AGENCY(EMA). Question & Answers on the CHMP Guideline on the Limits of Genotoxic Impurities[EB/OL]. 2010. [2017-05-18]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002907.pdf
|
| [3] |
FDA. U. S. FOOD AND DRUG ADMINISTRATION(FDA). DRAFT guidance for industry. Genotoxic and carcinogenic impurities in drug substances and products: recommended approaches[EB/OL]. 2008. [Withdrawn].
|
| [4] |
ICH. M7: assessment and control of DNA reactive(mutagenic)impurities in pharmaceuticals to limit potential carcinogenic risk[EB/OL]. 2014. [2017-05-18]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/M7_Step_4.pdf
|
| [5] |
KROES R, KLEINERE J, RENWICK A. The threshold of toxicological concern concept in risk assessment[J]. Toxicol Sci, 2005, 86(2): 226. DOI:10.1093/toxsci/kfi169 |
| [6] |
ICH. ADDENDUM TO ICH M7: assessment and control of DNA reactive(mutagenic)impurities in pharmaceuticals to limit potential carcinogenic risk[EB/OL]. 2015. [2017-05-18]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/M7_Addendum_Step_2.pdf
|
| [7] |
ASHBY J, TENNANT RW. Definitive relationships among chemical structure, carcinogenicity and mutagenicity for 301 chemicals tested by the U.S.NTP[J]. Mutat Res, 1991, 257(3): 229. DOI:10.1016/0165-1110(91)90003-E |
| [8] |
POWLEY MW. (Q)SAR assessments of potentially mutagenic impurities:a regulatory perspective on the utility of expert knowledge and data submission[J]. Regul Toxicol Pharmacol, 2015, 71(2): 295. DOI:10.1016/j.yrtph.2014.12.012 |
| [9] |
SUTTER A, AMBERG A, BOYET S, et al. Use of in silico systems and expert knowledge for structurebased assessment of potentially mutagenic impurities[J]. Regul Toxicol Pharmacol, 2013, 67(1): 39. DOI:10.1016/j.yrtph.2013.05.001 |
| [10] |
GREENE N, DOBO KL, KENYON MO, et al. A practical application of two in silico systems for identification of potentially mutagenic impurities[J]. Regul Toxicol Pharmacol, 2015, 72(2): 335. DOI:10.1016/j.yrtph.2015.05.008 |
| [11] |
IARC, Glycidol Some Industrial Chemicals. IARC Monographs on the Evaluation of Carcinogenic Risk of Chemicals to Humans, Vol 77[R], France, 2000: 469
|
| [12] |
AASA J, VARE D, HITESH VM, et al. Quantification of the mutagenic potency and repair of glycidol-induced DNA lesions[J]. Mutation Res, 2016, 805(7): 38. |
| [13] |
McGREGOR D. Hydroquinone:an evaluation of the human risks from its carcinogenic and mutagenic properties[J]. Crit Rev Toxicol, 2007, 37(10): 887. DOI:10.1080/10408440701638970 |
| [14] |
ZANASI A, LANATA L, FONTANA G, et al. Levodropropizine for treating cough in adults and children:a meta-analysis of published studies[J]. Multidiscip Resp Med, 2015, 10(1): 19. DOI:10.1186/s40248-015-0014-3 |
| [15] |
中国药典2015年版. 二部[S]. 2015: 158, 1225 ChP 2015. Vol Ⅱ[S]. 2015: 158, 1225 |
| [16] |
EP 8. 0[S]. 2014: 2610, 1733
|
| [17] |
RABEL E, BALLARINI S, LEHR L. A randomized, double-blind, placebo-controlled, clinical study on the efficacy and safety of calcium dobesilate in the treatment of chronic venous insufficiency[J]. Phlebology, 2016, 31(4): 264. DOI:10.1177/0268355515586097 |
| [18] |
NIH Hydroquinone: Carcinogenic Potency Database[EB/OL]. 2007. [2017-09-8]. https://toxnet.nlm.nih.gov/cpdb/chempages/HYDROQUINONE.html
|
 2018, Vol. 38
2018, Vol. 38