2. 安捷伦科(中国)有限公司, 上海 200085
2. Agilent Scientific Company, Shanghai 200085, China
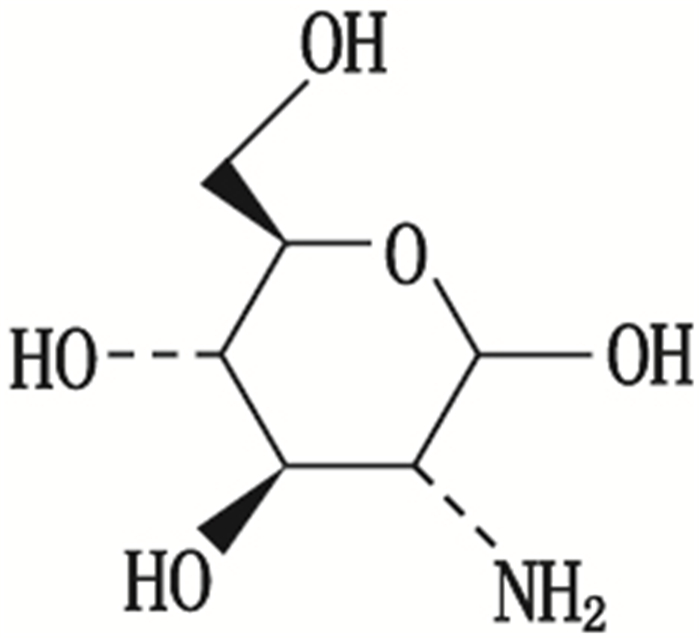
氨基葡萄糖能刺激软骨细胞中胶原蛋白的生长,从而帮助修复和维护软骨,在临床上主要用于预防和治疗各种类型的骨性关节炎。氨基葡萄糖结构式见图 1,是葡萄糖的1个羟基被1个氨基取代的化合物,存在α和β 2种异构体。由于氨基葡萄糖不稳定,被制成盐酸盐或者硫酸盐复盐以延长其稳定性,国内外市场上主要有盐酸氨基葡萄糖、硫酸氨基葡萄糖氯化钠和硫酸氨基葡萄糖氯化钾,剂型包括片剂、胶囊、颗粒、散剂和泡腾片等。
|
图 1 氨基葡萄糖的结构式 Figure 1 Structure of glucosamine |
文献报道氨基葡萄糖含量测定的方法主要包括:乙酰丙酮比色法[1]、衍生-HPLC[2-8]、HPLC-蒸发光散射检测器法[9]、HPLC-示差检测器法[10]、离子色谱法[11-13]、毛细管电泳法[14]、HPLC-紫外检测器法[15-19]等。目前国内外药典和标准中收载的氨基葡萄糖含量测定方法,国家药品标准WS1-XG-028-2001采用乙酰丙酮比色法测定;进口药品注册标准JX20030178、JX20050101、JX20130277和国家食品药品监督管理局标准YBH11442006均采用HPLC-紫外检测器法测定,C8/C18色谱柱,磷酸盐缓冲液-乙腈为流动相;USP39[20]中盐酸氨基葡萄糖、盐酸氨基葡萄糖片、硫酸氨基葡萄糖氯化钾、硫酸氨基葡萄糖氯化钠品种项下均为高效液相-紫外检测器法测定,氨基柱,磷酸盐缓冲液-乙腈为流动相;进口药品注册标准JX20090053和USP39[20]中氨基葡萄糖硫酸钠软骨素品种项下采用邻苯二醛柱前衍生-HPLC测定。
日常工作中发现,进口药品注册标准JX20030178采用HPLC-紫外检测器法测定氨基葡萄糖含量,C8色谱柱,磷酸盐缓冲液(pH 3.0)-乙腈(80:20,v/v)为流动相,主峰约在6分钟出峰(0.5 mL·min-1),在25 cm长的C8色谱柱上几乎无保留,通过与等摩尔浓度的氯化钠溶液的色谱图比对,发现该色谱主峰可能为氯离子峰。查阅文献发现该推测已有类似报道[4, 16-17, 21],但晓梦[21]在其硕士研究论文中对氨基葡萄糖类药物的含量测定方法进行了详尽的研究,认为国内现行标准中分离模式和检测器选择不当,导致误将氨基葡萄糖的成盐离子错当活性基团进行测定,该方法存在严重缺陷,不具专属性。文献[4, 16-17, 21]主要通过相对保留时间定位推测氨基葡萄糖液相色谱测定的主峰为氯离子,认为氨基葡萄糖没有吸收或出峰位置与主峰重叠,但是实验结果有待质谱[22-23]来进一步确认。目前尚无文献采用质谱对氨基葡萄糖峰和氯离子峰的出峰位置和结构进行确认。
由于氨基葡萄糖液相含量测定方法中采用磷酸盐为流动相,不适用于直接进行LC-MS分析。二维液相色谱-质谱联用技术通过在线联用的自动化操作,可在第一维HPLC体系中使用质谱不兼容流动相(如磷酸盐系统)对药品进行分析,通过柱切换技术实现对组分的捕集和脱盐,并转移至第二维HPLC中,进质谱仪,使用合适的流动相进行组分的结构分析[24]。本研究采用在线2D-LC-QTOF MS对进口药品注册标准JX20030178的含量测定方法中3个色谱峰进行了结构分析,解决了该色谱体系中使用质谱不兼容流动相从而不适用于直接进行MS分析的难题,同时确定了氨基葡萄糖液相色谱测定的主峰为氯离子,确定了氨基葡萄糖的出峰位置。
1 仪器与试药Agilent公司1290 Infinity 2D-LCQ-TOF液-质联用仪;梅特勒-托多利公司XS205型电子天平;岛津公司Inertsil C8-3(辛烷基硅烷键合硅胶;250 mm×4.6 mm,5 μm)色谱柱,Agilent公司Poroshell120 EC-C18(十八烷基硅烷键合硅胶;3.0 mm×100 mm,2.7 μm)色谱柱。质谱数据软件为MassHunter(软件版本B07)。
硫酸氨基葡萄糖氯化钠(批号:1400294,含量100%,干燥失重0.2%,Rottapharm公司);盐酸氨基葡萄糖(批号:CRS160106A,含量100%,Bioiberica公司);乙腈和甲酸为色谱级,氯化钠、硫酸钠、氢氧化钾和磷酸为分析纯,水为去离子水。
2 方法与结果 2.1 溶液配制 2.1.1 供试品溶液分别称取硫酸氨基葡萄糖氯化钠约62 mg、盐酸氨基葡萄糖约46 mg、硫酸钠约31 mg和氯化钠约12 mg,各置于10 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得。
2.1.2 氢氧化钾试液取氢氧化钾6.5 g,加水溶解并稀释至100 mL。
2.1.3 磷酸盐缓冲液(pH 3.0)取磷酸1 mL,加水至2 000 mL,用氢氧化钾试液调节pH至3.0。
2.2 色谱与质谱条件一维色谱条件:采用Inertsil C8-3(250 mm×4.6 mm,5 μm)色谱柱,以磷酸盐缓冲液(pH 3.0)-乙腈(80:20,v/v)为流动相,流速0.5 mL·min-1,检测波长为195 nm,柱温30 ℃,进样量20 μL。二维色谱条件:采用Poroshell120 EC-C18(100 mm×3.0 mm,2.7 mm)色谱柱,以0.1%(v/v)甲酸水溶液为流动相A,以0.1%(v/v)甲酸乙腈溶液为流动相B,流速0.3 mL·min-1。质谱检测采用Dual AJS ESI电离源,毛细管电压3.0 kV,干燥气温度300 ℃,鞘气温度350 ℃,干燥气流速10 L·min-1,鞘气流速12 L·min-1,雾化气压力241 kPa。
第一维HPLC紫外色谱图中观测到组分的出峰位置后,分别对每个组分进行中心切割,通过设置阀切换时间,将组分捕集至40 μL定量环中。再通过阀切换将组分从样品环上反冲至第二维HPLC色谱柱上分离,最后进入质谱进行分析。四极杆-飞行时间质谱仪采用MS Scan采集模式,得到一级质谱。使用软件通过精确分子量和同位素分布进行元素组成分析,确定分子式,并结合第一维HPLC保留时间定位和配制梯度浓度的溶液,共同确定3个组分的结构。
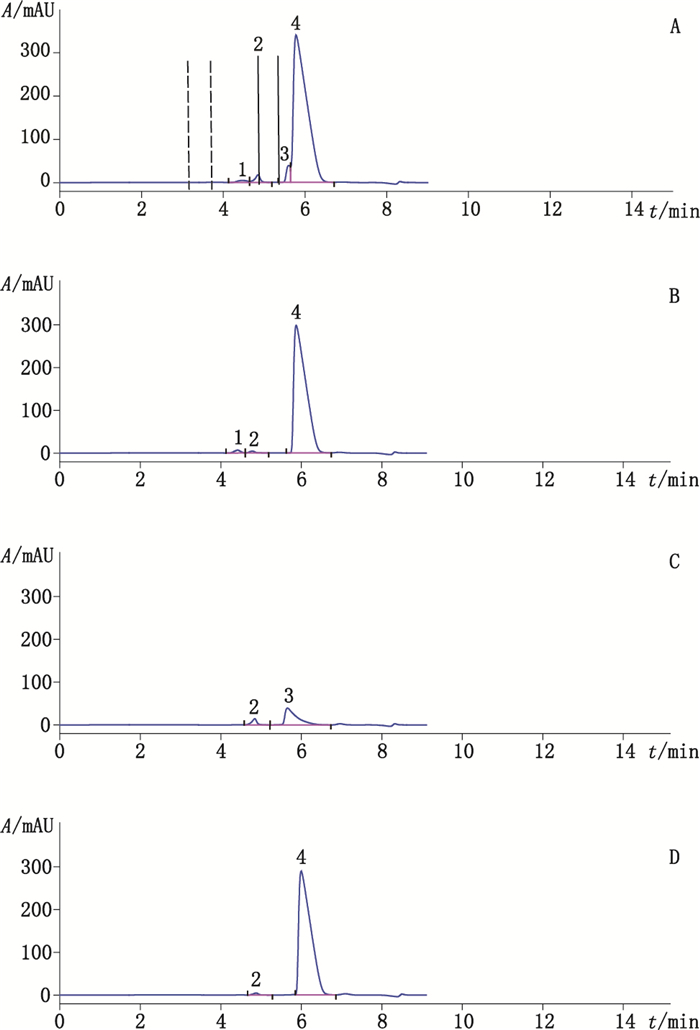
2.3 第一维HPLC分析第一维色谱图见图 2,含有基本相同摩尔浓度氯离子的硫酸氨基葡萄糖氯化钠溶液、盐酸氨基葡萄糖溶液和氯化钠溶液中均在5.8~5.9 min出现1个色谱峰,且峰面积大小基本相同,该色谱峰可能为氯离子。含有基本相同摩尔浓度硫酸根离子的硫酸氨基葡萄糖氯化钠溶液和硫酸钠溶液中均在5.6 min出现1个色谱峰,该色谱峰可能为硫酸根离子。含有基本相同摩尔浓度的氨基葡萄糖的硫酸氨基葡萄糖氯化钠溶液和盐酸氨基葡萄糖溶液,均在4.3~4.4 min出现1个色谱峰,该色谱峰可能为氨基葡萄糖。分别将图 2中3个色谱峰(分别为峰1、峰3、峰4)从第一维HPLC色谱系统中切入第二维HPLC色谱,进行MS分析。
|
A.硫酸氨基葡萄糖氯化钠溶液(glucosamine sulfate sodium chloride solution)B.盐酸氨基葡萄糖溶液(glucosamine hydrochloride solution)C.硫酸钠溶液(sodium sulfate solution)D.氯化钠溶液(sodium chloride solution) 图 2 第一维液相色谱图 Figure 2 The first dimensional chromatography spectra |
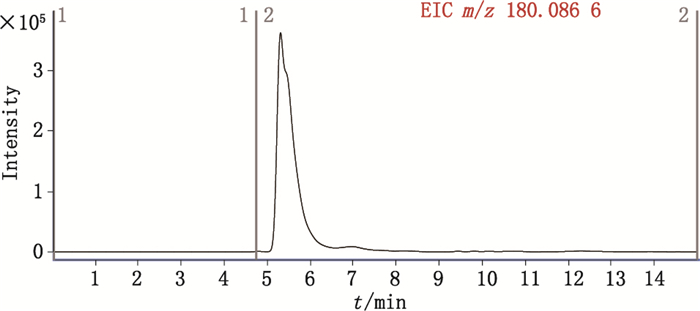
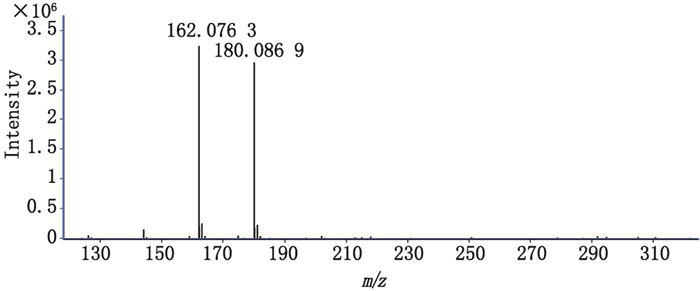
图 3为峰1(原位于图 2-A两虚线所示位置)进行中心切割后得到的提取离子流图。图 4为峰1测得的质谱精确质量数,分别与氨基葡萄糖阳离子[M+H]+的理论精确质量数(m/z 180.086 7)及氨基葡萄糖阳离子脱水后碎片[M+H-H2O]+的理论精确质量数(m/z 162.076 1)相基本一致,可知其分子式为C6H13NO5,即峰1为氨基葡萄糖,结构如图 1所示。
|
图 3 峰1切入第二维HPLC色谱后的提取总离子流图 Figure 3 The extract total ion chromatogram of peak 1 in second dimensional HPLC. |
|
图 4 峰1的一级质谱图 Figure 4 MS spectrum of peak 1 |
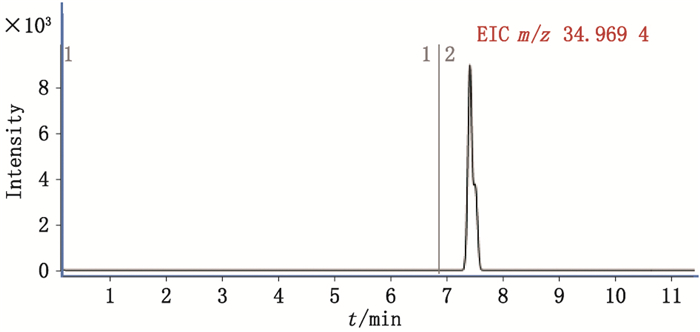
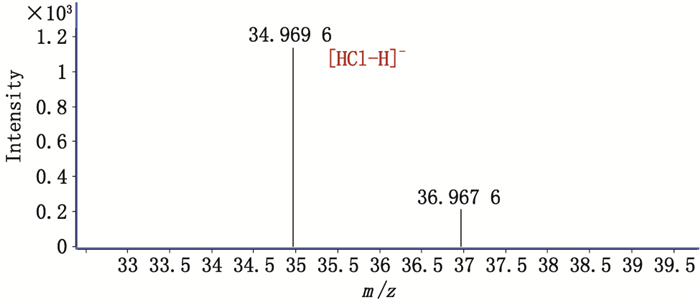
图 5为峰4(原位于图 2-A两实线所示位置)进行中心切割后得到的提取离子流图。图 6为峰4测得的质谱精确质量数,分别与氯离子同位素的理论精确质量数(34.968 9和36.965 9)基本一致,可知峰4为氯离子。同理确定峰3为硫酸根。
|
图 5 峰4切入第二维HPLC色谱后的提取总离子流图 Figure 5 The extract total ion chromatogram of peak 4 in second dimensional HPLC |
|
图 6 峰4的一级质谱图 Figure 6 MS spectrum of peak 4 |
组分结构确认结果表明,第一维HPLC测定的主峰为氯离子,氯离子峰前面为硫酸根离子,且两峰有一定的重叠,氨基葡萄糖出峰时间在两离子之前,且在195 nm波长下的吸光度值较低,检测灵敏度低,按照标准JX20030178方法样品浓度为0.5 mg·mL-1时,该色谱系统中几乎不能检出,本文使用样品中氨基葡萄糖浓度3.8 mg·mL-1,参考了USP39版[20]。
3 讨论 3.1 2D-LC-QTOF MS方法的选择和构建当HPLC中使用了不挥发盐而不适用于直接进行MS分析时,传统的解决方案为收集HPLC色谱馏分,对馏分进行脱盐处理后质谱分析。该方法操作烦琐,且对于低含量组分需要进行多次收集,大大增加了工作量,同时收集馏分和脱盐等处理过程组分容易损失或被破坏,实验结果不确定性增加。而二维液相色谱-质谱联用技术可回避上述缺陷,通过在线联用的自动化操作,可在第一维HPLC色谱体系中使用质谱不兼容流动相(如磷酸盐系统)对药品进行分析,通过阀切换技术实现对组分的捕集和脱盐,并转移至第二维HPLC色谱体系中,进质谱仪,使用合适的流动相进行组分结构分析[24]。
本文在原有液相色谱仪的基础上增加了另一个四元泵、一个质谱检测器和一个内置了2位-6通阀的柱温箱,实现了在线2D-LC-QTOF MS。第一维HPLC和第二维HPLC均为反相液相色谱(RPLC),不需要进行分离模式之间的转换。实现第一维HPLC组分的捕集和脱盐,并在第二维HPLC使用与质谱兼容的流动相的关键在于阀切换技术。由于不需要对色谱峰进行定量,因此选取色谱峰中间一点进行中心切割,用小体积样品环进行捕集,然后再通过阀切换将色谱峰冲洗至第二维反相柱进行质谱分析。
3.2 氨基葡萄糖含量测定方法进口药品注册标准JX20030178、JX20050101、JX20130277和国家食品药品监督管理局标准YBH11442006均采用HPLC-紫外检测器法测定氨基葡萄糖含量,主要区别在于采用C8或C18色谱柱,以及流动相缓冲液和有机相的比例稍有差异,但是HPLC的分离原理基本相同。因此与进口药品注册标准JX20030178类似,以上进口药品注册标准和国家药品标准的含量测定方法测定的主峰均为氯离子,而非其活性组分氨基葡萄糖,方法不具有专属性。且标准中针对氨基葡萄糖的特征鉴别反应为液相色谱法,测定的主峰为氯离子,也就是说整个标准中完全没有针对氨基葡萄糖的控制项目,完全不能控制药品的有效性,存在极大掺伪可能,这些标准均亟需改进和提高。关于氨基葡萄糖液相含量测定方法,可以参考USP39版[20]和文献[16]方法采用的氨基柱同时加大供试品溶液的浓度,氨基酸的固定相能保留极性小分子,因此增加了氨基葡萄糖在色谱柱上的保留。也可以参考进口药品注册标准JX20090053和文献柱前衍生高效液相色谱法[2-8]对氨基葡萄糖进行含量测定,随着自动衍生化方法的发展,衍生化前处理越来越简便且精密度良好,但是采用该方法需要注意一点,由于氨基葡萄糖存在α和β 2种异构体经衍生后HPLC法分离出现2个色谱峰,计算时应采用两峰峰面积之和。
4 结论本研究采用二维液相色谱-质谱联用技术有效地解决了氨基葡萄糖液相含量测定方法中采用不挥发性磷酸盐而不适用于进行LC-MS分析组分结构的难题,确定了进口药品注册标准JX20030178含量测定方法测定的主峰结构以及文献[4, 16-17, 21]关于氨基葡萄糖HPLC测定的主峰为氯离子的推断结果,并且找到了氨基葡萄糖的出峰位置,文献[16, 21]关于氨基葡萄糖峰与主峰氯离子重合的推断有误,且发现当样品中含有硫酸根离子时,硫酸根离子紧邻氯离子出峰有部分重叠。
| [1] |
王英瑛, 李俊, 曾苏. 氨基葡萄糖3种含量测定方法的比较[J]. 中国现代应用药学杂志, 2009, 26(4): 307. WANG YY, LI J, ZENG S. The comparison of three determination methods of glucosamine[J]. Chin J Mod Appl Pharm, 2009, 26(4): 307. |
| [2] |
刘利萍, 章非凡, 张阳, 等. HPLC测定盐酸氨基葡萄糖的柱前衍生化条件的相应面优化[J]. 营养学报, 2013, 35(4): 387. LIU LP, ZHANG FF, ZHANG Y, et al. Response surface optimization of pre-column derivatization for HPLC determination of the content of glucosamine hydrochloride[J]. Acta Nutr Sin, 2013, 35(4): 387. |
| [3] |
狄平平, 劳苑子, 赵立平, 等. HPLC法测定复方氨基葡萄糖片中盐酸氨基葡萄糖和硫酸软骨素含量[J]. 中国药事, 2010, 24(3): 283. DI PP, LAO YZ, ZHAO LP, et al. Determination of glucosamine hydrochloride and chondroitin sulfate in tablets by HPLC[J]. Chin Pharm Aff, 2010, 24(3): 283. |
| [4] |
黄鑫, 陈清松, 许建中, 等. 反向高效液相色谱法测定氨基葡萄糖硫酸盐[J]. 福建师范大学学报, 2009, 25(3): 80. HUANG X, CHEN QS, XU JZ, et al. Determination of the content of glucosamine sulfate by RP-HPLC[J]. J Fujian Normal Univ, 2009, 25(3): 80. |
| [5] |
翟志雷, 杨瑞春, 王爱月. OPA柱前衍生-高效液相色谱法测定氨基葡萄糖[J]. 中国卫生检验杂志, 2010, 20(6): 1380. ZAI ZL, YANG RC, WANG AY. Method for determination of glucosamine by HPLC system with o-phthaldialdehyde precolumn derivatization[J]. Chin J Health Lab Technol, 2010, 20(6): 1380. |
| [6] |
初立梅, 徐家根, 霍立茹. 高效液相色谱法测定硫酸氨基葡萄糖泡腾片中硫酸氨基葡萄糖含量[J]. 儿科药学杂志, 2012, 18(3): 40. CU LM, XU JG, HUO LR. RP-HPLC determination of glucosamine sulfate in glucosamine sulfate effervescent tablets[J]. JP Ediatric Pharm, 2012, 18(3): 40. |
| [7] |
廖栩, 王淑君, 佟岩, 等. 柱前衍生化法测定盐酸氨基葡萄糖软膏的含量[J]. 沈阳药科大学学报, 2011, 28(5): 380. LIAO X, WANG SJ, TONG Y, et al. Determination of the content of glucosamine hydrochloride in glucosamine hydrochloride ointment by pre-column derivatization RP-HPLC[J]. J Shenyang Pharm Univ, 2011, 28(5): 380. |
| [8] |
万慧芳, 万欢, 汪华杰. 盐酸氨基葡萄糖反相高效液相色谱法含量测定方法研究[J]. 南昌大学学报, 2010, 50(5): 96. WAN HF, WAN H, WANG HJ. Determination of glucosamine hydrochloride by RP-HPLC[J]. J Nanchang Univ, 2010, 50(5): 96. |
| [9] |
洪专, 黄宏南, 许晨, 等. HPLC-ELSD测定氨基葡萄糖含量[J]. 中国卫生检验杂志, 2007, 17(6): 1025. HONG Z, HUANG HN, XU C, et al. Studies on the determination of glucosamine by HPLC-ELSD[J]. ChinJ Health Lab Technol, 2007, 17(6): 1025. |
| [10] |
姜红, 但晓梦, 胡远华, 等. HPLC-RID法测定氨基葡萄糖含量[J]. 中国药品标, 2013, 14(4): 259. JIANG H, DAN XM, HU YH, et al. Determination of the content of glucosamine hydrochloride by HPLC-RID[J]. Drug Stand China, 2013, 14(4): 259. |
| [11] |
沈国, 许建中, 唐旭, 等. 高效离子色谱法测定氨基葡萄糖类化合物[J]. 中国卫生检验杂志, 2010, 20(3): 495. SHEN G, XU JZ, TANG X, et al. Determination of glucosamine compounds by high-performance ion chromatography[J]. Chin J Health Lab Technol, 2010, 20(3): 495. |
| [12] |
张思维, 郑波, 邹晓丽, 等. 高效阴离子色谱法测定保健食品中的盐酸氨基葡萄糖[J]. 色谱, 2009, 27(1): 117. ZHANG SW, ZHENG B, ZOU XL, et al. Determination of glucosamine hydrochloride in health foods using high performance anion exchange chromatography[J]. Chin J Chromatogr, 2009, 27(1): 117. |
| [13] |
甘宾宾, 刘展华, 黎少豪. HPLC法测定保健食品中盐酸氨基葡萄糖含量的研究[J]. 中国食品卫生杂志, 2011, 23(6): 531. GAN BB, LIU ZH, LI SH. Determination of glucosamine hydrochloride in health food by HPLC[J]. ChinJ Food Hyg, 2011, 23(6): 531. |
| [14] |
张佳蕊, 何志一, 尹燕杰. 毛细管电泳间接紫外检测法测定氨基葡萄糖制剂的含量[J]. 黑龙江医药, 2013, 26(3): 353. ZHANG JR, HE ZY, YIN YJ. Determination of glucosamine preparation content by capillary electrophoresis indirect uv method[J]. Heilongjiang Med J, 2013, 26(3): 353. |
| [15] |
杨岚, 李铜铃, 黄婷, 等. RP-HPLC测定盐酸氨基葡萄糖片的含量[J]. 华西药学杂志, 2005, 20(3): 259. YANG L, LI TL, HUANG T, et al. Determination of the content of glucosamine hydrochloride tablet by RP-HPLC[J]. West China J Pharm Sci, 2005, 20(3): 259. |
| [16] |
罗立, 但汉雄. 氨基柱HPLC法测定盐酸氨基葡萄糖及其制剂的含量[J]. 中国药师, 2016, 19(2): 387. LUO L, DAN HX. Content determination of glucosamine hydrochloride and its preparation by HPLC[J]. China Pharm, 2016, 19(2): 387. |
| [17] |
曾茂法, 李俊, 王英瑛, 等. D-氨基葡萄糖硫酸钾盐含量测定方法探讨[J]. 中国现代应用药学杂志, 2008, 25(3): 251. ZENG MF, LI J, WANG YY, et al. Discussion on assay method of D-glucosamine sulfate potassium chloride[J]. Chin J Mod Appl Pharm, 2008, 25(3): 251. |
| [18] |
刘升涛, 李师, 尹鸿萍, 等. 高效液相色谱法测定氨基葡萄糖中的乙酰氨基葡萄糖[J]. 药物分析杂志, 2015, 35(5): 900. LIU ST, LI S, YIN HP, et al. Determination of acetylglucosamine in glucosamine by HPLC[J]. Chin J Pharm Anal, 2015, 35(5): 900. |
| [19] |
杨华良, 雷勇胜. HPLC法测定盐酸氨基葡萄糖颗粒中盐酸氨基葡萄糖的含量[J]. 天津药学, 2011, 23(6): 17. YANG HL, LEI YS. Determination the content of glucosamine hydrochloride in glucosamine hydrochloride granule by HPLC[J]. Tianjin Pharm, 2011, 23(6): 17. |
| [20] |
USP 39[S]. 2016: 6677
|
| [21] |
但晓梦. 氨基葡萄糖类药物质量控制研究[D]. 武汉: 华中科技大学, 2012 DAN XM. The Research in Quality Control of Glucosamine Drugs[D]. Wuhan: Huangzhong University of Science and Technology, 2012 |
| [22] |
陈伟珠, 张怡评, 方华, 等. 硫酸氨基葡萄糖标准样品的研制[J]. 化学分析计量, 2015, 24(2): 1. CHEN WZ, ZHANG YP, FANG H, et al. Development of glucosamine sulfate certified reference material[J]. Chem Anal Mete, 2015, 24(2): 1. |
| [23] |
张华珺, 张喆, 张蓉. 氨基葡萄糖液相色谱-质谱联用含量测定方法研究[J]. 中国卫生检验杂志, 2013, 23(5): 1148. ZAHNG HJ, ZHANG Z, ZHANG R. A study on the determination of glucosamine by liquid chromatography-mass spectrometry[J]. Chin J Health Lab Technol, 2013, 23(5): 1148. |
| [24] |
裘亚, 秦峰, 闻宏亮, 等. 在线二维液相色谱-四级杆飞行时间质谱法检测头孢噻吩钠的杂质谱[J]. 色谱, 2015, 33(12): 1314. QIU Y, QIN F, WEN HL, et al. Impurity profile study of cefalotin sodium by two-dimensional liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Chin J Chromatogr, 2015, 33(12): 1314. |
 2018, Vol. 38
2018, Vol. 38 
